Азот субоксид
Азот оксид (динитроген оксид или динитроген моноксид)[4] — хемиско соединение, азотен оксид со формула N2O. На собна температура, тој е безбоен незапалив гас и има малку сладок мирис и вкус.[5] При покачени температури, азотниот оксид е моќен оксидатор сличен на молекуларниот кислород.
| |

| |
| Систематско име | Oxodiazen-2-ium-1-ide |
Други називи Гас за смеење, протоксид на азот, хипонитрозен оксид, динитроген оксид, динитроген моноксид | |
| Назнаки | |
|---|---|
| 10024-97-2 | |
| Бајлштајн | 8137358 |
| ChEBI | CHEBI:17045 |
| ChEMBL | ChEMBL1234579 |
| ChemSpider | 923 |
| DrugBank | DB06690 |
| 2153410 | |
| |
| 3Д-модел (Jmol) | Слика Слика |
| KEGG | D00102 |
| PubChem | 948 |
| RTECS-бр. | QX1350000 |
| |
| UNII | K50XQU1029 |
| ОН-бр. | 1070 (compressed) 2201 (liquid) |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | безбоен гас |
| Густина | 1,977 g/L (gas) |
| Точка на топење | |
| Точка на вриење | |
| 1,5 g/L (15 °C) | |
| Растворливост | растворлив во алкохол, етер, сулфурна киселина |
| log P | 0,35 |
| Парен притисок | 5150 kPa (20 °C) |
| −18,9·10−6 cm3/mol | |
| Показател на прекршување (nD) | 1,000516 (0 °C; 101,325 kPa) |
| Вискозност | 14,90 μPa·s[3] |
| Структура | |
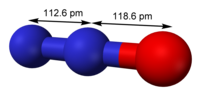
| Геометрија на молекулата | линеарно, C∞v |
| Диполен момент | 0,166 D |
| Термохемија | |
| Ст. енталпија на образување ΔfH |
+82,05 kJ/mol |
| Стандардна моларна ентропија S |
219,96 J/(K·mol) |
| Pharmacology | |
| ATC код | N01AX13 |
| вдишување | |
| Фармакокинетика: | |
| 0,004% | |
| 5 минути | |
| Респираторно | |
| Опасност | |
| GHS-ознаки: | |
Пиктограми
|
  
|
| NFPA 704 | |
| Температура на запалување | Незапалив |
| Безбедносен лист | Ilo.org, ICSC 0067 |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Азотниот оксид има значителна медицинска употреба, особено во хирургијата и стоматологијата, поради неговите анестетички својства и намалување на болката.[6] Неговото колоквијално име „гас за смеење“, измислено од Хамфри Дејви, се должи на еуфоричните ефекти при неговото вдишување, својство што довело до негова рекреативна употреба како дисоцијативен анестетик.[6] Се наоѓа на списокот на есенцијални лекови на Светската здравствена организација.[7] Исто така се користи како оксидатор во ракетни погони и во моторни трки за зголемување на моќноста на моторите.
Атмосферската концентрација на азотен оксид достигнала 333 делови на милијарда (ppb) во 2020 година, зголемувајќи се со стапка од околу 1 ppb годишно.[8][9] Тој е главен чистач на стратосферскиот озон, со влијание споредливо со влијанието на хлорофлуоројаглеродот.[10] Глобалната застапеност на N2O покажува дека околу 40% од просечните 17 TgN/година (тераграми или милиони метрички тони азот годишно) емисии потекнуваат од човековата активност и покажува дека растот на емисиите главно доаѓа од проширувањето на земјоделството и индустриските извори во економиите во развој.[11][12] Како трет најважен долготраен стакленички гас, азотен оксид, исто така, значително придонесува за глобалното затоплување.[13][14]
Азотниот оксид се користи како погонско гориво и има различни примени од ракетирање до правење шлаг. Се користи како рекреативна дрога; повеќето рекреативни корисници не се свесни за неговата невротоксичност и потенцијалот да предизвика невролошки оштетувања.
Употреба
уредиРакетни мотори
уредиАзотниот оксид може да се користи како оксидатор во ракетниот мотор. Има предности во однос на другите оксидатори со тоа што е многу помалку токсичен, а поради неговата стабилност на собна температура, исто така е полесен за складирање и релативно безбеден за носење на лет. Како секундарна придобивка, може лесно да се распадне и да формира воздух за дишење. Неговата висока густина и нискиот притисок за складирање (кога се одржува на ниска температура) му овозможуваат да биде високо конкурентен со складираните системи за гас под висок притисок.[15]
Во патент од 1914 година, американскиот ракетен пионер Роберт Годард предложил азотен оксид и бензин како можни погони за ракета со течно гориво.[16] Азотниот оксид е оксидатор на избор во неколку дизајни на хибридни ракети (со користење на цврсто гориво со течен или гасовит оксидатор). Комбинацијата на азотен оксид со гориво со полибутадиен со хидроксил е користена од SpaceShipOne и други. Исто така, особено се користи во аматерската и висока моќност на ракета со различни пластики како гориво.
Азотниот оксид, исто така, може да се користи во ракета со монопропелант. Во присуство на загреан катализатор, N2O ќе се распадне егзотермично на азот и кислород, на температура од приближно 1,070 °F (577 °C).[17] Поради големото ослободување на топлина, каталитичкото дејство брзо станува секундарно, бидејќи термичкото автоматско распаѓање станува доминантно. Во вакуумски погон, ова може да обезбеди специфичен импулс на монопропелант (Isp) од дури 180 секунди. Иако е значително помал од I sp достапен од потиснувачите на хидразин (монопропелант или бипропелант со динитроген тетрооксид ), намалената токсичност го прави азотен оксид опција што вреди да се истражува.
Се вели дека азотниот оксид дефлагрира на приближно 600 °C (1,112 °F) при притисок од 309 psi (21 атмосфери).[18] На 600 psi, на пример, потребната енергија за палење е само 6 џули, додека N2O на 130 psi влезот на енергија за палење од 2.500 џули е недоволен.[19][20]
Мотор со внатрешно согорување
уредиВо трките со возила, азотниот оксид (често се нарекува само „азотен“) му овозможува на моторот да согорува повеќе гориво обезбедувајќи повеќе кислород за време на согорувањето. Зголемувањето на кислородот овозможува зголемување на вбризгувањето на горивото, овозможувајќи му на моторот да произведува поголема моќност на моторот. Гасот не е запалив при низок притисок/температура, но испорачува повеќе кислород од атмосферскиот воздух со распаѓање на покачени температури, околу 570 степени F (~ 300C). Затоа, често се меша со друго гориво што полесно се разгорува. Азотниот оксид е силен оксидирачки агенс, приближно еквивалентен на водород пероксид и многу посилен од кислородниот гас.
Азотниот оксид се складира како компресирана течност; испарувањето и проширувањето на течниот азотен оксид во доводниот колектор предизвикува голем пад на температурата на доводното полнење, што резултира со погусто полнење, што дополнително дозволува повеќе мешавина на воздух/гориво да влезе во цилиндерот. Понекогаш азотен оксид се вбризгува во (или пред) доводниот колектор, додека другите системи директно инјектираат, непосредно пред цилиндерот (директно вбризгување на приклучокот) за да се зголеми моќноста.
Техниката била користена за време на Втората светска војна од авионите на Луфтвафе со системот GM-1 за да се зголеми излезната моќност на моторите на авионите. Првично наменето да му обезбеди на стандардниот авион на Луфтвафе супериорни перформанси на голема височина, технолошките размислувања ја ограничиле неговата употреба на екстремно високи височини. Според тоа, го користеле само специјализирани авиони, како што се извидувачки авиони со голема височина, бомбардери со голема брзина и авиони за пресретнување на голема височина. Понекогаш може да се најде на авионите на Луфтвафе, исто така опремен со друг систем за засилување на моторот, MW 50, форма на вбризгување вода за воздухопловни мотори кои користеле метанол за неговите способности за засилување.
Еден од главните проблеми при користењето на азотен оксид во клипниот мотор е тоа што тој може да произведе доволно енергија за да го оштети или уништи моторот. Можни се многу големи зголемувања на моќноста, и ако механичката структура на моторот не е правилно зајакната, моторот може да биде сериозно оштетен или уништен за време на овој вид на работа. Многу е важно со зголемувањето на азотен оксид кај бензинските мотори да се одржуваат соодветни работни температури и нивоа на гориво за да се спречи „пред-палење“,[21] или „детонација“ (понекогаш се нарекува „чукање“). Повеќето проблеми кои се поврзани со азотен оксид не доаѓаат од механички дефект поради зголемувањето на моќноста. Бидејќи азотниот оксид овозможува многу погусто полнење во цилиндерот, тој драматично го зголемува притисокот во цилиндерот. Зголемениот притисок и температура може да предизвикаат проблеми како што се топење на клипот или вентилите. Исто така, може да пукне или да го искриви клипот или главата и да предизвика претходно палење поради нерамномерно загревање.
Течниот азотен оксид од автомобилска класа малку се разликува од азотен оксид од медицинска класа. Мала количина на сулфур диоксид (SO2) се додава за да се спречи злоупотреба на супстанции.[22]
Аеросолно погонско гориво
уредиГасот е одобрен за употреба како додаток на храна ( Е број : E942), особено како погонско гориво за аеросолен спреј. Неговата најчеста употреба во овој контекст е во канистри за шлаг со аеросол и спрејови за готвење.
Гасот е исклучително растворлив во масни соединенија. Во шлагот со аеросол се раствора во масната павлака додека не излезе од конзервата, кога станува гасовита и на тој начин се создава пена. Кога се користи на овој начин, се добива шлаг што е четири пати поголем од волуменот на течноста, додека изматувањето на воздухот во кремот произведува само двојно поголем волумен. Ако воздухот се користи како погонско гориво, кислородот би го забрзал ранцидирањето на маснотиите од путер, но азотниот оксид ја инхибира таквата деградација. Јаглерод диоксидот не може да се користи за шлаг затоа што е кисел во вода, што би го замрзнало кремот и ќе му даде чувство на „пенкаво“ како селцер.
Шлагот произведен со азотен оксид е нестабилен и ќе се врати во потечна состојба во рок од половина час до еден час.[23] Така, методот не е погоден за украсување храна што нема да се служи веднаш.
Во текот на декември 2016 година, некои производители пријавиле недостиг на шлаг со аеросолни креми во Соединетите Држави поради експлозија во постројката за азотен оксид на Air Liquide во Флорида кон крајот на август. Со голем објект офлајн, прекинот предизвикал недостиг што резултирал со тоа што компанијата го пренасочила снабдувањето со азотен оксид до медицинските клиенти наместо кон производството на храна. Недостатокот се појавил за време на божиќната и празничната сезона кога употребата на конзервирана шлаг вообичаено е на највисоко ниво.[24]
Слично на тоа, спрејот за готвење, кој е направен од различни видови масла комбинирани со лецитин (емулгатор), може да користи азотен оксид како погонско гориво. Други погони кои се користат во спрејот за готвење вклучуваат алкохол и пропан за храна.
Лек
уредиАзотниот оксид се користи во стоматологијата и хирургијата, како анестетик и аналгетик, од 1844 година Во раните денови, гасот се администрирал преку едноставни инхалатори кои се состоеле од вреќа за дишење направена од гумена ткаенина. Денес, гасот се администрира во болниците со помош на автоматска машина за релативна аналгезија, со испарувач на анестетици и медицински вентилатор, кој обезбедува прецизно дозиран и активиран со здив проток на азотен оксид измешан со кислород во сооднос 2:1.
Азотниот оксид е слаб општ анестетик, и затоа генерално не се користи сам во општа анестезија, туку се користи како гас-носител (помешан со кислород) за помоќни лекови за општа анестезија како што се севофлуран или десфлуран. Има минимална алвеоларна концентрација од 105% и коефициент на поделба на крв/гас од 0,46. Употребата на азотен оксид во анестезија, сепак, може да го зголеми ризикот од постоперативна гадење и повраќање.[25][26][27]
Стоматолозите користат поедноставна машина која испорачува само N2O / O2 смеса за пациентот да вдишува додека е свесен. Пациентот се одржува свесен во текот на целата процедура и ги задржува соодветните ментални способности да одговори на прашањата и упатствата од стоматологот.[28]
Вдишувањето на азотен оксид често се користи за ублажување на болката поврзана со породување, траума, орална хирургија и акутен коронарен синдром (вклучува срцев удар). Неговата употреба за време на породувањето се покажало како безбедна и ефикасна помош за жените кои раѓаат.[29] Неговата употреба за акутен коронарен синдром е од непозната корист.[30]
Во Британија и Канада, Ентонокс и Нитронокс најчесто се користат од екипи на брза помош (вклучувајќи ги и нерегистрирани лекари) како брз и високо ефикасен аналгетски гас.
Педесет проценти азотен оксид може да се земе предвид за употреба од обучени непрофесионални лица кои реагираат на прва помош во предхоспиталните услови, со оглед на релативната леснотија и безбедност на администрирање на 50% азотен оксид како аналгетик. Брзата реверзибилност на нејзиниот ефект, исто така, ќе го спречи да ја спречи дијагнозата.[31]
Рекреативна употреба
уредиРекреативното вдишување на азотен оксид, со цел да предизвика еуфорија и/или благи халуцинации, започнало како феномен за британската висока класа во 1799 година, познат како „забави со гасови од смеење“.[32]
Почнувајќи од деветнаесеттиот век, широката достапност на гасот за медицински и кулинарски цели овозможило рекреативната употреба значително да се прошири низ целиот свет. Во Обединетото Кралство, од 2014 година, се проценува дека азотен оксид го користат речиси половина милион млади луѓе на ноќни места, фестивали и забави.[33]
Широката рекреативна употреба на лекот низ ОК била прикажана во документарниот филм на Vice од 2017 година , Inside The Laughing Gas Black Market, во кој новинарот Мет Шеј се сретнал со дилерите на дрогата кои ја украле од болниците.[34]
Значајното прашање наведено во лондонскиот печат е ефектот од фрлањето на канистер со азотен оксид, што е многу видливо и предизвикува значителни поплаки од заедниците.[35]
Рекреативните корисници често погрешно го перцепираат азотен оксид како пат до „безбедно високо ниво“ и не се свесни за неговиот потенцијал за предизвикување невролошки оштетувања. Во Австралија, рекреативната употреба стана загриженост за јавното здравје по порастот на пријавени случаи на невротоксичност и порастот на приемот во собата за итни случаи, а во (состојбата) Јужна Австралија законодавството беше донесено во 2020 година за ограничување на продажбата на канистери.
Безбедност
уредиАзотниот оксид претставува професионална опасност за хирурзите, стоматолозите и медицинските сестри. Бидејќи азотниот оксид минимално се метаболизира кај луѓето (со стапка од 0,004%), тој ја задржува својата моќ при издишување во просторијата од страна на пациентот и може да претставува опојна и долготрајна опасност од изложување на персоналот на клиниката доколку просторијата е слабо проветрена. Онаму каде што се администрира азотен оксид, систем за вентилација на свеж воздух со континуиран проток или Систем за чистење N2O е потребно да се користи за да се спречи акумулација на отпаден гас.
Националниот институт за безбедност и здравје при работа препорачува дека изложеноста на работниците на азотен оксид треба да се контролира за време на администрацијата на анестетички гас кај медицинските, стоматолошките и ветеринарните оператори.[36] Поставена е препорачана граница на изложеност (REL) од 25 ppm (46 mg/m 3 ) до излеан анестетик.[37]
Ментално и мануелно оштетување
уредиИзложеноста на азотен оксид предизвикува краткорочно намалување на менталните перформанси, аудиовизуелните способности и рачната умешност.[38] Овие ефекти заедно со предизвиканата просторна и временска дезориентација може да резултираат со физичка штета на корисникот од еколошки опасности.[39]
Невротоксичност и невропротекција
уредиАзотниот оксид е невротоксичен и долготрајната или вообичаената употреба може да предизвика сериозни невролошки оштетувања.[40]
Како и другите антагонисти на NMDA рецепторите, се сугерира дека N2O предизвикува невротоксичност во форма на олни лезии кај глодарите при продолжена (неколку часовна) изложеност.[41][42][43][44] Ново истражување сугерира дека лезиите не се јавуваат кај луѓето, сепак, и денес се верува дека слични лекови како кетамин не се акутно невротоксични.[45][46] Се тврди дека, бидејќи N2O брзо се исфрла од телото во нормални околности, помала е веројатноста да биде невротоксичен од другите антагонисти на NMDAR.[47] , Кај глодарите, краткотрајната изложеност резултира со само блага повреда која е брзо реверзибилна, а смртта на невроните настанува само по постојана и долготрајна изложеност.[41] Азотниот оксид, исто така, може да предизвика невротоксичност по продолжена изложеност поради хипоксија. Ова е особено точно за немедицинските формулации како што се полначите за шлаг (исто така познати како „випетс“ или „нангс“),[48] кои никогаш не содржат кислород, бидејќи кислородот го прави кремот граничен.[49]
Кај тешки (≥400 g или ≥200 L од Гас во една сесија) или чести (редовни, на пр. дневно или неделно) корисници пријавени во центрите за контрола на отрови, забележани се знаци на периферна невропатија: присуство на атаксија (абнормалности во одењето) или парестезија (перцепција на абнормални сензации, на пр. пецкање, вкочанетост, боцкање, најмногу во екстремитетите). Тие се сметаат за ран знак на невролошко оштетување и укажуваат на хронична токсичност.[50]
Азотниот оксид на 75% по волумен ја намалува невронската смрт предизвикана од исхемија предизвикана од оклузија на средната церебрална артерија кај глодарите и го намалува приливот на Ca 2+ предизвикан од NMDA во невронските клеточни култури, критичен настан вклучен во ексцитотоксичноста.
Оштетување на ДНК
уредиПрофесионалната изложеност на амбиентален азотен оксид е поврзана со оштетување на ДНК, поради прекини во синтезата на ДНК.[51] Оваа корелација е зависна од дозата [52][53] и се чини дека не се протега на случајна рекреативна употреба; сепак, потребни се дополнителни истражувања за да се потврди времетраењето и количината на изложеност потребни за да се предизвика штета.
Недостаток на кислород
уредиАко чист азотен оксид се вдишува без кислород, може да дојде до недостаток на кислород, што ќе резултира со низок крвен притисок, несвестица, па дури и срцев удар. Ова може да се случи ако корисникот непрекинато вдишува големи количества, како со маска за прицврстување поврзана со канистер за гас. Исто така, може да се случи ако корисникот прекумерно го задржува здивот или користи кој било друг систем за вдишување што го прекинува снабдувањето со свеж воздух.[54] Дополнителен ризик е дека симптомите на смрзнатини може да се појават на усните, гркланот и бронхиите доколку гасот се вдишува директно од садот за гас. Затоа, азотен оксид често се вдишува од балони.[55]
Недостаток на витамин Б12
уредиДолготрајната изложеност на азотен оксид може да предизвика недостаток на витамин Б12. Ова може да предизвика сериозна невротоксичност ако корисникот има веќе постоечки дефицит на витамин Б12.[56] Ја инактивира кобаламинската форма на витаминот Б12 со оксидација. Симптомите на дефицит, вклучувајќи сензорна невропатија, миелопатија и енцефалопатија, може да се појават во рок од неколку дена или недели по изложувањето на анестезија со азотен оксид кај луѓе со субклинички недостаток на витамин 12.
Симптомите се третираат со високи дози на витамин Б12, но закрепнувањето може да биде бавно и нецелосно.[57]
Луѓето со нормални нивоа на витамин Б 12 имаат резерви за да ги направат незначителни ефектите на азотен оксид, освен ако изложувањето не се повторува и продолжено (злоупотреба на азотен оксид). Нивоата на витамин Б 12 треба да се проверат кај луѓе со фактори на ризик за недостаток на витамин Б 12 пред да се користи анестезија со азотен оксид.[58]
Пренатален развој
уредиНеколку експериментални студии на стаорци покажуваат дека хроничната изложеност на бремени жени на азотен оксид може да има негативни ефекти врз фетусот во развој.[59][60][61]
Хемиски/физички ризици
уредиНа собна температура ( 20 °C (68 °F) ) притисокот на заситената пареа е 50,525 бари, што се зголемува до 72,45 бар на 36.4 °C (97.5 °F) - критична температура. Поради тоа, кривата на притисок е невообичаено чувствителна на температура.[62]
Како и кај многу силни оксидатори, контаминацијата на деловите со горива е вмешана во ракетни несреќи, каде што мали количини на азотни/гориво мешавини експлодираат поради ефекти слични на „ воден чекан “ (понекогаш се нарекува „дизелирање“ - загревање поради адијабатска компресија на гасови може да достигне температури на распаѓање).[63] Некои вообичаени градежни материјали, како што се нерѓосувачки челик и алуминиум, можат да дејствуваат како горива со силни оксиданти како што е азотен оксид, како и загадувачи кои можат да се запалат поради адијабатска компресија.[64]
Исто така, имало инциденти каде што распаѓањето на азотен оксид во водоводот довело до експлозија на големи резервоари.[18]
Механизам на дејство
уредиФармаколошкиот механизам на дејство на N2O во медицината не е целосно познат. Сепак, се покажало дека директно модулира широк опсег на јонски канал затворен со лиганд, и ова веројатно игра голема улога во многу од неговите ефекти. Умерено ги блокира NMDAR и β2-подединица што содржи nACh канали, слабо ја инхибира AMPA , каинат, GABAC и 5-HT3 рецептори, и малку ги потенцира GABAA.[65][66] Исто така, се покажало дека активира калиумови канали со два пори на К+]]].[67] Покрај неговите ефекти врз јонските канали, N2O може да делува на имитација на азотен оксид (NO) во централниот нервен систем, а тоа може да биде поврзано со неговите аналгетик и анксиолитички својства. Азотниот оксид е 30 до 40 пати порастворлив од азот.
Познато е дека ефектите од вдишување на суб-анестетички дози на азотен оксид варираат, врз основа на неколку фактори, вклучувајќи ги поставувањата и индивидуалните разлики;[68][69] сепак, од неговата дискусија, Џеј (2008) сугерира дека е сигурно познато дека ги поттикнува следните состојби и сензации:
- Интоксикација
- Еуфорија/дисфорија
- Просторна дезориентација
- Временска дезориентација
- Намалена чувствителност на болка
Малцинство корисници, исто така, ќе се појават со неконтролирани вокализации и мускулни грчеви. Овие ефекти генерално исчезнуваат неколку минути по отстранувањето на изворот на азотен оксид.
Анксиолитички ефект
уредиВо бихејвиоралните тестови на анксиозност, мала доза на N2O е ефикасен анксиолитик, а овој анти-анксиозно дејство е поврзан со зголемената активност на ГАБА A рецепторите, бидејќи делумно се менува со антагонисти на бензодиазепинските рецептори. Според ова, животните кои развиле толеранција на анксиолитичките ефекти на бензодиазепините се делумно толерантни на N2O [70] Кај луѓето дадени 30% N2O, антагонистите на бензодиазепинските рецептори ги намалиле субјективните извештаи за чувство на „високо ниво“, но не ги промениле психомоторните перформанси, во клиничките студии на луѓе.[71]
Аналгетските ефекти на N2O се поврзани со интеракцијата помеѓу ендогениот опиоиден систем и десцендентниот норадренергичен систем. Кога на животните им се дава морфин хронично, тие развиваат толеранција на неговите ефекти против болки, а тоа исто така ги прави животните толерантни на аналгетските ефекти на N2O [72] Администрацијата на антитела кои ја врзуваат и блокираат активноста на некои ендогени опиоиди (не β-ендорфин ) исто така ги блокираат антиноцицептивните ефекти на N2O [73] Лековите кои го инхибираат разградувањето на ендогени опиоиди, исто така, ги потенцираат антиноцицептивните ефекти на N2O [73] Неколку експерименти покажале дека антагонистите на опиоидните рецептори кои се применуваат директно на мозокот ги блокираат антиноцицептивните ефекти на N2O, но овие лекови немаат ефект кога се инјектираат во 'рбетниот мозок.
Освен индиректно дејство, азотниот оксид, како морфинот [74] исто така директно комуницира со ендогениот опиоиден систем со врзување на местата за врзување на опиоидните рецептори.[75][76]
Спротивно на тоа, антагонистите на алфа-2 адренергичен рецептор ги блокираат ефектите за намалување на болката на N2O кога се дава директно на ’рбетниот мозок, но не и кога се нанесува директно на мозокот. Очигледно N2O -индуцираното ослободување на ендогени опиоиди предизвикува дезинхибиција на норадренергичните неврони на мозочното стебло, кои ослободуваат норепинефрин во ’рбетниот мозок и ја инхибираат сигнализацијата за болка.
Својства и реакции
уредиАзотниот оксид е безбоен гас со слаб, сладок мирис.
Азотниот оксид го поддржува согорувањето со ослободување на диполарниот врзан кислороден радикал и на тој начин може повторно да запали блескава шина.
N2O е инертен на собна температура и има малку реакции. При покачени температури, неговата реактивност се зголемува. На пример, азотен оксид реагира со NaNH2 на 460 K (187 °C) за да даде NaN3:
- 2 NaNH2 + N2O → NaN3 + NaOH + NH3
Горенаведената реакција е пат усвоен од комерцијалната хемиска индустрија за производство на азидни соли, кои се користат како детонатори.[77]
Историја
уредиГасот првпат бил синтетизиран во 1772 година од англискиот природен филозоф и хемичар Џозеф Пристли кој го нарекол дефлогистиран азотен воздух (види теорија на флогистон) [78] или запалив азотен воздух.[79] Пристли го објавил своето откритие во книгата <i id="mwAkM">„Експерименти и набљудувања на различни видови воздух“ (1775)</i>, каде што опишал како да се произведе подготовката на „намалениот азотен воздух“, со загревање на железни навлаки натопени со азотна киселина.[80]
Рана употреба
уредиПрвата важна употреба на азотен оксид била овозможена од Томас Беддос и Џејмс Ват, кои работеле заедно за да ја објават книгата Размислувања за медицинската употреба и за производството на фабрички воздух (1794). Оваа книга била важна од две причини. Прво, Џејмс Ват измислил нова машина за производство на „промислен воздух“ (вклучувајќи азотен оксид) и нов „апарат за дишење“ за вдишување на гасот. Второ, во книгата се претставени и новите медицински теории на Томас Беддос, дека туберкулозата и другите белодробни заболувања може да се лекуваат со вдишување на „Фактивниот воздух“.
Машината за производство на „Factitious Airs“ имала три дела: печка за согорување на потребниот материјал, сад со вода каде што произведениот гас поминувал во спирална цевка (за нечистотиите да се „измијат“) и на крајот боца со гас со гасометар каде произведениот гас, „воздух“, може да се внесе во преносни воздушни перничиња (изработени од херметички мрсна свила). Апаратот за дишење се состоел од едно од преносливите воздушни перничиња поврзано со цевка за уста. Со оваа нова опрема што била дизајнирана и произведена до 1794 година, бил отворен патот за клинички испитувања што започнало во 1798 година кога Томас Бедос ја основал „Пневматската институција за ослободување од болести со медицински воздух“ во Хотвелс ( Бристол). Во подрумот на зградата, машина со големи размери ги произведувала гасовите под надзор на младиот Хамфри Дејви, кој бил охрабрен да експериментира со нови гасови за пациентите да ги вдишуваат.
И покрај откритието на Дејви дека вдишувањето на азотен оксид може да ја ослободи свесната личност од болка, поминале уште 44 години пред лекарите да се обидат да го користат за анестезија. Употребата на азотен оксид како рекреативна дрога на „забави за гас за смеење“, првенствено организирана за британската висока класа, станало непосреден успех почнувајќи од 1799 година. Додека ефектите од гасот генерално го прават корисникот да изгледа ступорозен, сонлив и седатен, некои луѓе исто така „се кикотат“ во состојба на еуфорија и често еруптираат во смеа.[81]
Еден од најраните комерцијални производители во САД бил Џорџ По, братучед на поетот Едгар Алан По.[82]
Употреба на анестетици
уредиПрвиот пат кога азотен оксид бил употребен како анестетик во лекувањето на пациент бил кога стоматологот Хорас Велс, со помош на Гарднер Квинси Колтон и Џон Менки Ригс, покажал нечувствителност на болка од екстракција на забите на 11 декември 1844 година [83] Во следните недели, Велс ги лекувал првите 12 до 15 пациенти со азотен оксид во Хартфорд, Конектикат, и, според неговиот сопствен рекорд, не успеал само во два случаи.[84] И покрај овие убедливи резултати кои Велс ги пријавил до медицинското друштво во Бостон во декември 1844 година, овој нов метод не бил веднаш прифатен од други стоматолози. Причината за ова била најверојатно тоа што Велс, во јануари 1845 година на неговата прва јавна демонстрација на медицинскиот факултет во Бостон, бил делумно неуспешен, оставајќи ги неговите колеги сомнителни во однос на неговата ефикасност и безбедност.[85] Методот стапил во општа употреба сè до 1863 година, кога Гарднер Квинси Колтон успешно започнал да го користи во сите негови клиники „Стоматолошка асоцијација Колтон“, кои штотуку ги основал во Њу Хевн и Њујорк Сити.[86] Во текот на следните три години, Колтон и неговите соработници успешно администрирале азотен оксид на повеќе од 25.000 пациенти.[87] Денес, азотен оксид се користи во стоматологијата како анксиолитик, како додаток на локалниот анестетик.
Сепак, било откриено дека азотниот оксид не е доволно силен анестетик за употреба во големи операции во болнички услови. Наместо тоа, диетил етерот, кој е посилен и посилен анестетик, бил демонстриран и прифатен за употреба во октомври 1846 година, заедно со хлороформот во 1847 година. Меѓутоа, кога Џозеф Томас Кловер го измислил „инхалаторот за гас-етер“ во 1876 година, станало вообичаена практика во болниците да се иницираат сите анестетички третмани со благ проток на азотен оксид, а потоа постепено да се зголемува анестезијата со посилниот етер или хлороформ. Инхалаторот на Кловер е дизајниран да го снабдува пациентот со азотен оксид и етер во исто време, при што точната смеса ја контролира операторот на уредот. Тој останал во употреба од многу болници до 1930-тите. Иако болниците денес користат понапредна машина за анестезија, овие машини сè уште го користат истиот принцип лансиран со инхалаторот, за да се започне анестезијата со азотен оксид, пред да се даде помоќен анестетик.
Како патент лек
уредиПопуларизацијата на азотен оксид од страна на Колтон довела до негово усвојување од страна на неколку помалку од угледни надрилекари, кои го промовирале како лек за консумирање, скрофула, катара и други болести на крвта, грлото и белите дробови. Третманот со азотен оксид бил администриран и лиценциран како патент лек од страна на CL Blood и Џером Харис во Бостон и Чарлс Е. Барни од Чикаго.[88][89]
Производство
уредиОбјавен е преглед на различни методи за производство на азотен оксид.[90]
Индустриски методи
уредиАзотниот оксид се подготвува на индустриско ниво со внимателно загревање на амониум нитрат на околу 250 °C, кој се распаѓа на азотен оксид и водена пареа.[91]
- NH4NO3 → 2 H2O + N2O
Додавањето на различни фосфатни соли го фаворизира формирањето на почист гас на малку пониски температури. Оваа реакција може да биде тешко да се контролира, што резултира со детонација.[92]
Лабораториски методи
уредиРаспаѓањето на амониум нитрат е исто така вообичаен лабораториски метод за подготовка на гасот. Еквивалентно, може да се добие со загревање на мешавина од натриум нитрат и амониум сулфат :[93]
- 2 NaNO3+ (NH4) 2 SO4 → Na2SO4 + 2 N2O + 4 H2O
Друг метод вклучува реакција на уреа, азотна киселина и сулфурна киселина:[94]
- 2 (NH2)2CO + 2 HNO3 + H2SO4 → 2 N2O + 2 CO2 + (NH4)2SO4 + 2 H2O
Пријавена е директна оксидација на амонијак со катализатор на манган диоксид - бизмут оксид:[95] сп. Оствалдов процес.
- 2 NH3 + 2 O2 → N2O + 3 H2O
Хидроксиламониум хлорид реагира со натриум нитрит и дава азотен оксид. Ако нитритот се додаде во растворот на хидроксиламин, единствениот преостанат нуспроизвод е солената вода. Ако растворот на хидроксиламин се додаде во растворот на нитрит (нитритот е во вишок), тогаш се формираат и токсични повисоки оксиди на азот:NH NH3OHCl + NaNO2 → N2O + NaCl + 2 H2O
Лекување HNO3 со SnCl2 и HCl, исто така, е докажано:
2 HNO3 + 8 HCl + 4 SnCl2 → 5 H2O + 4 SnCl4 + N2O
Хипонитрозната киселина се распаѓа до N2 O и вода со полуживот од 16 дена на 25 °C при pH 1–3.[96]
H2N2O2→ H2O + N2O
Атмосферска појава
уредиАзотниот оксид е помала компонента на атмосферата на Земјата и е активен дел од планетарниот циклус на азот. Врз основа на анализа на примероци од воздух собрани од локации низ целиот свет, неговата концентрација надминала 330 ppb во 2017 година.[8] Стапката на раст од околу 1 ppb годишно, исто така, се забрзала во последните децении.[9] Атмосферското изобилство на азотен оксид пораснало за повеќе од 20% од основното ниво од околу 270 ppb во 1750 година.[98] Важни атмосферски својства на N2O се сумирани во следната табела:
| Имотот | Вредност |
|---|---|
| Потенцијал за осиромашување на озонската обвивка (ODP) | 0,17 [99] (CCl 3 F = 1) |
| Потенцијал за глобално затоплување (GWP: 100-години) | 265 [100] ( CO2 = 1) |
| Атмосферски животен век | 121 [100] години |
Во октомври 2020 година, научниците објавиле сеопфатна квантификација на глобалниот N2O извори и мијалници. Тие известуваат дека емисиите предизвикани од човекот се зголемиле за 30% во последните четири децении и се главната причина за зголемувањето на атмосферската концентрација. Неодамнешниот раст надминал некои од највисоките проектирани сценарија за емисии.[11][14]
Емисии по извор
уредиЗаклучно со 2010 година, се проценува дека околу 29,5 милиони тони N2O (содржи 18.8 милиони тони азот) влегуваат во атмосферата секоја година; од кои 64% биле природни, а 36% поради човечка активност.[101][102]
Повеќето од N2O што се испушта во атмосферата, од природни и антропогени извори, се произведува од микроорганизми како што се бактериите и габите кои го денитрифицираат почвите и океаните.[103] Почвите под природна вегетација се важен извор на азотен оксид, кој сочинува 60% од сите природно произведени емисии. Други природни извори ги вклучуваат океаните (35%) и атмосферските хемиски реакции (5%).[101] Мочуриштата можат да бидат и емитери на азотен оксид.[104][105]
Студијата од 2019 година покажала дека емисиите од топењето на вечниот мраз се 12 пати повисоки од претходно претпоставените.[106]
Главните компоненти на антропогените емисии се оплодени земјоделски почви и ѓубриво од добиток (42%), истекување на ѓубрива (25%), согорување на биомаса (10%), согорување на фосилни горива и индустриски процеси (10%), биолошка деградација на други атмосферски емисии што содржат азот (9%) и човечка канализација (5%).[107][108][109][110][111] Земјоделството го подобрува производството на азотен оксид преку одгледување почва, употреба на азотни ѓубрива и ракување со животинскиот отпад.[112] Овие активности ги стимулираат природните бактерии да произведуваат повеќе азотен оксид. Емисиите на азотни оксиди од почвата може да бидат предизвик за мерење бидејќи тие значително варираат со текот на времето и просторот,[113] и поголемиот дел од емисиите на една година може да се појават кога условите се поволни за време на „жешките моменти“ [114][115] и/или во поволни локации познати како „жешки точки“.[116]
Меѓу индустриските емисии, производството на азотна киселина и адипинска киселина се најголемите извори на емисии на азотен оксид. Емисиите на адипичната киселина конкретно произлегуваат од разградувањето на посредникот на нитролната киселина добиен од нитрацијата на циклохексанон.[107][117][118]
Биолошки процеси
уредиПриродните процеси кои генерираат азотен оксид може да се класифицираат како нитрификација и денитрификација. Поточно, тие вклучуваат:
- аеробна автотрофична нитрификација, постепено оксидација на амонијак ( NH3) до нитрит ( NO−
2) и да нитрат ( NO−
3 ) - анаеробна хетеротрофична денитрификација, постепено намалување на NO−
3 до NO−
2, азотен оксид (NO), N2O и на крајот N2, каде што факултативните анаеробни бактерии користат NO−
3 како акцептор на електрони во дишењето на органски материјал во состојба на недоволен кислород (O2 ) - нитрификатор денитрификација, која се врши од страна на автотрофина NH3 -оксидирачки бактерии и патека по која амонијак ( NH3 ) се оксидира до нитрит ( NO−
2 ), проследено со намалување на NO−
2 до азотен оксид (NO), N2O и молекуларен азот ( N2 ) - хетеротрофична нитрификација
- аеробна денитрификација од истите хетеротрофни нитрификатори
- габична денитрификација
- небиолошка хемоденитрификација
Овие процеси се под влијание на хемиските и физичките својства на почвата, како што се достапноста на минералниот азот и органската материја, киселоста и типот на почвата, како и факторите поврзани со климата, како што се температурата на почвата и содржината на вода.
Емисијата на гасот во атмосферата е многу ограничена од неговата потрошувачка во клетките, со процес катализиран од ензимот азотен оксид редуктаза.[119]
Влијание врз животната средина
уредиЕфект на стаклена градина
уредиАзотниот оксид има значителен потенцијал за глобално затоплување како гас со ефект на стаклена градина. На основа по молекула, сметано за период од 100 години, азотен оксид има 265 пати поголема способност за атмосферска топлина од јаглерод диоксидот (CO2). Меѓутоа, поради неговата ниска концентрација (помалку од 1/1.000 од онаа на CO2 ), неговиот придонес во ефектот на стаклена градина е помал од една третина од јаглеродниот диоксид, а исто така помал од водената пареа и метанот.[120] Од друга страна, бидејќи 38% или повеќе од N2O влегувањето во атмосферата е резултат на човековата активност,[107] контролата на азотен оксид се смета за дел од напорите за ограничување на емисиите на стакленички гасови.[121]
Студијата од 2008 година на нобеловецот Пол Круцен сугерира дека количината на ослободување на азотен оксид што може да се припише на земјоделските нитратни ѓубрива е сериозно потценета, од кои повеќето веројатно ќе бидат испуштени од почвата и океаните во податоците на Агенцијата за заштита на животната средина.[122] Азотниот оксид се ослободува во атмосферата преку земјоделството, кога земјоделците додаваат ѓубрива на база на азот на полињата и преку разградување на животинското ѓубриво. Приближно 79 отсто од сите азотни оксиди ослободени во Соединетите држави потекнуваат од азотното оплодување. Намалувањето на емисиите може да биде жешка тема во политиката на климатските промени.[123]
Азотниот оксид, исто така, се ослободува како нуспроизвод од согорувањето на фосилното гориво, иако количината што се ослободува зависи од тоа кое гориво се користело. Исто така, се испушта преку производство на азотна киселина, која се користи во синтезата на азотни ѓубрива. Производството на адипинска киселина, претходник на најлон и други синтетички влакна за облека, исто така ослободува азотен оксид. Вкупната количина на ослободен азотен оксид од човечко потекло е околу 40 проценти.[124]
Осиромашување на озонската обвивка
уредиАзотниот оксид исто така е вмешан во разредувањето на озонската обвивка. Студијата од 2009 година сугерира дека N2O била единствената најважна емисија што ја осиромашува озонската обвивка и се очекувало таа да остане најголема во текот на 21 век.[10]
Законитост
уредиВо Соединетите Американски Држави, поседувањето на азотен оксид е легално според федералниот закон и не е предмет на надлежност на ДЕА.[125] Сепак, тоа е регулирано од страна на Управата за храна и лекови според Законот за прехранбени лекови и козметика; гонење е можно според неговите клаузули за „погрешно брендирање“, со кои се забранува продажба или дистрибуција на азотен оксид за потребите на човечка исхрана. Многу држави имаат закони кои го регулираат поседувањето, продажбата и дистрибуцијата на азотен оксид. Таквите закони обично забрануваат дистрибуција на малолетни лица или ја ограничуваат количината на азотен оксид што може да се продава без посебна лиценца. На пример, во државата Калифорнија, поседувањето за рекреативна употреба е забрането и се квалификува како прекршок.[126]
Во август 2015 година, Советот на лондонскиот округ Ламбет ( Велика Британија) ја забранил употребата на лекот за рекреативни цели, со што прекршителите подлежат на казна на лице место до 1.000 фунти.[127]
Во Нов Зеланд, Министерството за здравство предупредило дека азотен оксид е лек на рецепт, а неговата продажба или поседување без рецепт е прекршок според Законот за лекови.[128] Оваа изјава навидум би ги забранила сите немедицински употреби на азотен оксид, иако се подразбира дека законски ќе биде насочена само рекреативната употреба.
Во Индија, преносот на азотен оксид од цилиндрите на големо во помали, попреносливи резервоари од тип Е, со капацитет од 1.590 литри [129] е легален кога наменетата употреба на гасот е за медицинска анестезија.
Наводи
уреди- ↑ „[Nitrous oxide]“. Degruyter.com. Посетено на 24 July 2022.
- ↑ IUPAC nomenclature of inorganic chemistry 2005. PDF, p. 317.
- ↑ Takahashi, Mitsuo; Shibasaki-Kitakawa, Naomi; Yokoyama, Chiaki; Takahashi, Shinji (1996). „Viscosity of Gaseous Nitrous Oxide from 298.15 K to 398.15 K at Pressures up to 25 MPa“. Journal of Chemical & Engineering Data. 41 (6): 1495–1498. doi:10.1021/je960060d. ISSN 0021-9568.
- ↑ Tarendash, Albert S. (2001). Let's review: chemistry, the physical setting (3rd. изд.). Barron's Educational Series. стр. 44. ISBN 978-0-7641-1664-3.
- ↑ PubChem. „Nitrous oxide“. pubchem.ncbi.nlm.nih.gov (англиски). Посетено на 2022-03-29.
- ↑ 6,0 6,1 „Frostbite injury: An unknown risk when using nitrous oxide as a party drug“. Acta Chirurgica Belgica. Taylor & Francis on behalf of the Royal Belgian Society for Surgery. 120 (1–4): 140–143. July 2020. doi:10.1080/00015458.2020.1782160. ISSN 0001-5458. PMID 32543291.
- ↑ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.CS1-одржување: користи параметар authors (link)
- ↑ 8,0 8,1 „Nitrous Oxide (N2O) Mole Fraction“ (PDF). Massachusettes Institute of Technology. Архивирано од изворникот (PDF) на 2022-10-09. Посетено на 2021-02-15.
- ↑ 9,0 9,1 „Trends in Atmospheric Nitrous Oxide“. National Oceanic and Atmospheric Administration / Earth System Research Laboratories. Посетено на 2021-02-15.
- ↑ 10,0 10,1 Ravishankara, A. R.; Daniel, J. S.; Portmann, R. W. (2009). „Nitrous Oxide (N2O): The Dominant Ozone-Depleting Substance Emitted in the 21st Century“. Science. 326 (5949): 123–5. Bibcode:2009Sci...326..123R. doi:10.1126/science.1176985. PMID 19713491.
- ↑ 11,0 11,1 Tian, Hanqin; Xu, Rongting; Canadell, Josep G.; Thompson, Rona L.; Winiwarter, Wilfried; Suntharalingam, Parvadha; Davidson, Eric A.; Ciais, Philippe; Jackson, Robert B.; и др. (October 2020). „A comprehensive quantification of global nitrous oxide sources and sinks“. Nature (англиски). 586 (7828): 248–256. Bibcode:2020Natur.586..248T. doi:10.1038/s41586-020-2780-0. ISSN 1476-4687. PMID 33028999 Проверете ја вредноста
|pmid=(help). Архивирано од изворникот на 2020-10-31. Посетено на 2020-11-09.CS1-одржување: бот: непознат статус на изворната URL (link) - ↑ Thompson, R. L., Lassaletta, L., Patra, P. K.; и др. (2019). „Acceleration of global N2O emissions seen from two decades of atmospheric inversion“. Nat. Clim. Change. 9 (12): 993–998. Bibcode:2019NatCC...9..993T. doi:10.1038/s41558-019-0613-7.CS1-одржување: повеќе имиња: список на автори (link)
- ↑ „Chapter 8“. AR5 Climate Change 2013: The Physical Science Basis. стр. 677–678.
- ↑ 14,0 14,1 „Nitrous oxide emissions pose an increasing climate threat, study finds“. phys.org (англиски). Посетено на 2020-11-09.
- ↑ Berger, Bruno (5 October 2007). „Is nitrous oxide safe?“ (PDF). Swiss Propulsion Laboratory. стр. 1–2. Архивирано од изворникот (PDF) на 2022-10-09.
...Self pressurizing (Vapor pressure at 20°C is ~50.1 bar...Nontoxic, low reactivity -> rel. safe handling (General safe ???)...Additional energy from decomposition (as a monopropellant: ISP of 170 s)...Specific impulse doesn't change much with O/F...[page 2] N2O is a monopropellant (as H2O2 or Hydrazine...)
- ↑ Goddard, R. H. (1914) "Rocket apparatus" U.S. Patent 1.103.503
- ↑ Nitrous Oxide Safety.
- ↑ 18,0 18,1 Munke, Konrad (2 July 2001) Nitrous Oxide Trailer Rupture, Report at CGA Seminar "Safety and Reliability of Industrial Gases, Equipment and Facilities", 15–17 October 2001, St. Louis, Missouri
- ↑ „Scaled Composites Safety Guidelines for N2O“ (PDF). Scaled Composites. 17 June 2009. Архивирано од изворникот (PDF) на 12 July 2011. Посетено на 29 December 2013.
For example, N2O flowing at 130 psi in an epoxy composite pipe would not react even with a 2500 J ignition energy input. At 600 psi, however, the required ignition energy was only 6 J.
- ↑ FR-5904.
- ↑ Cline, Allen W. (January 2000) "Engine Basics: Detonation and Pre-Ignition".
- ↑ „Holley performance products, FAQ for Nitrous Oxide Systems“. Holley. Посетено на 18 December 2013.
- ↑ „Explora Science | Nitrous use as a propellant and in cooking“ (англиски). Архивирано од изворникот на 2019-02-27. Посетено на 2019-02-19.
- ↑ Dewey, Caitlin (2016-12-21). „The real reason grocery stores are running out of whipped cream this Christmas“. The Washington Post. Посетено на 2016-12-22.
- ↑ Divatia, Jigeeshu V.; Vaidya, Jayant S.; Badwe, Rajendra A.; Hawaldar, Rohini W. (1996). „Omission of Nitrous Oxide during Anesthesia Reduces the Incidence of Postoperative Nausea and Vomiting“. Anesthesiology. 85 (5): 1055–1062. doi:10.1097/00000542-199611000-00014. PMID 8916823.
- ↑ Hartung, John (1996). „Twenty-Four of Twenty-Seven Studies Show a Greater Incidence of Emesis Associated with Nitrous Oxide than with Alternative Anesthetics“. Anesthesia & Analgesia. 83 (1): 114–116. doi:10.1213/00000539-199607000-00020.
- ↑ Tramèr, M.; Moore, A.; McQuay, H. (February 1996). „Omitting nitrous oxide in general anaesthesia: meta-analysis of intraoperative awareness and postoperative emesis in randomized controlled trials“. British Journal of Anaesthesia. 76 (2): 186–193. doi:10.1093/bja/76.2.186. PMID 8777095.
- ↑ Council on Clinical Affairs (2013). „Guideline on use of nitrous oxide for pediatric dental patients“ (PDF). Reference Manual V37. 6: 206–210. Архивирано од изворникот (PDF) на 2022-10-09.
- ↑ Copeland, Claudia. „Nitrous Oxide Analgesia for Childbirth“. Pregnancy.org. Архивирано од изворникот на 25 May 2011.
- ↑ O'Connor RE; Brady W; Brooks SC; Diercks, D.; Egan, J.; Ghaemmaghami, C.; Menon, V.; O'Neil, B. J.; и др. (2010). „Part 10: acute coronary syndromes: 2010 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care“. Circulation. 122 (18 Suppl 3): S787–817. doi:10.1161/CIRCULATIONAHA.110.971028. PMID 20956226.
- ↑ Faddy, S. C.; Garlick, S. R. (2005-12-01). „A systematic review of the safety of analgesia with 50% nitrous oxide: can lay responders use analgesic gases in the prehospital setting?“. Emergency Medicine Journal. 22 (12): 901–908. doi:10.1136/emj.2004.020891. PMC 1726638. PMID 16299211.
- ↑ Davy, Humphry (1800). Researches, chemical and philosophical : chiefly concerning nitrous oxide, or diphlogisticated nitrous air, and its respiration. Francis A. Countway Library of Medicine. London : printed for J. Johnson, St. Paul's Church-Yard, by Biggs and Cottle, Bristol.
- ↑ „Warning over laughing gas misuse“. The Guardian. London. Press Association. 9 August 2014. Посетено на 9 August 2014.
- ↑ VICE (2017-02-07), Inside The Laughing Gas Black Market, Архивирано од изворникот на 2018-04-06, Посетено на 2019-03-29CS1-одржување: бот: непознат статус на изворната URL (link)
- ↑ „Recycling used laughing gas canisters for cash could help create a cleaner Britain“. Metro (англиски). 2018-07-10. Посетено на 2019-07-15.
- ↑ CDC.gov NIOSH Alert: Controlling Exposures to Nitrous Oxide During Anesthetic Administration.
- ↑ „CDC – NIOSH Pocket Guide to Chemical Hazards – Nitrous oxide“. www.cdc.gov. Посетено на 2015-11-21.
- ↑ Criteria for a recommended standard: occupational exposure to waste anesthetic gases and vapors.
- ↑ „Nitrous oxide: recreational use, regulation and harm reduction“. Drugs and Alcohol Today. 8 (3): 22–25. 2008-09-01. doi:10.1108/17459265200800022.
- ↑ „Nangs, balloons and crackers: Recreational nitrous oxide neurotoxicity“. Aust J Gen Pract (Review). 50 (11): 834–838. November 2021. doi:10.31128/AJGP-10-20-5668. PMID 34713284 Проверете ја вредноста
|pmid=(help).Evans EB, Evans MR (November 2021). - ↑ 41,0 41,1 „Prolonged exposure to inhalational anesthetic nitrous oxide kills neurons in adult rat brain“. Neuroscience. 122 (3): 609–16. 2003. doi:10.1016/j.neuroscience.2003.07.012. PMID 14622904.
- ↑ „NMDA receptor antagonist neurotoxicity and psychotomimetic activity“. Masui. The Japanese Journal of Anesthesiology (јапонски). 52 (6): 594–602. 2003. PMID 12854473.
- ↑ „Ketamine potentiates cerebrocortical damage induced by the common anaesthetic agent nitrous oxide in adult rats“. British Journal of Pharmacology. 130 (7): 1692–8. 2000. doi:10.1038/sj.bjp.0703479. PMC 1572233. PMID 10928976.
- ↑ Jevtovic-Todorovic V, Carter LB; Carter (2005). „The anesthetics nitrous oxide and ketamine are more neurotoxic to old than to young rat brain“. Neurobiology of Aging. 26 (6): 947–56. doi:10.1016/j.neurobiolaging.2004.07.009. PMID 15718054.
- ↑ Slikker, W.; Zou, X.; Hotchkiss, C. E.; Divine, R. L.; Sadovova, N.; Twaddle, N. C.; Doerge, D. R.; Scallet, A. C.; Patterson, T. A. (2007). „Ketamine-Induced Neuronal Cell Death in the Perinatal Rhesus Monkey“. Toxicological Sciences. 98 (1): 145–158. doi:10.1093/toxsci/kfm084. PMID 17426105.
- ↑ Sun, Lin; Qi Li; Qing Li; Yuzhe Zhang; Dexiang Liu; Hong Jiang; Fang Pan; David T. Yew (November 2012). „Chronic ketamine exposure induces permanent impairment of brain functions in adolescent cynomolgus monkeys“. Addiction Biology. 19 (2): 185–94. doi:10.1111/adb.12004. PMID 23145560.
- ↑ „Potentially neuroprotective and therapeutic properties of nitrous oxide and xenon“. Annals of the New York Academy of Sciences. 1053 (1): 289–300. 2005. Bibcode:2005NYASA1053..289A. doi:10.1111/j.1749-6632.2005.tb00036.x. PMID 16179534.
- ↑ De Vasconcellos, K.; Sneyd, J. R. (2013). „Nitrous oxide: Are we still in equipoise? A qualitative review of current controversies“. British Journal of Anaesthesia. 111 (6): 877–85. doi:10.1093/bja/aet215. PMID 23801743.
- ↑ Middleton, Ben (2012). Physics in anaesthesia. Banbury, Oxfordshire, UK: Scion Pub. Ltd. ISBN 978-1-904842-98-9.
- ↑ van Riel, A.J.H.P. (2022). „Alarming increase in poisonings from recreational nitrous oxide use after a change in EU-legislation, inquiries to the Dutch Poisons Information Center“. International Journal of Drug Policy. 100: 103519. doi:10.1016/j.drugpo.2021.103519. PMID 34753046 Проверете ја вредноста
|pmid=(help). - ↑ Randhawa, G.; Bodenham, A. (1 March 2016). „The increasing recreational use of nitrous oxide: history revisited“ (англиски). стр. 321–324. doi:10.1093/bja/aev297. PMID 26323292.
- ↑ Wrońska-Nofer, Teresa; Nofer, Jerzy-Roch; Jajte, Jolanta; Dziubałtowska, Elżbieta; Szymczak, Wiesław; Krajewski, Wojciech; Wąsowicz, Wojciech; Rydzyński, Konrad (1 March 2012). „Oxidative DNA damage and oxidative stress in subjects occupationally exposed to nitrous oxide (N2O)“. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 731 (1): 58–63. doi:10.1016/j.mrfmmm.2011.10.010. PMID 22085808.
- ↑ Wrońska-Nofer, Teresa; Palus, Jadwiga; Krajewski, Wojciech; Jajte, Jolanta; Kucharska, Małgorzata; Stetkiewicz, Jan; Wąsowicz, Wojciech; Rydzyński, Konrad (18 June 2009). „DNA damage induced by nitrous oxide: Study in medical personnel of operating rooms“. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 666 (1–2): 39–43. doi:10.1016/j.mrfmmm.2009.03.012. PMID 19439331.
- ↑ Dangers of Nitrous Oxide.
- ↑ van Amsterdam, Jan; Nabben, Ton; van den Brink, Wim (2015-10-22). „Recreational nitrous oxide use: Prevalence and risks“. Regulatory Toxicology and Pharmacology. 73 (3): 790–796. doi:10.1016/j.yrtph.2015.10.017. ISSN 1096-0295. PMID 26496821.
- ↑ Flippo, T. S.; Holder, W. D. Jr. (1993). „Neurologic Degeneration Associated with Nitrous Oxide Anesthesia in Patients with Vitamin B12 Deficiency“. Archives of Surgery. 128 (12): 1391–5. doi:10.1001/archsurg.1993.01420240099018. PMID 8250714.
- ↑ Giannini, A.J. (1999). Drug Abuse. Los Angeles: Health Information Press. ISBN 978-1-885987-11-2.
- ↑ Conrad, Marcel (4 October 2006). „Pernicious Anemia“. Посетено на 2 June 2008. Наводот journal бара
|journal=(help) - ↑ Vieira, E.; Cleaton-Jones, P.; Austin, J.C.; Moyes, D.G.; Shaw, R. (1980). „Effects of low concentrations of nitrous oxide on rat fetuses“. Anesthesia and Analgesia. 59 (3): 175–7. doi:10.1213/00000539-198003000-00002. PMID 7189346.
- ↑ Vieira, E. (1979). „Effect of the chronic administration of nitrous oxide 0.5% to gravid rats“. British Journal of Anaesthesia. 51 (4): 283–7. doi:10.1093/bja/51.4.283. PMID 465253.
- ↑ Vieira, E; Cleaton-Jones, P; Moyes, D. (1983). „Effects of low intermittent concentrations of nitrous oxide on the developing rat fetus“. British Journal of Anaesthesia. 55 (1): 67–9. doi:10.1093/bja/55.1.67. PMID 6821624.
- ↑ Nitrous oxide Архивирано на 30 март 2016 г..
- ↑ „Vaseline triggered explosion of hybrid rocket“. Ukrocketman.com.
- ↑ „Safetygram 20: Nitrous Oxide“ (PDF). Airproducts.com. Архивирано од изворникот (PDF) на 1 September 2006.
- ↑ Yamakura T, Harris RA (2000). „Effects of gaseous anaesthetics nitrous oxide and xenon on ligand-gated ion channels. Comparison with isoflurane and ethanol“. Anesthesiology. 93 (4): 1095–101. doi:10.1097/00000542-200010000-00034. PMID 11020766. S2CID 4684919.
- ↑ Mennerick S, Jevtovic-Todorovic V, Todorovic SM, Shen W, Olney JW, Zorumski CF (1998). „Effect of nitrous oxide on excitatory and inhibitory synaptic transmission in hippocampal cultures“. Journal of Neuroscience. 18 (23): 9716–26. doi:10.1523/JNEUROSCI.18-23-09716.1998. PMC 6793274. PMID 9822732.
- ↑ Gruss M, Bushell TJ, Bright DP, Lieb WR, Mathie A, Franks NP (2004). „Two-pore-domain K+ channels are a novel target for the anesthetic gases xenon, nitrous oxide, and cyclopropane“. Molecular Pharmacology. 65 (2): 443–52. doi:10.1124/mol.65.2.443. PMID 14742687. S2CID 7762447.
- ↑ Atkinson, Roland M.; Green, J. DeWayne; Chenoweth, Dennis E.; Atkinson, Judith Holmes (1979-10-01). „Subjective Effects of Nitrous Oxide: Cognitive, Emotional, Perceptual and Transcendental Experiences“. Journal of Psychedelic Drugs. 11 (4): 317–330. doi:10.1080/02791072.1979.10471415. PMID 522172.
- ↑ Walker, Diana J.; Zacny, James P. (2001-09-01). „Within- and between-subject variability in the reinforcing and subjective effects of nitrous oxide in healthy volunteers“. Drug and Alcohol Dependence. 64 (1): 85–96. doi:10.1016/s0376-8716(00)00234-9. PMID 11470344.
- ↑ „Nitrous oxide anxiolytic effect in mice in the elevated plus maze: mediation by benzodiazepine receptors“. Psychopharmacology. 115 (1–2): 167–72. 1994. doi:10.1007/BF02244768. PMID 7862891.
- ↑ „Flumazenil may attenuate some subjective effects of nitrous oxide in humans: a preliminary report“. Pharmacology Biochemistry and Behavior. 51 (4): 815–9. 1995. doi:10.1016/0091-3057(95)00039-Y. PMID 7675863.
- ↑ „Tolerance to nitrous oxide analgesia in rats and mice“. Anesthesiology. 51 (4): 309–12. 1979. doi:10.1097/00000542-197910000-00006. PMID 484891.
- ↑ 73,0 73,1 „Role of brain dynorphin in nitrous oxide antinociception in mice“. Pharmacology Biochemistry and Behavior. 65 (2): 217–21. 2000. doi:10.1016/S0091-3057(99)00202-6. PMID 10672972.
- ↑ Gillman M.A. [1986a].
- ↑ (Daras, C., Cantrill, R. C., Gillman, M. A. [1983]. 3[H]-Naloxone displacement: evidence for nitrous oxide as an opioid agonist.
- ↑ Ori, C., Ford-Rice, F., London, E. D. [1989].
- ↑ Housecroft, Catherine E.; Sharpe, Alan G. (2008). „Chapter 15: The group 15 elements“. Inorganic Chemistry (3rd. изд.). Pearson. стр. 464. ISBN 978-0-13-175553-6.
- ↑ Keys, T.E. (1941). „The Development of Anesthesia“. Anesthesiology. 2 (5): 552–574. Bibcode:1982AmSci..70..522D. doi:10.1097/00000542-194109000-00008.
- ↑ McEvoy, J. G. (6 March 2015). „Gases, God and the balance of nature: a commentary on Priestley (1772) 'Observations on different kinds of air'“. Philosophical Transactions of the Royal Society A: Mathematical, Physical and Engineering Sciences. 373 (2039): 20140229. Bibcode:2015RSPTA.37340229M. doi:10.1098/rsta.2014.0229. PMC 4360083. PMID 25750146.
- ↑ Priestley J (1776). „Experiments and Observations on Different Kinds of Air“. 2 (3). Наводот journal бара
|journal=(help) - ↑ Brecher EM (1972). „Consumers Union Report on Licit and Illicit Drugs, Part VI – Inhalants and Solvents and Glue-Sniffing“. Consumer Reports Magazine. Посетено на 18 December 2013.
- ↑ „George Poe is Dead“. Washington Post. 3 February 1914. Архивирано од изворникот на 2013-03-01. Посетено на 29 December 2007.
- ↑ Erving, H. W. (1933). „The Discoverer of Anæsthesia: Dr. Horace Wells of Hartford“. The Yale Journal of Biology and Medicine. 5 (5): 421–430. PMC 2606479. PMID 21433572.
- ↑ Wells H (1847). A history of the discovery, of the application of nitrous oxide gas, ether, and other vapours, to surgical operations. J. Gaylord Wells.
- ↑ „The discovery of modern anaesthesia-contributions of Davy, Clarke, Long, Wells and Morton“. Indian J Anaesth. 51 (6): 472–8. 2007.
- ↑ Sneader W (2005). Drug Discovery –A History. (Part 1: Legacy of the past, chapter 8: systematic medicine, pp. 74–87). John Wiley and Sons. ISBN 978-0-471-89980-8. Посетено на 21 April 2010.Sneader W (2005).
- ↑ Miller AH (1941). „Technical Development of Gas Anesthesia“. Anesthesiology. 2 (4): 398–409. doi:10.1097/00000542-194107000-00004.
- ↑ „Alleged Forgery“. The Inter Ocean. 1877-09-28. стр. 8. Посетено на 2015-10-26.
- ↑ „A Man of Ominous Name“. The Inter Ocean. 1890-02-19. Посетено на 2015-10-26.
- ↑ Parmon, V. N.; Panov, G. I.; Uriarte, A.; Noskov, A. S. (2005). „Nitrous oxide in oxidation chemistry and catalysis application and production“. Catalysis Today. 100 (2005): 115–131. doi:10.1016/j.cattod.2004.12.012.
- ↑ Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- ↑ „Nitrous oxide plant“. Sanghi Organization. Архивирано од изворникот на 27 November 2013. Посетено на 18 December 2013.
- ↑ "Nitrogen Family" Архивирано на 21 октомври 2014 г.. chemistry.tutorvista.com
- ↑ "Preparation of Nitrous Oxide from Urea, Nitric Acid and Sulfuric Acid".
- ↑ „Manufacture of Nitrous Oxide by the Catalytic Oxidation of Ammonia“. The Journal of the Society of Chemical Industry, Japan. 64 (11): 1879–1888. 1961. doi:10.1246/nikkashi1898.64.11_1879.
- ↑ Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier ISBN 0-12-352651-5
- ↑ „N2O Budget“. Global Carbon Project. Посетено на 2020-11-09.
- ↑ „Chapter 6“. TAR Climate Change 2001: The Scientific Basis. стр. 358.
- ↑ Ravishankara, A. R.; Daniel, John S.; Portmann, Robert W. (2009-08-27), „Supporting Online Material for - Nitrous Oxide (N2O): The Dominant Ozone-Depleting Substance Emitted in the 21st Century“ (PDF), Science, 326 (5949): 123–125, Bibcode:2009Sci...326..123R, doi:10.1126/science.1176985, PMID 19713491, Архивирано од изворникот (PDF) на 2022-10-09
- ↑ 100,0 100,1 „Chapter 8“. AR5 Climate Change 2013: The Physical Science Basis. стр. 731.
- ↑ 101,0 101,1 U.S. Environmental Protection Agency (2010), "Methane and Nitrous Oxide Emissions from Natural Sources".
- ↑ „2011 U.S. Greenhouse Gas Inventory Report“. U.S. Environmental Protection Agency. February 2011. Архивирано од изворникот на 25 March 2011. Посетено на 11 April 2011.
- ↑ Sloss, Leslie L. (1992). Nitrogen Oxides Control Technology Fact Book. William Andrew. стр. 6. ISBN 978-0-8155-1294-3.
- ↑ Bange, Hermann W. (2006). „Nitrous oxide and methane in European coastal waters“. Estuarine, Coastal and Shelf Science (англиски). 70 (3): 361–374. Bibcode:2006ECSS...70..361B. doi:10.1016/j.ecss.2006.05.042.
- ↑ Thompson, A. J.; Giannopoulos, G.; Pretty, J.; Baggs, E. M.; Richardson, D. J. (2012). „Biological sources and sinks of nitrous oxide and strategies to mitigate emissions“. Philosophical Transactions of the Royal Society B. 367 (1593): 1157–1168. doi:10.1098/rstb.2011.0415. PMC 3306631. PMID 22451101.
- ↑ McDermott-Murphy, Caitlin (6 June 2019). „No laughing matter“. The Harvard Gazette. Посетено на 22 July 2019.
- ↑ 107,0 107,1 107,2 K. L. Denman, G. Brasseur, et al. (2007), "Couplings Between Changes in the Climate System and Biogeochemistry".
- ↑ Steinfeld, H.; Gerber, P.; Wassenaar, T.; Castel, V.; Rosales, M.; de Haan, C. (2006). Livestock's long shadow: Environmental issues and options. Fao.org. Посетено на 2 February 2008.
- ↑ „Overview of Greenhouse Gases: Nitrous Oxide“. U.S. Environmental Protection Agency. 23 December 2015. Архивирано од изворникот на 12 August 2016. Посетено на 31 March 2016.
- ↑ „Nitrous Oxide: Sources and Emissions“. U.S. Environmental Protection Agency. 2006. Архивирано од изворникот на 16 January 2008. Посетено на 2 February 2008.
- ↑ IPCC. 2013.
- ↑ Thompson, R. L.; Lassaletta, L.; Patra, P. K.; Wilson, C.; Wells, K. C.; Gressent, A.; Koffi, E. N.; Chipperfield, M. P.; Winiwarter, W. (2019-11-18). „Acceleration of global N 2 O emissions seen from two decades of atmospheric inversion“. Nature Climate Change (англиски). 9 (12): 993–998. Bibcode:2019NatCC...9..993T. doi:10.1038/s41558-019-0613-7. ISSN 1758-6798.
- ↑ Molodovskaya, Marina; Warland, Jon; Richards, Brian K.; Öberg, Gunilla; Steenhuis, Tammo S. (2011). „Nitrous Oxide from Heterogeneous Agricultural Landscapes: Source Contribution Analysis by Eddy Covariance and Chambers“. Soil Science Society of America Journal. 75 (5): 1829. Bibcode:2011SSASJ..75.1829M. doi:10.2136/SSSAJ2010.0415.
- ↑ Molodovskaya, M.; Singurindy, O.; Richards, B. K.; Warland, J. S.; Johnson, M.; Öberg, G.; Steenhuis, T. S. (2012). „Temporal variability of nitrous oxide from fertilized croplands: hot moment analysis“. Soil Science Society of America Journal. 76 (5): 1728–1740. Bibcode:2012SSASJ..76.1728M. doi:10.2136/sssaj2012.0039.
- ↑ Singurindy, Olga; Molodovskaya, Marina; Richards, Brian K.; Steenhuis, Tammo S. (July 2009). „Nitrous oxide emission at low temperatures from manure-amended soils under corn (Zea mays L.)“. Agriculture, Ecosystems & Environment. 132 (1–2): 74–81. doi:10.1016/j.agee.2009.03.001.
- ↑ Mason, C.W.; Stoof, C.R.; Richards, B.K.; Das, S.; Goodale, C.L.; Steenhuis, T.S. (2017). „Hotspots of nitrous oxide emission in fertilized and unfertilized perennial grasses on wetness-prone marginal land in New York State“. Soil Science Society of America Journal. 81 (3): 450–458. Bibcode:2017SSASJ..81..450M. doi:10.2136/sssaj2016.08.0249.
- ↑ Reimer R. A.; Slaten C. S.; Seapan M.; Lower M. W.; Tomlinson P. E. (1994). „Abatement of N2O emissions produced in the adipic acid industry“. Environmental Progress. 13 (2): 134–137. doi:10.1002/ep.670130217.
- ↑ Shimizu, A.; Tanaka, K.; Fujimori, M. (2000). „Abatement of N2O emissions produced in the adipic acid industry“. Chemosphere – Global Change Science. 2 (3–4): 425–434. Bibcode:2000ChGCS...2..425S. doi:10.1016/S1465-9972(00)00024-6.
- ↑ Schneider, Lisa K.; Wüst, Anja; Pomowski, Anja; Zhang, Lin; Einsle, Oliver (2014). „Ch. 8 No Laughing Matter: The Unmaking of the Greenhouse Gas Dinitrogen Monoxide by Nitrous Oxide Reductase“. Во Kroneck, Peter M. H.; Sosa Torres, Martha E. (уред.). The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment. Metal Ions in Life Sciences. 14. Springer. стр. 177–210. doi:10.1007/978-94-017-9269-1_8. ISBN 978-94-017-9268-4. PMID 25416395.
- ↑ US Environmental Protection Agency, "Climate Change Indicators: Atmospheric Concentrations of Greenhouse Gases" Web document, accessed on 2017-02-14
- ↑ „4.1.1 Sources of Greenhouse Gases“. IPCC TAR WG1 2001. Архивирано од изворникот на 29 October 2012. Посетено на 21 September 2012.
- ↑ Crutzen, P. J.; Mosier, A. R.; Smith, K. A.; Winiwarter, W. (2008). „N2O release from agro-biofuel production negates global warming reduction by replacing fossil fuels“. Atmospheric Chemistry and Physics. 8 (2): 389–395. Bibcode:2008ACP.....8..389C. doi:10.5194/acp-8-389-2008.
- ↑ Mundschenk, Susanne (3 August 2022). „The Netherlands is showing how not to tackle climate change | The Spectator“. www.spectator.co.uk (англиски). Посетено на 2022-08-28.
- ↑ „Overview of Greenhouse Gases: Nitrous Oxide Emissions“. United States Environmental Protection Agency. October 6, 2016. Посетено на July 14, 2019.
- ↑ „US Nitrous Oxide Laws (alphabetically) Based on a search of online free legal databases. Conducted May 2002“. Center for Cognitive Liberty and Ethics. Архивирано од изворникот на 24 January 2008. Посетено на 27 January 2008.
- ↑ „CAL. PEN. CODE § 381b : California Code – Section 381b“. Lp.findlaw.com.
- ↑ „Lambeth Council bans laughing gas as recreational drug“. BBC News. 17 August 2015. Посетено на 17 August 2015.
- ↑ Anderton, Jim (26 June 2005). „Time's up for sham sales of laughing gas“. Beehive.govt.nz. Архивирано од изворникот на 8 January 2015.
- ↑ „Ohio Medical“ (PDF). www.ohiomedical.com. Архивирано од изворникот (PDF) на 17 April 2016. Посетено на 20 September 2017.
Надворешни врски
уреди- Упатство за безбедност и здравје при работа за азотен оксид
- Интервју со Пол Круцен Бесплатно видео на Нобеловецот Пол Круцен за неговата работа на распаѓање на озонот разговарајќи со нобеловецот Хари Крото од страна на Вега научен труст.
- Национален инвентар на загадувачи – Информативен лист за оксид на азот
- Национален институт за безбедност и здравје при работа – азотен оксид
- ЦДЦ – NIOSH Џебен водич за хемиски опасности – азотен оксид
- Најчесто поставувани прашања за азотен оксид
- Erowid напис за азотен оксид
- Азотниот оксид со прсти како чудовиште убиец на озон Архивирано на 29 септември 2012 г., Science News
- Стоматолошки страв Централна статија за употребата на азотен оксид во стоматологијата
- База на податоци за изменети држави Архивирано на 29 декември 2023 г.
