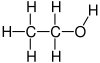
Етанол
Етанол (скрат. EtOH; исто така наречен етил алкохол, зрнест алкохол, алкохол за пиење, или едноставно алкохол) е органско соединение. Тоа е алкохол со хемиска формула C
2H
6O. Неговата формула може да се напише и како CH
3–CH
2–OH или C
2H
5OH (етил група поврзана со хидроксилна група). Етанолот е испарлива, запалива, безбојна течност со карактеристичен мирис на вино и лут вкус.[11][12] Тоа е психоактивна рекреативна дрога и активна состојка во алкохолните пијалаци.
| |||
| |||

| |||
Други називи апсолутен алкохол | |||
| Назнаки | |||
|---|---|---|---|
| 64-17-5 | |||
| 3DMet | B01253 | ||
| Бајлштајн | 1718733 | ||
| ChEBI | CHEBI:16236 | ||
| ChEMBL | ChEMBL545 | ||
| ChemSpider | 682 | ||
| DrugBank | DB00898 | ||
| 787 | |||
| |||
IUPHAR/BPS
|
2299 | ||
| 3Д-модел (Jmol) | Слика | ||
| KEGG | C00469 | ||
| PubChem | 702 | ||
| |||
| UNII | 3K9958V90M | ||
| ОН-бр. | UN 1170 | ||
| Својства | |||
| Хемиска формула | |||
| Моларна маса | 0 g mol−1 | ||
| Изглед | Безбојна течност | ||
| Мирис | како вино, остар[2] | ||
| Густина | 0,78945 g/cm3 (at 20 °C)[3] | ||
| Точка на топење | |||
| Точка на вриење | |||
| Miscible | |||
| log P | −0,18 | ||
| Парен притисок | 5,95 kPa (at 20 °C) | ||
| Киселост (pKa) | 15,9 (H2O), 29,8 (DMSO)[4][5] | ||
| −33,60·10−6 cm3/mol | |||
| Показател на прекршување (nD) | 1,3611[3] | ||
| Вискозност | 1,2 mPa·s (at 20 °C), 1,074 mPa·s (at 25 °C)[6] | ||
| Диполен момент | 1,69 D[7] | ||
| Опасност | |||
| GHS-ознаки: | |||
Пиктограми
|
 
| ||
Сигнални зборови
|
Опасност | ||
Изјави за опасност
|
H225, H319 | ||
Изјави за претпазливост
|
P210, P233, P240, P241, P242, P305+P351+P338 | ||
| NFPA 704 | |||
| Температура на запалување | 14 °C (Апсолутен)[9] | ||
| Смртоносна доза или концентрација: | |||
LD50 (средна доза)
|
7340 mg/kg (орално, стаорец) 7300 mg/kg (глушец) | ||
| NIOSH (здравствени граници во САД): | |||
PEL (дозволива)
|
TWA 1000 ppm (1900 mg/m3)[10] | ||
REL (препорачана)
|
TWA 1000 ppm (1900 mg/m3)[10] | ||
IDLH (непосредна опасност)
|
N.D.[10] | ||
| Безбедносен лист | [8] | ||
| Дополнителни податоци | |||
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |||
| Наводи | |||
Етанолот природно се произведува со процесот на ферментација на шеќери со квасец или преку петрохемиски процеси како што е хидратација на етилен. Историски се користел како општ анестетик и има современи медицински примени како антисептик, средство за дезинфекција, растворувач за некои лекови и противотров за труење со метанол и труење со етилен гликол.[13][14] Се користи како хемиски растворувач и во синтезата на органски соединенија и како извор на гориво. Етанолот, исто така, може да се дехидрира за да се направи етилен, важна хемиска суровина. Од 2006 година, светското производство на етанол беше 51 гигалитар, главно од Бразил и САД.[15]
Етимологија
уредиЕтанол е систематско име дефинирано од страна на Меѓународната унија за чиста и применета хемија за соединение кое се состои од алкилна група со два јаглеродни атоми (префикс „ет-“), кои имаат единечна врска меѓу нив (инфикс „-ан-“) и приложена −OH функционална група (наставка „-ол“).[16]
Префиксот „ет-“ и квалификаторот „етил“ во „етил алкохол“ првично потекнуваат од името „етил“ доделено во 1834 година на групата C2H5− од Јустус Либиг. Тој го измислил зборот од германското име Етер од соединението C2H5−O−C2H5 (на англиски најчесто се нарекува „етер“, поконкретно наречен „диетил етер“).[17] Според Оксфордскиот англиски речник, етил е контракција на старогрчкиот αἰθήρ (aithḗr, „горен воздух“) и грчкиот збор ὕλη (hýlē, „супстанција“).[18]
Името етанол е измислено како резултат на резолуцијата за именување на алкохоли и феноли која беше усвоена на Меѓународната конференција за хемиска номенклатура што се одржа во април 1892 година во Женева, Швајцарија.[19]
Терминот алкохол сега се однесува на поширока класа на супстанции во номенклатурата на хемијата, но во вообичаениот јазик останува името на етанол. Тоа е средновековен заем од арапски ал-кухл, прашкаста руда на антимон што се користела уште од антиката како козметика и го задржала тоа значење на среднолатинскиот.[20] Употребата на „алкохол“ за етанол (во целост, „алкохол од вино“) е модерна и за прв пат е забележана во 1753 година.[21]
Употреба
уредиМедицина
уредиАнестетик
уредиЕтанолот е најстариот познат седатив, кој се користел како орален општ анестетик за време на операцијата во античка Месопотамија и во средниот век.[13][14] Благата интоксикација започнува со концентрација на алкохол во крвта од 0,03 - 0,05 % и индуцира анестетичка кома на 0,4 %.[22] Сепак, оваа употреба носеше висок ризик од смртоносна алкохолна интоксикација и пулмонална аспирација при повраќање, што доведе до употреба на алтернативи во антиката, како што се опиумот и канабисот, а подоцна и диетил етер почнувајќи од 1840-тите.[23]
Антисептик
уредиЕтанолот се користи во медицински марамчиња и најчесто во антибактериски гелови за дезинфекција на раце како антисептик поради неговите бактерицидни и антигабични ефекти.[24] Етанолот ги убива микроорганизмите со растворање на нивниот мембрански липиден двослој и денатурирање на нивните белковини и е ефикасен против повеќето бактерии, габи и вируси. Сепак, тој е неефикасен против бактериски спори, но тоа може да се ублажи со користење на водород пероксид.[25] Растворот од 70 % етанол е поефикасен од чистиот етанол бидејќи етанолот се потпира на молекулите на водата за оптимална антимикробна активност. Апсолутниот етанол може да ги инактивира микробите без да ги уништи бидејќи алкохолот не може целосно да навлезе во мембраната на микробот.[26][27] Етанолот може да се користи и како средство за дезинфекција и антисептик бидејќи предизвикува дехидрација на клетките со нарушување на осмотската рамнотежа низ клеточната мембрана, па водата ја напушта клетката што доведува до клеточна смрт.[28]
Противотров
уредиЕтанолот може да се администрира како противотров за труење со етилен гликол[29] и труење со метанол.[30] Етанолот служи за овој процес со тоа што делува како конкурентен инхибитор против метанолот и етилен гликолот за алкохол дехидрогеназа.[31] Иако има повеќе несакани ефекти, етанолот е поевтин и полесно достапен од фомепизолот, кој исто така се користи како противотров за труење со метанол и етилен гликол.[32]
Медицински растворувач
уредиЕтанолот, често во високи концентрации, се користи за растворање на многу лекови нерастворливи во вода и сродни соединенија. Течните препарати од лекови против болки, лекови за кашлица и настинки и миење уста, на пример, може да содржат до 25 % етанол[33] и можеби треба да се избегнуваат кај лица со несакани реакции на етанол, како што се респираторните реакции предизвикани од алкохол.[34] Етанолот е присутен главно како антимикробен конзерванс во преку 700 течни препарати на лекови, вклучувајќи ацетаминофен, додатоци на железо, ранитидин, фуросемид, манитол, фенобарбитал, триметоприм/сулфаметоксазол и лекови против кашлица без рецепт.[35]
Фармакологија
уредиКај цицачите, етанолот примарно се метаболизира во црниот дроб и желудникот преку ензимите на алкохол дехидрогеназа (ADH).[36] Овие ензими ја катализираат оксидацијата на етанолот во ацеталдехид (етанал):[37]
- CH3CH2OH + NAD+ → CH3CHO + NADH + H+
Кога е присутен во значителни концентрации, овој метаболизам на етанол е дополнително потпомогнат од ензимот CYP2E1 на цитохром P450 кај луѓето, додека трагите исто така се метаболизираат со каталаза.[38]
Добиениот меѓупроизвод, ацеталдехид, е познат канцероген и претставува значително поголема токсичност кај луѓето од самиот етанол. Многу од симптомите типично поврзани со интоксикација со алкохол - како и многу од здравствените опасности типично поврзани со долгорочното консумирање на етанол - може да се припишат на токсичноста на ацеталдехид кај луѓето.[39]
Последователната оксидација на ацеталдехидот во ацетат се изведува со ензими на алдехид дехидрогеназа (ALDH). Мутација во генот ALDH2 што кодира за неактивна или дисфункционална форма на овој ензим влијае на приближно 50 % од популациите во источна Азија, придонесувајќи за карактеристичната реакција на црвенило на алкохол што може да предизвика привремено црвенило на кожата, како и голем број сродни и често непријатни симптоми на токсичност од ацеталдехид.[40] Оваа мутација е типично придружена со друга мутација на ензимот на алкохол дехидрогеназа ADH1B кај приближно 80 % од источните Азијци, што ја подобрува каталитичката ефикасност на конвертирањето на етанолот во ацеталдехид.[40]
Рекреација
уредиКако депресив на централниот нервен систем, етанолот е еден од најчесто консумираните психоактивни дроги.[41]
И покрај психоактивните и канцерогени својства на алкохолот, тој е лесно достапен и легален за продажба во повеќето земји. Сепак, постојат закони кои ја регулираат продажбата, извозот/увозот, оданочувањето, производството, потрошувачката и поседувањето на алкохолни пијалоци. Највообичаена регулатива е забраната за малолетници.
Гориво
уредиМоторно гориво
уреди| Тип на гориво | MJ/L | MJ/kg | Истражување |
|---|---|---|---|
| Суво дрво (20% влага) | ~19.5 | ||
| Метанол | 17.9 | 19.9 | 108.7[42] |
| Етанол | 21.2[43] | 26.8[43] | 108.6[42] |
| E85 (85% етанол, 15% бензин) |
25.2 | 33.2 | 105 |
| Течен природен гас | 25.3 | ~55 | |
| Автогас (ТНГ)
(60% пропан + 40% бутан) |
26.8 | 50 | |
| Воздухопловен бензин
(бензин со високи октани, не авионско гориво) |
33.5 | 46.8 | 100/130
(слаб/богат) |
| Гасохол
(90% бензин + 10% етанол) |
33.7 | 47.1 | 93/94 |
| Обичен бензин | 34.8 | 44.4[44] | min. 91 |
| Премиум бензин | max. 104 | ||
| Дизел | 38.6 | 45.4 | 25 |
| Јаглен, екструдиран | 50 | 23 |
Најголемата поединечна употреба на етанол е како гориво на моторот и како додаток на горивото. Бразил особено се потпира на употребата на етанол како гориво за моторот, делумно поради неговата улога како еден од водечките светски производители на етанол.[45][46] Бензинот што се продава во Бразил содржи најмалку 25 % безводен етанол. Водниот етанол (околу 95 % етанол и 5 % вода) може да се користи како гориво во повеќе од 90 % од новите автомобили на бензин што се продаваат во земјата.
САД и многу други земји првенствено користат Е10 (10 % етанол, понекогаш познат како газохол) и Е85 (85 % етанол) етанол/бензин мешавини. Со текот на времето, се верува дека материјалниот дел од ≈150 милијарди американски галони (570.000.000 m3) годишно за бензин ќе почне да се заменува со етанол за гориво.[47]
Австралискиот закон ја ограничува употребата на чист етанол од отпадот од шеќерна трска на 10 % во автомобилите. Кај постарите автомобили (и старите автомобили дизајнирани да користат гориво што гори побавно) треба да ги надградат или заменат вентилите на моторот.[48]
Според група за застапување во индустријата, етанолот како гориво ги намалува штетните емисии на јаглерод моноксид, честички, оксиди на азот и други загадувачи кои формираат озон.[49] Националната лабораторија Argonne ги анализирала емисиите на стакленички гасови на многу различни комбинации на мотори и горива и открила дека мешавината на биодизел/петродизел (B20) покажала намалување од 8 %, конвенционалната мешавина од етанол E85 намалување од 17 % и целулозниот етанол за 64 %, во споредба со чистиот бензин.[50] Етанолот има многу поголем истражувачки октански број (RON) од бензинот, што значи дека е помалку склон кон предзапалување, што овозможува подобро напредување на палењето што значи поголем вртежен момент и ефикасност покрај помалите емисии на јаглерод.[51]
Согорувањето на етанол во мотор со внатрешно согорување дава многу производи од нецелосно согорување произведени од бензин и значително поголеми количества формалдехид и сродни видови како што е ацеталдехидот.[52] Ова води до значително поголема фотохемиска реактивност и повеќе озон на нивото на земјата.[53] Овие податоци се собрани во извештајот за чисти горива за споредба на емисиите на гориво[54] и покажуваат дека издувните гасови од етанол создаваат 2,14 пати повеќе озон од издувните гасови на бензинот.[55] Кога ова ќе се додаде во прилагодениот индекс на локализирано загадување (LPI) на Извештајот за чисти горива, локалното загадување со етанол (загадување кое придонесува за смог) е оценето со 1,7, каде што бензинот е 1,0, а повисоките бројки значат поголемо загадување.[56] Одборот за воздушни ресурси на Калифорнија го формализираше ова прашање во 2008 година со признавање на контролните стандарди за формалдехидите како група за контрола на емисиите, слично како конвенционалните NOx и реактивни органски гасови (ROGs).[57]
Повеќе од 20 % од бразилските автомобили можат да користат 100 % етанол како гориво, што вклучува мотори само со етанол и мотори со флексибилно гориво.[58] Моторите со флекс гориво во Бразил можат да работат целосно со етанол, целосно со бензин или која било мешавина од двете. Во САД возилата со флексибилно гориво можат да работат на 0 % до 85 % етанол (15 % бензин), бидејќи мешавините со повисок етанол сè уште не се дозволени или ефикасни. Бразил ја поддржува оваа флота на автомобили што горат етанол со голема национална инфраструктура која произведува етанол од домашна шеќерна трска.
Високата спојливост на етанолот со вода го прави несоодветен за транспорт преку модерни цевководи како што се течните јаглеводороди.[59] Механичарите забележале зголемени случаи на оштетување на малите мотори (особено, карбураторот) и штетата ја припишуваат на зголеменото задржување на водата од етанолот во горивото.[60]
Ракетно гориво
уредиЕтанолот вообичаено се користел како гориво во раните бипропелантни ракетни возила (со течен погон), во врска со оксидатор како што е течниот кислород. Германската балистичка ракета А-4 од Втората светска војна (попозната по своето пропагандно име V-2),[61] за која се смета дека го започнала вселенското доба, користела етанол како главен составен дел на B-Stoff. Според таквата номенклатура, етанолот се мешал со 25 % вода за да се намали температурата на комората за согорување.[62][63] Дизајнерскиот тим на V-2 помогна да се развијат американски ракети по Втората светска војна, вклучувајќи ја и ракетата Редстоун со етанол, која го лансираше првиот американски сателит.[64] Алкохолите паднаа во општа неупотреба бидејќи беа развиени повеќе енергетски густи ракетни горива, [63] иако етанолот моментално се користи во лесните тркачки авиони со ракетен погон.[65]
Горивни ќелии
уредиКомерцијалните горивни ќелии работат на реформиран природен гас, водород или метанол. Етанолот е атрактивна алтернатива поради неговата широка достапност, ниска цена, висока чистота и мала токсичност. Постои широк спектар на концепти за горивни ќелии кои се навлезени во испитувања, вклучувајќи горивни ќелии со директен етанол, системи со авто-термичко реформирање и термички интегрирани системи. Поголемиот дел од работата се спроведува на ниво на истражување, иако има голем број организации на почетокот на комерцијализацијата на горивни ќелии со етанол.[66]
Греење и готвење на домаќинството
уредиКамините со етанол може да се користат за затоплување на домот или за украсување. Етанолот може да се користи и како гориво за шпоретот за готвење.[67][68]
Суровина
уредиЕтанолот е важна индустриска состојка. Има широка употреба како прекурсор за други органски соединенија како што се етил халиди, етил естри, диетил етер, оцетна киселина и етил амини.
Растворувач
уредиЕтанолот се смета за универзален растворувач, бидејќи неговата молекуларна структура овозможува растворање на поларни, хидрофилни и неполарни, хидрофобни соединенија. Бидејќи етанолот има и ниска точка на вриење, лесно се отстранува од растворот што се користел за растворање на други соединенија, што го прави популарно средство за екстракција за ботанички масла. Методите за екстракција на маслото од канабис често користат етанол како растворувач за екстракција[69] и исто така како растворувач по обработката за отстранување на маслата, восоците и хлорофилот од растворот во процес познат како зимирање.
Етанолот се наоѓа во боите, тинктурите, маркерите и производите за лична нега, како што се средствата за плакнење на уста, парфемите и дезодорансите. Полисахаридите се таложат од воден раствор во присуство на алкохол, а таложењето со етанол се користи поради оваа причина за прочистување на ДНК и РНК.
Течност со ниска температура
уредиПоради неговата ниска точка на замрзнување од -114 °C (-173 °F) и малата токсичност, етанолот понекогаш се користи во лаборатории (со сув мраз или други средства за ладење) како бања за ладење за да ги одржува садовите на температури под точката на замрзнување на водата. Од истата причина, се користи и како активна течност во алкохолните термометри.
Хемија
уредиХемиска формула
уредиЕтанолот е 2-јаглероден алкохол. Неговата молекулска формула е CH3CH2OH. Алтернативна ознака е CH3−CH2−OH,што покажува дека јаглеродот на метил групата (CH3−) е прикачен на јаглеродот на метиленската група (−CH2–), која е прикачена на кислородот од хидроксилната група (− OH). Тоа е конституционален изомер на диметил етер. Етанолот понекогаш се пишува скратено како EtOH, користејќи ја вообичаената ознака во органска хемија за претставување на етил групата (C2H5−) со Et.
Физички својства
уредиЕтанолот е испарлива, безбојна течност која има благ мирис. Гори со безчаден син пламен кој не е секогаш видлив при нормална светлина. Физичките својства на етанолот произлегуваат првенствено од присуството на неговата хидроксилна група и краткиот јаглероден синџир. Хидроксилната група на етанол е способна да учествува во водородното поврзување, што го прави повеќе вискозен и помалку испарлив од помалку поларните органски соединенија со слична молекуларна тежина, како што е пропанот.
Температурата на адијабатски пламен на етанолот за согорување во воздухот е 2082 °C или 3779 °F.[70]
Етанолот е малку порефрактивен од водата, со индекс на рефракција од 1.36242 (на λ=589.3 nm и 18.35 °C (65.03 °F)).[71] Тројната точка за етанолот е 150 K на притисок од 4.3 × 10−4 Pa.[72]
Одлики на растворувач
уредиЕтанолот е разновиден растворувач, кој се меша со вода и со многу органски растворувачи, вклучувајќи оцетна киселина, ацетон, бензен, јаглерод тетрахлорид, хлороформ, диетил етер, етилен гликол, глицерол, нитрометан, пиридин и толуен. Неговата главна употреба како растворувач е во правењето тинктура од јод, сирупи за кашлица итн.[71][73] Исто така, се меша со лесни алифатични јаглеводороди, како што се пентан и хексан, и со алифатични хлориди како што се трихлороетан и тетрахлороетилен.[73]
Мешаливоста на етанолот со вода е во контраст со немешаливоста на алкохолите со подолг синџир (пет или повеќе јаглеродни атоми), чија мешливост со вода нагло се намалува како што се зголемува бројот на јаглероди.[74] Мешаливоста на етанолот со алканите е ограничена на алкани до удекан: мешавините со додекан и повисоки алкани покажуваат јаз на мешање под одредена температура (околу 13 °C за додекан[75]). Јазот за мешање има тенденција да станува поширок со повисоки алкани, а температурата за целосно мешање се зголемува.
Мешавините етанол-вода имаат помал волумен од збирот на нивните поединечни компоненти во дадените фракции. Мешањето на еднакви количини на етанол и вода резултира со само 1,92 зафатнинска смеса.[71][76] Мешањето на етанол и вода е егзотермно, до 777 J/mol[77] што се ослободува на 298 K.
Мешавините на етанол и вода формираат азеотроп на околу 89 % етанол (количествен удел) и 11 % вода (количествен удел)[78] или мешавина од 95,6% етанол (масен удел) или околу 97% алкохол (зафатнински удел) при нормален притисок, која врие на 351 K (78 °C). Овој азеотропен состав е силно зависен од температурата и притисокот и исчезнува на температури под 303 K.[79]
Водородното поврзување предизвикува чистиот етанол да биде хигроскопен до степен до кој лесно ја апсорбира водата од воздухот. Поларната природа на хидроксилната група предизвикува етанолот да раствори многу јонски соединенија, особено натриум и калиум хидроксид, магнезиум хлорид, калциум хлорид, амониум хлорид, амониум бромид и натриум бромид.[73] Натриум и калиум хлоридот се малку растворливи во етанол.[73] Бидејќи молекулата на етанол има и неполарен крај, таа исто така ќе раствори неполарни супстанции, вклучувајќи ги повеќето есенцијални масла[80] и бројни ароми, бои и лековити средства.
Додавањето дури и неколку проценти етанол во водата нагло го намалува површинскиот напон на водата. Ова својство делумно го објаснува феноменот „солзи од вино“. Кога виното се врти во чаша, етанолот брзо испарува од тенкиот слој вино на ѕидот на чашата. Како што се намалува содржината на етанол во виното, неговата површинска напнатост се зголемува и тенкиот слој се „збива“ и поминува низ чашата во канали наместо како мазен лист.
Запаливост
уредиРастворот на етанол-вода ќе се запали ако се загрее над температура наречена точка на палење и потоа се примени извор на пламен на него.[81] За 20 % алкохол масен удел (околу 25 % зафатнински удел), тоа ќе се случи на околу 25 °C (77 °F). Точката на палење на чистиот етанол е 13 °C (55 °F),[82] но може да биде многу мало под влијание на атмосферскиот состав како што се притисокот и влажноста. Етанолните смеси може да запалат под просечна собна температура. Етанолот се смета за запалива течност (опасен материјал од класа 3) во концентрации над 2,35 %масен удел (3,0% волуменси удел).[83][84][85]
| Етанол масен удел, % |
Температура | |
|---|---|---|
| °C | °F | |
| 1 | 84.5 | 184.1[84] |
| 2 | 64 | 147[84] |
| 2.35 | 60 | 140[83][84] |
| 3 | 51.5 | 124.7[84] |
| 5 | 43 | 109[86] |
| 6 | 39.5 | 103.1[84] |
| 10 | 31 | 88[86] |
| 20 | 25 | 77[84] |
| 30 | 24 | 75[86] |
| 40 | 21.9 | 71.4[се бара извор][86] |
| 50 | 20 | 68[84][86] |
| 60 | 17.9 | 64.2[се бара извор][86] |
| 70 | 16 | 61[86] |
| 80 | 15.8 | 60.4[84] |
| 90 | 14 | 57[86] |
| 100 | 12.5 | 54.5[82][84][86] |
Јадењата кои користат запален алкохол за кулинарски ефекти се нарекуваат flambé.
Природна појава
уредиЕтанолот е нуспроизвод на метаболичкиот процес на квасецот. Како таков, етанолот ќе биде присутен во секое живеалиште на квасецот. Етанолот најчесто може да се најде во презреено овошје.[88] Етанолот произведен од симбиотски квасец може да се најде во бертамските палми. И покрај тоа што некои животински видови, како што е шушкава, покажуваат однесувања кои бараат етанол, повеќето не покажуваат интерес или избегнуваат извори на храна што содржат етанол.[89] Етанолот се произведува и при `ртење на многу растенија како резултат на природна анаеробиоза.[90] Етанолот е откриен во вселената, формирајќи ледена обвивка околу зрната прашина во меѓуѕвездените облаци.[91] Минутни количини (просечни 196 ppb) на ендоген етанол и ацеталдехид беа пронајдени во издишениот здив на здрави доброволци.[92] Синдромот на авто-пиварница, исто така познат како синдром на цревна ферментација, е ретка медицинска состојба во која опојните количини на етанол се произведуваат преку ендогена ферментација во дигестивниот систем.[93]
Производство
уредиЕтанолот се произведува и како петрохемија, преку хидратација на етилен и преку биолошки процеси, со ферментирање на шеќери со квасец.[94] Кој процес е поекономичен зависи од преовладувачките цени на резервите на нафта и житна храна.
Извори
уредиСветското производство на етанол во 2006 година беше 51 гигалитар, со 69 % од светската понуда која доаѓа од Бразил и САД.[15] Бразилскиот етанол се произведува од шеќерна трска, која има релативно високи приноси (830 % повеќе гориво од фосилните горива што се користат за негово производство) во споредба со некои други енергетски култури.[95] Шеќерната трска не само што има поголема концентрација на сахароза од пченката (за околу 30 %), туку и многу полесно се вади. Багасот генериран од процесот не се фрла, туку се согорува од електраните за производство на електрична енергија. Согорувањето на багасот сочинува околу 9 % од електричната енергија произведена во Бразил.[96]
Во 1970-тите, повеќето индустриски етанол во САД се произведувале како петрохемиски производи, но во 1980-тите САД воведоа субвенции за етанол базиран на пченка.[97] Според Здружението за обновливи горива, од 30 октомври 2007 година, 131 биорафинерија за етанол во САД имаат капацитет да произведуваат 7×109 US gal (26.000.000 m3) етанол годишно. Дополнителни 72 градежни проекти што се во тек (во САД) можат да додадат 6,4 милијарди американски галони (24.000.000 m3) нов капацитет во следните 18 месеци.[47]
Во Индија етанолот се прави од шеќерна трска.[98] Слаткиот сорго е уште еден потенцијален извор на етанол и е погоден за одгледување во суви услови. Меѓународниот институт за истражување на култури за полусуви тропски предели ја истражува можноста за одгледување сорго како извор на гориво, храна и добиточна храна во сушните делови на Азија и Африка.[99] Слаткиот сорго има една третина од потребата за вода од шеќерната трска во истиот временски период. Исто така бара околу 22 % помалку вода од пченката. Првата светска дестилерија за етанол за сладок сорго започна со комерцијално производство во 2007 година во Андра Прадеш, Индија.[100]
Хидратација
уредиЕтанолот може да се произведува од петрохемиските резерви на храна, првенствено со кисело катализирана хидратација на етилен. Често се нарекува синтетички етанол..
Катализаторот е најчесто фосфорна киселина,[101][102] се адсорбира на порозна потпора како што е силика гел или дијатомејска земја. Овој катализатор првпат беше користен за производство на етанол во големи размери од компанијата Shell Oil во 1947 година.[103] Реакцијата се изведува во присуство на пареа со висок притисок на 300 °C (572 °F) каде што се одржува сооднос 5:3 етилен и пареа.[104][105] Овој процес беше користен на индустриско ниво од страна на Union Carbide Corporation и други. Повеќе не се практикува во САД бидејќи етанолот од ферментација произведен од пченка е поекономичен.[106]
Во еден постар процес, првпат практикуван на индустриско ниво во 1930 година од страна на Union Carbide,[107] но сега речиси целосно застарен, етиленот се хидрираше индиректно со негова реакција со концентрирана сулфурна киселина за да се произведе етил сулфат, кој беше хидролизиран за да се добие етанол и да се регенерира сулфурната киселина:[108]
Од јаглерод диоксид
уредиЕтанолот е произведен во лабораторија со конвертирање на јаглерод диоксид преку биолошки и електрохемиски реакции.[109][110]
Ферментација
уредиЕтанолот во алкохолните пијалоци и горивото се произведува со ферментација. Одредени видови квасец (на пример, Saccharomyces cerevisiae) го метаболизираат шеќерот, произведувајќи етанол и јаглерод диоксид. Хемиските равенки подолу ја сумираат конверзијата:
Ферментацијата е процес на одгледување квасец под поволни термички услови за производство на алкохол. Овој процес се изведува на околу 35 – 40 °C (95 – 104 °F). Токсичноста на етанолот кон квасецот ја ограничува концентрацијата на етанолот што се добива со подготовка; повисоки концентрации, според тоа, се добиваат со фортификација или дестилација. Најмногу толерантни на етанол видови квасец можат да преживеат до приближно 18 % етанол волумен удел.
За да се произведе етанол од скробни материјали како што се житарките, скробот мора прво да се претвори во шеќери. Во подготовката на пивото, ова традиционално се постигнува со дозволување на зрното да 'ртат, или слад, кој го произведува ензимот амилаза. Кога сладното зрно се пасира, амилазата ги претвора преостанатиот скроб во шеќери.
Целулоза
уредиШеќери за ферментација на етанол може да се добијат од целулоза. Употребата на оваа технологија би можела да претвори голем број земјоделски нуспроизводи кои содржат целулоза, како што се пченкари, слама и струготини, во обновливи извори на енергија. Други земјоделски остатоци, како што е багасот од шеќерна трска и енергетски култури, како што е тревата, исто така може да бидат ферментирачки извори на шеќер.[111]
Тестирање
уредиПиварниците и постројките за биогориво користат два методи за мерење на концентрацијата на етанол. Инфрацрвените сензори за етанол ја мерат вибрациската фреквенција на растворениот етанол користејќи го опсегот C−H на 2900 cm−1. Овој метод користи релативно евтин сензор за цврста состојба кој го споредува опсегот C−H со референтната лента за да ја пресмета содржината на етанол. Пресметката го користи Ламберт-Беровиот закон. Алтернативно, со мерење на густината на почетниот материјал и густината на производот, со помош на хидрометар, промената на специфичната тежина за време на ферментацијата ја покажува содржината на алкохол. Овој евтин и индиректен метод има долга историја во индустријата за производство на пиво.
Прочистување
уредиДестилација
уредиЕтиленската хидратација или варењето произведува смеса од етанол-вода. За повеќето индустриски и горивни употреби, етанолот мора да се прочисти. Фракционата дестилација при атмосферски притисок може да концентрира етанол до 95,6% масен удел (89,5 количествен удел). Оваа смеса е азеотроп со точка на вриење од 78,1 °C (172,6 °F) и не може дополнително да се прочисти со дестилација. Додавањето на агенс за внесување, како што се бензен, циклохексан или хептан, овозможува да се формира нов тринарен азеотроп кој содржи етанол, вода и средство за внесување. Овој тринарен азеотроп со пониска температура на вриење се отстранува преференцијално, што доведува до етанол без вода.[102]
Молекуларни сита и средства за сушење
уредиОсвен со дестилација, етанолот може да се суши со додавање на средство за сушење, како што се молекуларните сита, целулозата или пченкарното брашно. Средствата за сушење може да се сушат и повторно да се користат.[102] Молекуларните сита може да се користат за селективно апсорпција на водата од 95,6% раствор на етанол.[112] Молекуларните сита со големина на пора од 3 Å, еден вид зеолит, ефикасно ги одземаат молекулите на водата додека ги пропуштаат молекулите на етанол. Загревањето на влажните сита ја исфрла водата, овозможувајќи регенерација на нивната способност за сушење.[113]
Мембрани и обратна осмоза
уредиМембраните може да се користат и за одвојување на етанолот и водата. Раздвојувањата базирани на мембрана не подлежат на ограничувањата на азеотропот вода-етанол бидејќи раздвојувањата не се засноваат на рамнотежа на пареа-течност. Мембраните често се користат во таканаречениот процес на дестилација со хибридна мембрана. Овој процес користи предконцентрациска дестилирана колона како прв чекор за одвојување. Понатамошното одвојување потоа се постигнува со мембрана која работи или во режим на пропустливост на пареа или во режим на первапорација. Пропустливоста на пареата користи напојување од мембрана на пареа, а первапорацијата користи течна мембрана.
Други техники
уредиРазлични други техники се дискутирани, вклучувајќи ги и следниве:[102]
- Солењето со употреба на калиум карбонат за да се искористи неговата нерастворливост ќе предизвика фазно одвојување со етанол и вода. Ова нуди многу мала нечистотија на калиум карбонат на алкохолот што може да се отстрани со дестилација. Овој метод е многу корисен за прочистување на етанолот со дестилација, бидејќи етанолот формира азеотроп со вода.
- Директна електрохемиска редукција на јаглерод диоксид до етанол во амбиентални услови со користење на бакарни наночестички на јаглероден наноспајк филм како катализатор;[114]
- Екстракција на етанол од каша од жито со суперкритичен јаглерод диоксид;
- Первапорација;
- Фракционо замрзнување се користи и за концентрирање на ферментирани алкохолни раствори, како што е традиционално направен Applejack (пијалак);
- Адсорпција на нишање под притисокот.[115]
Чистота на етанол
уредиДенатуриран алкохол
уредиЧистиот етанол и алкохолните пијалоци се многу оданочени како психоактивни дроги, но етанолот има многу намени кои не вклучуваат негова потрошувачка. За да се олесни даночното оптоварување за овие намени, повеќето јурисдикции се откажуваат од данокот кога средството е додадено во етанолот за да го направи несоодветно за пиење. Тие вклучуваат горчливи агенси како денатониум бензоат и токсини како што се метанол, нафта и пиридин. Производите од овој вид се нарекуваат денатуриран алкохол.[116][117]
Апсолутен алкохол
уредиАпсолутен или безводен алкохол се однесува на етанол со мала содржина на вода. Постојат различни степени со максимална содржина на вода која се движи од 1% до неколку делови на милион (ppm). Ако се користи азеотропна дестилација за отстранување на водата, таа ќе содржи траги од средството за сепарација на материјалот (на пр. бензен).[118] Апсолутен алкохол не е наменет за човечка исхрана. Апсолутниот етанол се користи како растворувач за лабораториски и индустриски апликации, каде што водата ќе реагира со други хемикалии и како алкохол за гориво. Спектроскопски етанол е апсолутен етанол со мала апсорпција во ултравиолетова и видлива светлина, погоден за употреба како растворувач во ултравиолетово-видливата спектроскопија.[119]
Чистиот етанол е класифициран како 200 доказ во САД, што е еквивалентно на 175 степени доказ во системот на ОК.[120]
Шпиритус
уредиНаместо безводен етанол за различни намени се користи ректификуван алкохол, азеотропен состав од 96% етанол кој содржи 4% вода. Духовите на виното се околу 94% етанол (188 доказ). Нечистотиите се различни од оние во 95% (190 доказ) лабораториски етанол.[121]
Реакции
уредиЕтанолот е класифициран како примарен алкохол, што значи дека јаглеродот на кој се прикачува неговата хидроксилна група има два водородни атоми исто така прикачени на него. Многу реакции на етанол се случуваат во неговата хидроксилна група.
Формирање на естер
уредиВо присуство на киселински катализатори, етанолот реагира со карбоксилни киселини за да произведе етил естри и вода:
- RCOOH + HOCH2CH3 → RCOOCH2CH3 + H2O
Оваа реакција, која се спроведува во големи размери индустриски, бара отстранување на водата од реакционата смеса додека се формира. Естрите реагираат во присуство на киселина или база за да го вратат алкохолот и солта. Оваа реакција е позната како сапонификација бидејќи се користи за подготовка на сапун. Етанолот може да формира и естри со неоргански киселини. Диетил сулфат и триетил фосфат се подготвуваат со третирање на етанол со сулфур триоксид и фосфор пентооксид соодветно. Диетил сулфатот е корисен етилирачки агенс во органската синтеза. Етил нитрит, подготвен од реакција на етанол со натриум нитрит и сулфурна киселина, порано се користел како диуретик.
Дехидрација
уредиВо присуство на кисели катализатори, алкохолите може да се претворат во алкени како што е етанолот во етилен. Вообичаено се користат цврсти киселини како што е алумина.[122]
- CH3CH2OH → H2C=CH2 + H2O
Бидејќи водата се отстранува од истата молекула, реакцијата е позната како внатремолекулска дехидрација. Внатремолекулската дехидрација на алкохол бара висока температура и присуство на кисел катализатор како што е сулфурна киселина.[123]
Етилен произведен од етанол добиен од шеќер (првенствено во Бразил) се натпреварува со етилен произведен од петрохемиски суровини како нафта и етан.
На пониска температура од онаа на внатремолекулската дехидрација, меѓумолекулската дехидрација на алкохол може и да произведува симетричен етер. Ова е реакција на кондензација. Во следниот пример, диетил етер се произведува од етанол:
- 2 CH3CH2OH → CH3CH2OCH2CH3 + H2O[124]
Согорување
уредиЦелосното согорување на етанол формира јаглерод диоксид и вода:
- C2H5OH (l) + 3 O2 (g) → 2 CO2 (g) + 3 H2O (l); −ΔHc = 1371 kJ/mol[125] = 29.8 kJ/g = 327 kcal/mol = 7.1 kcal/g
- C2H5OH (l) + 3 O2 (g) → 2 CO2 (g) + 3 H2O (g); −ΔHc = 1236 kJ/mol = 26.8 kJ/g = 295.4 kcal/mol = 6.41 kcal/g[126]
Специфична топлина = 2.44 kJ/(kg·K)
Киселинско-базна хемија
уредиЕтанолот е неутрална молекула и pH на растворот на етанол во вода е скоро 7,00. Етанолот може квантитативно да се претвори во неговата конјугирана база, етоксидниот јон (CH3CH2O−), со реакција со алкален метал како што е натриумот:[74]
- 2 CH3CH2OH + 2 Na → 2 CH3CH2ONa + H2
или многу силна база како натриум хидрид:
- CH3CH2OH + NaH → CH3CH2ONa + H2
Киселоста на водата и етанолот се скоро исти, како што е наведено со нивната pKa од 15,7 и 16 соодветно. Така, натриум етоксид и натриум хидроксид постојат во рамнотежа која е тесно избалансирана:
- CH3CH2OH + NaOH CH3CH2ONa + H2O
Халогенирање
уредиЕтанолот не се користи индустриски како прекурсор на етил халидите, но реакциите се илустративни. Етанолот реагира со водородни халиди за да произведе етил халиди како што се етил хлорид и етил бромид преку SN2 реакција:
- CH3CH2OH + HCl → CH3CH2Cl + H2O
HCl бара катализатор како што е цинк хлорид.[108] HBr бара рефлуксирање со катализатор на сулфурна киселина.[108] Етил халидите, во принцип, може да се произведуваат и со третирање на етанол со поспецијализирани средства за халогенирање, како што се тионил хлорид или фосфор трибромид.[74][108]
- CH3CH2OH + SOCl2 → CH3CH2Cl + SO2 + HCl
При третман со халогени во присуство на база, етанолот го дава соодветниот халоформ (CHX3, каде X = Cl, Br, I). Оваа конверзија се нарекува халоформна реакција.[127] Посредник во реакцијата со хлор е алдехидот наречен хлорал, кој формира хлорал хидрат при реакција со вода:[128]
- 4 Cl2 + CH3CH2OH → CCl3CHO + 5 HCl
- CCl3CHO + H2O → CCl3C(OH)2H
Оксидација
уредиЕтанолот може да се оксидира до ацеталдехид и понатаму да се оксидира до оцетна киселина, во зависност од реагенсите и условите.[108] Оваа оксидација не е од индустриска важност, но во човечкото тело, овие реакции на оксидација се катализираат од ензимот на црниот дроб алкохол дехидрогеназа. Производот на оксидација на етанолот, оцетна киселина, е хранлива материја за луѓето, како прекурсор на ацетил CoA, каде што ацетил групата може да се троши како енергија или да се користи за биосинтеза.
Метаболизам
уредиЕтанолот е сличен на макрохранливите материи како што се белковините, мастите и јаглехидратите по тоа што обезбедува калории. Кога се консумира и метаболизира, придонесува со 7 килокалории по грам преку метаболизмот на етанол.[129]
Биохемија
уредиЕтанолот е мала молекула и затоа поседува истовремено хидрофилни и липофилни одлики. Тоа му овозможува на етанолот лесно да ја помине плазма мембраната на клетката (пасивна дифузија), па затоа неговата концентрација вонклеточно и внатреклеточно е слична. Околу 95 % проценти од внесениот етанол се разградува во црниот дроб, а 5 % се излачува непроменет преку урината, потта и дишењето. Катаболизмот на етанол не е регулиран и е иреверзибилен - висока конзумација на етанол го намалува NAD+/NADH соодносот, што резултира со длабоки промени во метаболизмот.
Црниот дроб има централна улога во метаболизмот на етанолот. Тука се експримираат со најголема концентрација ензимите оксидацијата на етанолот. Главниот механизам преку кој етанолот се метаболизира опфаќа три ензими: алкохол дехидрогеназа, алдехид дехидрогеназа и ацетил-КоА синтетаза. Во првите два чекори се врши оксидација на молекулата на етанолот (алкохол > алдехид > карбонска киселина), каде акцептор на ослободените електрони е NAD+. Во првиот чекор се одвива во цитозолот, каде под каталитичко дејство на алкохол дехидрогеназата етанолот се оксидира до ацеталдехид. Вториот чекор се одвива во матрицата на митохондриите каде ензимот алдехид дехидрогеназа катализира оксидација на ацеталдехидот до ацетат (оцетна киселина). Притоа се генерираат 2 молекули NADH. Ацетатот во третиот чекор се претвора во ацетил-КоА (активирана оцетна киселина). Ацеталдехидот е реактивно соедниение и формира аддукти со најразлични структурни и функционални белковини при што ја нарушува нивната функција.
Во случај на хронично конзумирање на алкохол се индуцира вториот алтернативен механизам за разградба на етанолот: Микрозомалниот етанол оксидирачки систем (МЕОС) во мазниот ендоплазмичен ретикулум. Индуцирањето на МЕОС е основен механизам за развој на толеранција кон оваа супстанца. Овој пат е цитохром-P450 зависен и користи NADPH како коензим. Уделот во разградбата на етанолот изнесува околу 10-20 %. Ензимот значаен за оваа реакција (CYP2E1) им припаѓа на цитохром P450 монооксигеназите. Во реакцијата која овие ензими ја катализираат, ослободените протони и електрони при оксидација на супстратот се пренесуваат врз кислород. Овој ензим покрај етанолот метаболизира над 80 други супстанци (ксенобиотици) и е високо индуцибилен. МЕОС системот е локализиран главно во перивенозната метаболна зона 3 на црниот дроб, местото каде се јавува рана локализација на алкохолно оштетување на црниот дроб поради ацеталдехидот.
Ефекти на хронична конзумација на алкохол врз метаболизмот
уреди| Ефект | Причинител | Механизам |
|---|---|---|
| Закочување на цитратниот циклус | пораст на NADH и ATP | NADH е алостеричен инхибитор на клучните
ензими во цитратниот циклус.[130] |
| Зголемена продукција на лактат | Пируват се редуцира до лактат, а дарител на
електрони е NADH. Со тоа се овозможува регенерирање на NAD+ молекули за да се овозможи одвивање на гликолизата. | |
| Закочување на гликонеогенезата | -Опаѓање на количината на достапен пируват
како супстрат за de-novo синтеза на оксалацетат при гликонеогенезата. -Намалување на активноста на еден од клучните ензими во гликонеогенезата, пируват карбоксилаза, како резултат на намалена концентрација на пируват.[131] | |
| Намалена оксидација на масните киселини | намалена количина на
NAD+ |
-Намалена достапност на NAD+ како кофактор
во оксидацијата на масните киселини. -Инхибиција на трансферот на масните киселини од цитозолот во митохондриите преку инхибиција на карнитин-ацил трансферазата. |
| Зголемена синтеза на триацилглицериди
во црниот дроб |
-Зголемено преземање на масни киселини преку
крвотокот, настанати преку зголемена липолиза во адипоцитите. -Зголемена синтеза на масни киселини. -Зголемена достапност на глицерол-3-фосфат. | |
| Зголемена синтеза на кетонски тела | пораст на Ацетил-КоА | Ацетил-КоА ја стимулира кетогенезата. |
| Зголемена синтеза на масни киселини во
црниот дроб |
-Зголемена продукција на ацетил-КоА од ацетат
настанат со оксидација на ацеталдехидот. -Намалена активност на AMP-зависната киназа поради зголемена количина на ATP (>намалена на AMP), ја намалува инхибицјата на ацетил-КоА карбоксилазата што доведува до засилена активност, а со тоа и зголемена продукција на претходникот во синтезата на масните киселини малонил-КоА. | |
| Зголемена липолиза во адипоцитите | -Комплексни механизми (предмет на истражување):
намалени масти во адипозното ткиво се поврзани со зголемена акумулација на масти во црниот дроб (хепатоцитна стеатоза).[132] |
Безбедност
уредиЕтанолот е многу запалив и не треба да се користи околу отворен пламен.
Чистиот етанол ќе ги иритира кожата и очите.[133] Гадење, повраќање и интоксикација се симптоми на голтање. Долготрајната употреба со голтање може да резултира со сериозно оштетување на црниот дроб.[134] Атмосферските концентрации над еден промил се над границите за професионална изложеност на Европската унија.[134]
Историја
уредиФерментацијата на шеќер во етанол е една од најраните биотехнологии користени од луѓето. Етанолот е историски различно идентификуван како вински дух или жестоки духови,[135] и како aqua vitae или аква вита. Опојните ефекти од неговото консумирање се познати уште од античко време. Етанолот луѓето го користат уште од праисторијата како опојна состојка на алкохолните пијалоци. Исушените остатоци на керамиката стара 9.000 години пронајдена во Кина укажуваат на тоа дека луѓето од неолитот консумирале алкохолни пијалоци.[136]
Запалливата природа на издишувањето на виното веќе им била позната на античките природни филозофи како Аристотел (384–322 п.н.е.), Теофраст (о. 371–287 п.н.е.) и Плиниј Постариот (23/24–79 н.е.).[137] Сепак, ова не доведе веднаш до изолација на етанолот, дури и покрај развојот на понапредни техники за дестилација во римскиот Египет од вториот и третиот век.[138] Важно признание, за прв пат пронајдено во едно од записите што му се припишуваат на Џабир ибн Хајан (IX век н.е.), е дека со додавање сол на зовриеното вино, што ја зголемува релативната испарливост на виното, запаливоста на добиените пареи може да се зголеми.[139] Дестилацијата на вино е потврдена во арапските дела што му се припишуваат на ал-Кинди (о. 801-873 н.е.) и на ал-Фараби (о. 872-950) и во 28-та книга на ал-Захрави (латински: Abulcasis, 936 г. –1013) Китаб ал-Ташриф (подоцна преведена на латински како Liber servatoris).[140] Во дванаесеттиот век, рецептите за производство на аква ардени („запалена вода“, т.е. етанол) со дестилирање на вино со сол почнаа да се појавуваат во голем број латински дела, а до крајот на тринаесеттиот век стана широко позната супстанција меѓу западноевропските хемичари.[141]
Работите на Тадео Алдероти (1223-1296) опишуваат метод за концентрирање на етанол кој вклучува повторена фракциона дестилација преку водено ладење, со што може да се добие чистота на етанол од 90%.[142] Медицинските својства на етанолот ги проучувале Арналд од Виланова (1240–1311 н.е.) и Јован од Рупешиса (о. 1310–1366), од кои вториот го сметал за супстанца која го зачувува животот способна да ги спречи сите болести (аква витае или „вода на животот“, исто така наречена од Џон квинтесенција на виното).[143]
Во Кина, археолошките докази покажуваат дека вистинската дестилација на алкохол започнала за време на династиите Џин (1115–1234) или Јужна Сонг (1127–1279).[144] На археолошко наоѓалиште во Кинглонг, Хебеј, пронајдена е кабина која датира од 12 век.[144] Во Индија, вистинската дестилација на алкохол беше воведена од Блискиот Исток и беше во широка употреба во Султанатот Делхи до 14 век.[145]
Во 1796 година, германско-рускиот хемичар Јохан Тобијас Ловиц добил чист етанол со мешање делумно прочистен етанол (азеотроп од алкохол-вода) со вишок на безводен алкал и потоа дестилирање на смесата на тивок оган.[146] Францускиот хемичар Антоан Лавоазие го опишал етанолот како соединение од јаглерод, водород и кислород, а во 1807 година Николас-Теодор де Сосир ја одредил хемиската формула на етанолот.[147][148] Педесет години подоцна, Арчибалд Скот Купер ја објавил структурната формула на етанолот. Тоа беше една од првите утврдени структурни формули.[149]
Етанолот првпат бил подготвен синтетички во 1825 година од Мајкл Фарадеј. Тој откри дека сулфурната киселина може да апсорбира големи количини јаглен гас.[150] Добиениот раствор му го дал на Хенри Хенел, британски хемичар, кој во 1826 година открил дека содржи „сулфовинска киселина“ (етил водород сулфат).[151] Во 1828 година, Хенел и францускиот хемичар Жорж-Симон Серулас независно откриле дека сулфовинската киселина може да се разложи во етанол.[152][153] Така, во 1825 година Фарадеј несвесно открил дека етанолот може да се произведе од етилен (компонента на јагленот гас) со хидратација катализирана со киселина, процес сличен на сегашната индустриска синтеза на етанол.[154]
Етанолот се користел како гориво за светилки во САД уште во 1840 година, но данокот наметнат на индустриски алкохол за време на Граѓанската војна ја направил оваа употреба неекономична. Данокот бил укинат во 1906 година.[155] Употребата како автомобилско гориво датира од 1908 година, при што Ford Model T може да работи на бензин или етанол.[156] Тој се користи и кај шпиртни ламби.
Етанолот наменет за индустриска употреба често се произведува од етилен.[157] Етанолот има широко распространета употреба како растворувач на супстанции наменети за човечки контакт или конзумирање, вклучувајќи мириси, ароми, бои и лекови. Во хемијата, тој е и растворувач и суровина за синтеза на други производи. Има долга историја како гориво за топлина и светлина, а од неодамна и како гориво за мотори со внатрешно согорување.
Галерија
уреди-
Горење на испарен етанол во затворен простор
-
Горење на испарен етанол во затворен простор
Поврзано
уредиНаводи
уреди- ↑ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge, UK: The Royal Society of Chemistry. 2014. стр. 30. doi:10.1039/9781849733069-00001. ISBN 978-0-85404-182-4.
- ↑ „Ethanol“. PubChem. Посетено на 29 December 2022.
- ↑ 3,0 3,1 3,2 3,3 Haynes, William M., уред. (2011). CRC Handbook of Chemistry and Physics (XCII. изд.). Boca Raton, FL: CRC Press. стр. 3.246. ISBN 1439855110.
- ↑ Ballinger P, Long FA (1960). „Acid Ionization Constants of Alcohols. II. Acidities of Some Substituted Methanols and Related Compounds1,2“. Journal of the American Chemical Society. 82 (4): 795–798. doi:10.1021/ja01489a008.
- ↑ Arnett EM, Venkatasubramaniam KG (1983). „Thermochemical acidities in three superbase systems“. J. Org. Chem. 48 (10): 1569–1578. doi:10.1021/jo00158a001.
- ↑ Lide, David R., уред. (2012). CRC Handbook of Chemistry and Physics (92. изд.). Boca Raton, FL: CRC Press/Taylor and Francis. стр. 6–232. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ Lide, David R., уред. (2008). CRC Handbook of Chemistry and Physics (89. изд.). Boca Raton, FL: CRC Press. стр. 9–55. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ „MSDS Ethanol“. Посетено на 2023-01-12.
- ↑ „Ethanol“. webwiser.nlm.nih.gov (англиски). Посетено на 2021-06-25.
- ↑ 10,0 10,1 10,2 „Џебен водич за опасните хемиски материи #0262“. Национален институт за безбедност и здравје при работа (NIOSH). (англиски)
- ↑ „Ethanol“. PubChem. National Library of Medicine. Посетено на 28 September 2021.
- ↑ „Ethyl Alcohol“ (PDF). Hazardous Substance Fact Sheet. New Jersey Department of Health. Посетено на 28 September 2021.
- ↑ 13,0 13,1 Powell MA (2004). „9: Wine and the vine in ancient Mesopotamia: the cuneiform evidence“. Во McGovern PE, Fleming SJ, Katz SH (уред.). The Origins and Ancient History of Wine. Food and Nutrition in History and Anthropology. 11 (1. изд.). Amsterdam: Taylor & Francis. стр. 96–124. ISBN 978-0-203-39283-6. ISSN 0275-5769. Посетено на 2010-09-15.
- ↑ 14,0 14,1 Schnelle, Norbert (August 1965). „Alcohol Given Intravenously for General Anesthesia“. Surgical Clinics of North America. 45 (4): 1041–1049. doi:10.1016/S0039-6109(16)37650-2. PMID 14312998. Посетено на December 30, 2022.
- ↑ 15,0 15,1 „2008 World Fuel Ethanol Production“. Ellisville, Missouri: Renewable Fuels Association. Архивирано од изворникот на 24 September 2015. Посетено на 21 February 2011.
- ↑ „Ethanol – Compound Summary“. The PubChem Project. Bethesda, MD: National Center for Biotechnology Information.
- ↑ Liebig, Justus (1834). „Ueber die Constitution des Aethers und seiner Verbindungen“ [On the constitution of ether and its compounds]. Annalen der Pharmacie (германски). 9 (22): 1–39. Bibcode:1834AnP...107..337L. doi:10.1002/andp.18341072202.
From page 18: "Bezeichnen wir die Kohlenwasserstoffverbindung 4C + 10H als das Radikal des Aethers mit E2 und nennen es Ethyl, ..." (Let us designate the hydrocarbon compound 4C + 10H as the radical of ether with E2 and name it ethyl ...).
Занемарен непознатиот параметар|name-list-style=(help) - ↑ Harper, Douglas. „ethyl“. Online Etymology Dictionary.
- ↑ For a report on the 1892 International Conference on Chemical Nomenclature, see:
- Armstrong, Henry (1892). „The International Conference on Chemical Nomenclature“. Nature. 46 (1177): 56–59. Bibcode:1892Natur..46...56A. doi:10.1038/046056c0. Занемарен непознатиот параметар
|name-list-style=(help) - Armstrong's report is reprinted with the resolutions in English in: Armstrong, Henry (1892). „The International Conference on Chemical Nomenclature“. The Journal of Analytical and Applied Chemistry. 6 (1177): 390–400 (398). Bibcode:1892Natur..46...56A. doi:10.1038/046056c0.
The alcohols and the phenols will be called after the name of the hydrocarbon from which they are derived, terminated with the suffix ol (ex. pentanol, pentynol, etc.)
Занемарен непознатиот параметар|name-list-style=(help)
- Armstrong, Henry (1892). „The International Conference on Chemical Nomenclature“. Nature. 46 (1177): 56–59. Bibcode:1892Natur..46...56A. doi:10.1038/046056c0. Занемарен непознатиот параметар
- ↑ Multhauf, Robert P. (1966). The Origins of Chemistry. London: Oldbourne. ISBN 9782881245947. p. 205; OED; etymonline.com
- ↑ Berthelot, Marcellin; Houdas, Octave V. (1893). La Chimie au Moyen Âge. I. Paris: Imprimerie nationale. стр. 136.
- ↑ Kaveh, Anthony. „3 Natural, Ancient Anesthetics No One Talks About: Opium, Alcohol, Marijuana“. Dr. Anthony Kaveh, MD. Посетено на December 30, 2022.
- ↑ Grattan, N. "Treatment of Uterine Haemorrhage". Provincial Medicine and Surgical Journal. Vol. 1, No. 6 (Nov. 7, 1840), p. 107.
- ↑ Pohorecky, Larissa A.; Brick, John (January 1988). „Pharmacology of ethanol“. Pharmacology & Therapeutics. 36 (2–3): 335–427. doi:10.1016/0163-7258(88)90109-X. PMID 3279433.
- ↑ McDonnell G, Russell AD (January 1999). „Antiseptics and disinfectants: activity, action, and resistance“. Clinical Microbiology Reviews. 12 (1): 147–179. doi:10.1128/CMR.12.1.147. PMC 88911. PMID 9880479.
- ↑ „Chemical Disinfectants | Disinfection & Sterilization Guidelines | Guidelines Library | Infection Control | CDC“. www.cdc.gov (англиски). Посетено на 2018-01-29.
- ↑ „Why is 70% ethanol used for wiping microbiological working areas?“. ResearchGate (англиски). Посетено на 2018-01-29.
- ↑ „Ethanol“. www.drugbank.ca. Посетено на 28 January 2019.
- ↑ Scalley, Robert (September 2002). „Treatment of Ethylene Glycol Poisoning“. American Family Physician. 66 (5): 807–813. PMID 12322772. Посетено на 15 January 2018. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ Beauchamp, GA; Valento, M (September 2016). „Toxic Alcohol Ingestion: Prompt Recognition And Management In The Emergency Department“. Emergency Medicine Practice. 18 (9): 1–20. PMID 27538060.
- ↑ Sasanami, Misa; Yamada, Taihei; Obara, Takafumi; Nakao, Atsunori; Naito, Hiromichi (2020). „Oral Ethanol Treatment for Ethylene Glycol Intoxication“. Cureus. 12 (12): e12268. doi:10.7759/cureus.12268. ISSN 2168-8184. PMC 7827791 Проверете ја вредноста
|pmc=(help). PMID 33510981 Проверете ја вредноста|pmid=(help). - ↑ Anseeuw, Kurt; Sabbe, Marc B.; Legrand, Annemie (April 2008). „Methanol poisoning: the duality between 'fast and cheap' and 'slow and expensive'“. European Journal of Emergency Medicine. 15 (2): 107–109. doi:10.1097/MEJ.0b013e3282f3c13b. ISSN 0969-9546. PMID 18446077. S2CID 23861841.
- ↑ „Alcohol Content in Common Preparations“ (PDF). Medical Society of the State of New York. Архивирано од изворникот (PDF) на 2021-04-29. Посетено на October 8, 2019.
- ↑ Adams KE, Rans TS (December 2013). „Adverse reactions to alcohol and alcoholic beverages“. Annals of Allergy, Asthma & Immunology. 111 (6): 439–445. doi:10.1016/j.anai.2013.09.016. PMID 24267355.
- ↑ Zuccotti GV, Fabiano V (July 2011). „Safety issues with ethanol as an excipient in drugs intended for pediatric use“. Expert Opinion on Drug Safety. 10 (4): 499–502. doi:10.1517/14740338.2011.565328. PMID 21417862. S2CID 41876817.
- ↑ Farrés J, Moreno A, Crosas B, Peralba JM, Allali-Hassani A, Hjelmqvist L, и др. (September 1994). „Alcohol dehydrogenase of class IV (sigma sigma-ADH) from human stomach. cDNA sequence and structure/function relationships“. European Journal of Biochemistry. 224 (2): 549–557. doi:10.1111/j.1432-1033.1994.00549.x. PMID 7925371.
- ↑ Edenberg HJ, McClintick JN (December 2018). „Alcohol Dehydrogenases, Aldehyde Dehydrogenases, and Alcohol Use Disorders: A Critical Review“. Alcoholism: Clinical and Experimental Research. 42 (12): 2281–2297. doi:10.1111/acer.13904. PMC 6286250. PMID 30320893.
- ↑ Heit, C.; Dong, H.; Chen, Y.; Thompson, D.C.; Dietrich, R.A.; Vasiliou, V.K. (2013). „The Role of CYP2E1 in Alcohol Metabolism and Sensitivity in the Central Nervous System“. Cytochrome P450 2E1: Its Role in Disease and Drug Metabolism. Subcellular Biochemistry. 67. стр. 235–237. doi:10.1007/978-94-007-5881-0_8. ISBN 978-94-007-5880-3. PMC 4314297. PMID 23400924.
- ↑ „Alcohol Metabolism: An Update“. NIAA Publications. National Institute of Health. Архивирано од изворникот на 2021-02-28. Посетено на 10 March 2021.
- ↑ 40,0 40,1 Eng MY, Luczak SE, Wall TL (2007). „ALDH2, ADH1B, and ADH1C genotypes in Asians: a literature review“. Alcohol Research & Health. 30 (1): 22–27. PMC 3860439. PMID 17718397.
- ↑ Alcohol use and safe drinking Архивирано на 5 јули 2016 г.. US National Institutes of Health.
- ↑ 42,0 42,1 Eyidogan, Muharrem; Ozsezen, Ahmet Necati; Canakci, Mustafa; Turkcan, Ali (2010). „Impact of alcohol–gasoline fuel blends on the performance and combustion characteristics of an SI engine“. Fuel. 89 (10): 2713–2720. doi:10.1016/j.fuel.2010.01.032. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ 43,0 43,1 Thomas, George (2000). „Overview of Storage Development DOE Hydrogen Program“ (PDF). Livermore, California: Sandia National Laboratories. Архивирано од изворникот (PDF) на 21 February 2007.
- ↑ Thomas, George (2000). „Overview of Storage Development DOE Hydrogen Program“ (PDF). Sandia National Laboratories. Посетено на 1 August 2009. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ „Availability of Sources of E85“. Clean Air Trust. Посетено на 27 July 2015.
- ↑ „Fuel ethanol production worldwide“. Statista. Посетено на 2 June 2021.
- ↑ 47,0 47,1 „First Commercial U.S. Cellulosic Ethanol Biorefinery Announced“. Renewable Fuels Association. 20 November 2006. Посетено на 31 May 2011.
- ↑ Green, Ray. „Model T Ford Club Australia (Inc.)“. Архивирано од изворникот на 14 јануари 2014. Посетено на 24 јуни 2011. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ „Ethanol 101“. American Coalition for Ethanol. Архивирано од изворникот на 2020-11-14. Посетено на 2023-03-03.
- ↑ Energy Future Coalition. „The Biofuels FAQs“. The Biofuels Source Book. United Nations Foundation. Архивирано од изворникот на 19 February 2011.
- ↑ Malaquias, Augusto César Teixeira; Netto, Nilton Antonio Diniz; Filho, Fernando Antonio Rodrigues; da Costa, Roberto Berlini Rodrigues; Langeani, Marcos; Baêta, José Guilherme Coelho (2019-11-18). „The misleading total replacement of internal combustion engines by electric motors and a study of the Brazilian ethanol importance for the sustainable future of mobility: a review“. Journal of the Brazilian Society of Mechanical Sciences and Engineering (англиски). 41 (12): 567. doi:10.1007/s40430-019-2076-1. ISSN 1806-3691.
- ↑ California Air Resources Board (October 1989). „Definition of a Low Emission Motor Vehicle in Compliance with the Mandates of Health and Safety Code Section 39037.05, second release“. Архивирано од изворникот на 18 February 2018. Посетено на 18 February 2018.
- ↑ Lowi A, Carter WP (March 1990). A Method for Evaluating the Atmospheric Ozone Impact of Actual Vehicle emissions. S.A.E. Technical Paper. Warrendale, Pennsylvania.
- ↑ Jones TT (2008). „The Clean Fuels Report: A Quantitative Comparison Of Motor (engine) Fuels, Related Pollution and Technologies“. researchandmarkets.com. Архивирано од изворникот на 9 September 2012.
- ↑ Tao, Rongjia (16–20 August 2010). Electro-rheological Fluids and Magneto-rheological Suspensions. Proceedings of the 12th International Conference. Philadelphia: World Scientific. ISBN 9789814340229. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ Biello, David. „Want to Reduce Air Pollution? Don't Rely on Ethanol Necessarily“. Scientific American (англиски). Посетено на 11 July 2017. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ „Adoption of the Airborne Toxic Control Measure to Reduce Formaldehyde Emissions from Composite Wood Products“. Chicago & Washington, DC: Window and Door Manufacturers Association. 30 July 2008. Архивирано од изворникот на 9 March 2010.
- ↑ „Tecnologia flex atrai estrangeiros“ (португалски). Agência Estado.
- ↑ Horn, Miriam; Krupp, Fred (16 March 2009). Earth: The Sequel: The Race to Reinvent Energy and Stop Global Warming. Physics Today. 62. стр. 63–65. Bibcode:2009PhT....62d..63K. doi:10.1063/1.3120901. ISBN 978-0-393-06810-8. S2CID 153892198. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ "Mechanics see ethanol damaging small engines"Архивирано на 23 септември 2020 г., NBC News, 8 January 2008
- ↑ Clark, John D. (2017). Ingnition! An Informal History of Liquid Rocket Propellants. New Brunswick, New Jersey: Rutgers University Press. стр. 9. ISBN 978-0-8135-9583-2.
- ↑ Darling, David. „The Internet Encyclopedia of Science: V-2“. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ Braeunig, Robert A. "Rocket Propellants" Архивирано на 15 јуни 2012 г.. Rocket & Space Technology, 2006. Retrieved 23 August 2007.
- ↑ "A Brief History of Rocketry". Архивирано на 5 август 2006 г. NASA Historical Archive.
- ↑ Chow, Denise (26 April 2010). „Rocket Racing League Unveils New Flying Hot Rod“. Space.com. Посетено на 27 April 2010. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ Badwal SP, Giddey S, Kulkarni A, Goel J, Basu S (May 2015). „Direct ethanol fuel cells for transport and stationary applications – A comprehensive review“. Applied Energy. 145: 80–103. doi:10.1016/j.apenergy.2015.02.002.
- ↑ Immergut, Debra Jo (3 December 2015). „Can Ethanol Fireplaces Be Cozy?“. The Wall Street Journal. Посетено на 2 March 2016.
- ↑ Rajvanshi AK, Patil SM, Mendonca B (March 2007). „Low-concentration ethanol stove for rural areas in India“. Energy for Sustainable Development. 11 (1): 94–99. CiteSeerX 10.1.1.142.5846. doi:10.1016/S0973-0826(08)60568-2.
- ↑ „Your Guide to Ethanol Extraction“. Cannabis Business Times (англиски). Посетено на 2019-04-09.
- ↑ „Flame Temperature Analysis and NOx Emissions for Different Fuels“. Mississippi State Department of Chemical Engineering.
- ↑ 71,0 71,1 71,2 Lide, D. R., уред. (2000). CRC Handbook of Chemistry and Physics 81st edition. CRC press. ISBN 978-0-8493-0481-1. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ „What is the triple point of alcohol?“. Webanswers.com. 31 декември 2010. Архивирано од изворникот на 14 мај 2013.Предлошка:SCICN
- ↑ 73,0 73,1 73,2 73,3 Windholz, Martha (1976). The Merck index: an encyclopedia of chemicals and drugs (9. изд.). Rahway, NJ: Merck. ISBN 978-0-911910-26-1. Занемарен непознатиот параметар
|name-list-style=(help)[се бара страница] - ↑ 74,0 74,1 74,2 Morrison, Robert Thornton; Boyd, Robert Neilson (1972). Organic Chemistry (2. изд.). Allyn and Bacon, inc. ISBN 978-0-205-08452-4. Занемарен непознатиот параметар
|name-list-style=(help)[се бара страница] - ↑ Dahlmann U, Schneider GM (1989). „(Liquid + liquid) phase equilibria and critical curves of (ethanol + dodecane or tetradecane or hexadecane or 2,2,4,4,6,8,8-heptamethylnonane) from 0.1 MPa to 120.0 MPa“. J Chem Thermodyn. 21 (9): 997–1004. doi:10.1016/0021-9614(89)90160-2.
- ↑ „Ethanol“. Encyclopedia of chemical technology. 9. 1991. стр. 813.
- ↑ Costigan MJ, Hodges LJ, Marsh KN, Stokes RH, Tuxford CW (1980). „The Isothermal Displacement Calorimeter: Design Modifications for Measuring Exothermic Enthalpies of Mixing“. Aust. J. Chem. 33 (10): 2103. Bibcode:1982AuJCh..35.1971I. doi:10.1071/CH9802103.
- ↑ Lei Z, Wang H, Zhou R, Duan Z (2002). „Influence of salt added to solvent on extractive distillation“. Chem. Eng. J. 87 (2): 149–156. doi:10.1016/S1385-8947(01)00211-X.
- ↑ Pemberton RC, Mash CJ (1978). „Thermodynamic properties of aqueous non-electrolyte mixtures II. Vapour pressures and excess Gibbs energies for water + ethanol at 303.15 to 363.15 K determined by an accurate static method“. J Chem Thermodyn. 10 (9): 867–888. doi:10.1016/0021-9614(78)90160-X.
- ↑ Merck Index of Chemicals and Drugs, 9th ed.; monographs 6575 through 6669
- ↑ „Flash Point and Fire Point“. Nttworldwide.com. Архивирано од изворникот на 14 December 2010.
- ↑ 82,0 82,1 NFPA 325: Guide to Fire Hazard Properties of Flammable Liquids, Gases, and Volatile Solids. Quincy, Massachusetts: National Fire Protection Association (NFPA). 1 January 1994.
- ↑ 83,0 83,1 „49 CFR § 173.120 – Class 3 – Definitions“. Legal Information Institute.
a flammable liquid (Class 3) means a liquid having a flash point of not more than 60 °C (140 °F)
- ↑ 84,00 84,01 84,02 84,03 84,04 84,05 84,06 84,07 84,08 84,09 84,10 Martínez, P. J.; Rus, E.; Compaña, J. M. „Flash Point Determination of Binary Mixtures of Alcohols, Ketones and Water“. Departamento de Ingeniería Química, Facultad de Ciencias. p. 3, Table 4.
- ↑ „49 CFR § 172.101 – Purpose and use of hazardous materials table“. Legal Information Institute, Cornell University.
Hazardous materials descriptions and proper shipping names: Ethanol or Ethyl alcohol or Ethanol solutions or Ethyl alcohol solutions; Hazard class or Division: 3; Identification Numbers: UN1170; PG: II; Label Codes: 3;
- ↑ 86,00 86,01 86,02 86,03 86,04 86,05 86,06 86,07 86,08 86,09 Ha, Dong-Myeong; Park, Sang Hun; Lee, Sungjin (April 2015). „The Measurement of Flash Point of Water-Methanol and Water-Ethanol Systems Using Seta Flash Closed Cup Tester“. Fire Science and Engineering. 29 (2): 39–43. doi:10.7731/KIFSE.2015.29.2.039.
Page 4, Table 3
- ↑ „Flash points of ethanol-based water solutions“. Engineeringtoolbox.com. Посетено на 23 June 2011.
- ↑ Dudley R (August 2004). „Ethanol, fruit ripening, and the historical origins of human alcoholism in primate frugivory“. Integrative and Comparative Biology. 44 (4): 315–323. doi:10.1093/icb/44.4.315. PMID 21676715.
- ↑ Graber, Cynthia (2008). „Fact or Fiction?: Animals Like to Get Drunk“. Scientific American. Посетено на 23 July 2010. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ Leblová, Sylva; Sinecká, Eva; Vaníčková, Věra (1974). „Pyruvate metabolism in germinating seeds during natural anaerobiosis“. Biologia Plantarum. 16 (6): 406–411. doi:10.1007/BF02922229. S2CID 34605254. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ Schriver A, Schriver-Mazzuoli L, Ehrenfreund P, d'Hendecourt L (2007). „One possible origin of ethanol in interstellar medium: Photochemistry of mixed CO2–C2H6 films at 11 K. A FTIR study“. Chemical Physics. 334 (1–3): 128–137. Bibcode:2007CP....334..128S. doi:10.1016/j.chemphys.2007.02.018.
- ↑ Turner C, Spanel P, Smith D (2006). „A longitudinal study of ethanol and acetaldehyde in the exhaled breath of healthy volunteers using selected-ion flow-tube mass spectrometry“. Rapid Communications in Mass Spectrometry. 20 (1): 61–68. Bibcode:2006RCMS...20...61T. doi:10.1002/rcm.2275. PMID 16312013.
- ↑ Doucleff, Michaeleen (17 September 2013). „Auto-Brewery Syndrome: Apparently, You Can Make Beer In Your Gut“. NPR. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ Mills GA, Ecklund EE (1987). „Alcohols as Components of Transportation Fuels“. Annual Review of Energy. 12: 47–80. doi:10.1146/annurev.eg.12.110187.000403.
- ↑ Reel M (19 August 2006). „Brazil's Road to Energy Independence“. The Washington Post.
- ↑ Rossi, Liane M.; Gallo, Jean Marcel R.; Mattoso, Luiz H. C.; Buckeridge, Marcos S.; Licence, Peter; Allen, David T. (2021-03-29). „Ethanol from Sugarcane and the Brazilian Biomass-Based Energy and Chemicals Sector“. ACS Sustainable Chemistry & Engineering (англиски). 9 (12): 4293–4295. doi:10.1021/acssuschemeng.1c01678. ISSN 2168-0485. S2CID 233676614 Проверете ја вредноста
|s2cid=(help). - ↑ Wittcoff, Harold A.; Reuben, Bryan G.; Plotkin, Jeffery S. (2004). Industrial Organic Chemicals. John Wiley & Sons. стр. 136–. ISBN 978-0-471-44385-8. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ Swami, V. N. (2020). विद्याभराती जिल्हा मध्यवर्ती सहकारी बँक भारती परीक्षा मार्गदर्शक. Latur, Maharashtra, India: Vidyabharti Publication. стр. 119.
- ↑ "Sweet sorghum for food, feed and fuel". New Agriculturalist, January 2008.
- ↑ "Developing a sweet sorghum ethanol value chain" Архивирано на 23 февруари 2014 г.. ICRISAT, 2013
- ↑ Roberts, John D.; Caserio, Marjorie C. (1977). Basic Principles of Organic Chemistry. W. A. Benjamin. ISBN 978-0-8053-8329-4. Занемарен непознатиот параметар
|name-list-style=(help)[се бара страница] - ↑ 102,0 102,1 102,2 102,3 Kosaric, Naim; Duvnjak, Zdravko; Farkas, Adalbert; Sahm, Hermann; Bringer-Meyer, Stephanie; Goebel, Otto; Mayer, Dieter (2011). „Ethanol“. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. стр. 1–72. doi:10.1002/14356007.a09_587.pub2. ISBN 978-3-527-30673-2. Занемарен непознатиот параметар
|name-list-style=(help)(бара претплата) - ↑ „Ethanol“. Encyclopedia of chemical technology. 9. 1991. стр. 82.
- ↑ "Ethanol" Архивирано на 13 јануари 2015 г.. Essential Chemical Industry.
- ↑ Harrison, Tim (May 2014). "Catalysis Web Pages for Pre-University Students V1_0" Архивирано на 5 март 2021 г.. Bristol ChemLabs, School of Chemistry, University of Bristol
- ↑ Tullo, Alexander (2021-08-26). „Last synthetic ethanol plant in US to close“. cen.acs.org. Посетено на 2022-11-22.
- ↑ Lodgsdon JE (1991). „Ethanol“. Во Howe-Grant M, Kirk RE, Othmer DF, Kroschwitz JI (уред.). Encyclopedia of chemical technology. 9 (4. изд.). New York: Wiley. стр. 817. ISBN 978-0-471-52669-8.
- ↑ 108,0 108,1 108,2 108,3 108,4 Streitwieser, Andrew; Heathcock, Clayton H. (1976). Introduction to Organic Chemistry. MacMillan. ISBN 978-0-02-418010-0. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ Liew F, Henstra AM, Köpke M, Winzer K, Simpson SD, Minton NP (March 2017). „Metabolic engineering of Clostridium autoethanogenum for selective alcohol production“. Metabolic Engineering. 40: 104–114. doi:10.1016/j.ymben.2017.01.007. PMC 5367853. PMID 28111249.
- ↑ „Solar-to-Fuel System Recycles CO2 for Ethanol and Ethylene“. News Center (англиски). 18 September 2017. Посетено на 19 September 2017.
- ↑ Clines, Tom (July 2006). „Brew Better Ethanol“. Popular Science Online. Архивирано од изворникот на 3 November 2007. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ Chemists, American Association of Cereal (1986). Advances in Cereal Science and Technology (англиски). American Association of Cereal Chemists, Incorporated. ISBN 978-0-913250-45-7.
- ↑ Dale Callaham, Molecular Sieve Information
- ↑ Song, Yang; Peng, Rui; Hensley, Dale K.; Bonnesen, Peter V.; Liang, Liangbo; Wu, Zili; Meyer, Harry M.; Chi, Miaofang; Ma, Cheng; Sumpter, Bobby G.; Rondinone, Adam J. (2016). „High-Selectivity Electrochemical Conversion of CO2 to Ethanol using a Copper Nanoparticle/N-Doped Graphene Electrode“. ChemistrySelect. 1 (Preprint): 6055–6061. doi:10.1002/slct.201601169. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ Jeong, Jun-Seong; Jeon, Hyungjin; Ko, Kyung-mo; Chung, Bongwoo; Choi, Gi-Wook (2012). „Production of anhydrous ethanol using various PSA (Pressure Swing Adsorption) processes in pilot plant“. Renewable Energy. 42: 41–45. doi:10.1016/j.renene.2011.09.027. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ „U-M Program to Reduce the Consumption of Tax-free Alcohol; Denatured Alcohol a Safer, Less Expensive Alternative“ (PDF). University of Michigan. Архивирано од изворникот (PDF) на 27 ноември 2007. Посетено на 29 септември 2007.
- ↑ Great Britain (2005). The Denatured Alcohol Regulations 2005 Архивирано на 9 декември 2009 г.. Statutory Instrument 2005 No. 1524.
- ↑ Bansal, Raj K.; Bernthsen, August (2003). A Textbook of Organic Chemistry. New Age International Limited. стр. 402–. ISBN 978-81-224-1459-2. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ Christian, Gary D. (2004). „Solvents for Spectrometry“. Analytical chemistry. 1 (6. изд.). Hoboken, NJ: John Wiley & Sons. стр. 473. ISBN 978-0-471-21472-4. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ Andrews, Sudhir (1 August 2007). Textbook Of Food & Bevrge Mgmt. Tata McGraw-Hill Education. стр. 268–. ISBN 978-0-07-065573-7. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ Kunkee RE, Amerine MA (July 1968). „Sugar and alcohol stabilization of yeast in sweet wine“. Applied Microbiology. 16 (7): 1067–1075. doi:10.1128/AEM.16.7.1067-1075.1968. PMC 547590. PMID 5664123.
- ↑ Zimmermann, Heinz; Walz, Roland (2008). „Ethylene“. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a10_045.pub3. ISBN 978-3-527-30673-2.
- ↑ „14.4: Dehydration Reactions of Alcohols“. Chemistry LibreTexts (англиски). 2016-02-09. Посетено на 2022-05-09.
- ↑ „Alkenes from Dehydration of Alcohols“. Chemistry LibreTexts (англиски). 2013-10-02. Посетено на 2022-05-09.
- ↑ Rossini, Frederick D. (1937). „Heats of Formation of Simple Organic Molecules“. Ind. Eng. Chem. 29 (12): 1424–1430. doi:10.1021/ie50336a024. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ Calculated from heats of formation from CRC Handbook of Chemistry and Physics, 49th Edition, 1968–1969.
- ↑ Chakrabartty SK (1978). Trahanovsky WS (уред.). Oxidation in Organic Chemistry. New York: Academic Press. стр. 343–370.
- ↑ Reinhard, Jira; Kopp, Erwin; McKusick, Blaine C.; Röderer, Gerhard; Bosch, Axel; Fleischmann, Gerald (2007). „Chloroacetaldehydes“. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a06_527.pub2. ISBN 978-3-527-30673-2. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ Cederbaum, Arthur I (2012-11-16). „Alcohol Metabolism“. Clinics in Liver Disease. 16 (4): 667–685. doi:10.1016/j.cld.2012.08.002. ISSN 1089-3261. PMC 3484320. PMID 23101976.
- ↑ Berg, Jeremy M.; Tymoczko, John L.; Stryer, Lubert (2002). „Entry to the Citric Acid Cycle and Metabolism Through It Are Controlled“. Biochemistry. 5th edition (англиски).
- ↑ Krebs, H. A.; Freedland, R. A.; Hems, R.; Stubbs, Marion (1969-03-01). „Inhibition of hepatic gluconeogenesis by ethanol“. Biochemical Journal (англиски). 112 (1): 117–124. doi:10.1042/bj1120117. ISSN 0306-3283.
- ↑ Zhong, Wei; Zhao, Yantao; Tang, Yunan; Wei, Xiaoli; Shi, Xue; Sun, Wenlong; Sun, Xiuhua; Yin, Xinmin; Sun, Xinguo (2012-03). „Chronic Alcohol Exposure Stimulates Adipose Tissue Lipolysis in Mice“. The American Journal of Pathology (англиски). 180 (3): 998–1007. doi:10.1016/j.ajpath.2011.11.017. PMC 3349880. PMID 22234172. Проверете ги датумските вредности во:
|date=(help)CS1-одржување: PMC-формат (link) - ↑ Minutes of Meeting Архивирано на 16 април 2021 г.. Technical Committee on Classification and Properties of Hazardous Chemical Data (12–13 January 2010).
- ↑ 134,0 134,1 „Safety data for ethyl alcohol“. University of Oxford. 9 May 2008. Архивирано од изворникот на 14 July 2011. Посетено на 3 January 2011.
- ↑ William Campbell Ottley, A Dictionary of Chemistry, and of Mineralogy Архивирано на 16 октомври 2022 г. (1826) see entry "Alcohol"
- ↑ Roach J (18 July 2005). „9,000-Year-Old Beer Re-Created From Chinese Recipe“. National Geographic News. Посетено на 3 September 2007.
- ↑ Berthelot & Houdas 1893, vol. I, p. 137.
- ↑ Berthelot & Houdas 1893, vol. I, pp. 138-139.
- ↑ al-Hassan, Ahmad Y. (2009). „Alcohol and the Distillation of Wine in Arabic Sources from the 8th Century“. Studies in al-Kimya': Critical Issues in Latin and Arabic Alchemy and Chemistry. Hildesheim: Georg Olms Verlag. стр. 283–298. (same content also available on the author's website Архивирано на 29 декември 2015 г.).
- ↑ al-Hassan 2009 (same content also available on the author's website Архивирано на 29 декември 2015 г.); cf. Berthelot & Houdas 1893, vol. I, pp. 141, 143. Sometimes, sulfur was also added to the wine (see Berthelot & Houdas 1893, vol. I, p. 143).
- ↑ Multhauf 1966, стр. 204–206.
- ↑ Holmyard, Eric John (1957). Alchemy. Harmondsworth: Penguin Books. ISBN 978-0-486-26298-7. pp. 51–52.
- ↑ Principe, Lawrence M. (2013). The Secrets of Alchemy. Chicago: The University of Chicago Press. ISBN 978-0-226-10379-2. pp. 69-71.
- ↑ 144,0 144,1 Haw, Stephen G. (2006). „Wine, women and poison“. Marco Polo in China. Routledge. стр. 147–148. ISBN 978-1-134-27542-7. Посетено на 10 July 2016.
The earliest possible period seems to be the Eastern Han dynasty... the most likely period for the beginning of true distillation of spirits for drinking in China is during the Jin and Southern Song dynasties
Занемарен непознатиот параметар|name-list-style=(help) - ↑ Habib, Irfan (2011). Economic History of Medieval India, 1200–1500. Pearson Education India. стр. 55–. ISBN 978-81-317-2791-1.
- ↑ Lowitz, T. (1796). „Anzeige eines, zur volkommen Entwasserung des Weingeistes nothwendig zu beobachtenden, Handgriffs“ [Report of a task that must be done for the complete dehydration of wine spirits [i.e., alcohol-water azeotrope])]. Chemische Annalen für die Freunde der Naturlehre, Aerznengelartheit, Haushaltungskunde und Manufakturen (германски). 1: 195–204.
See pp. 197–198: Lowitz dehydrated the azeotrope by mixing it with a 2:1 excess of anhydrous alkali and then distilling the mixture over low heat.
Занемарен непознатиот параметар|name-list-style=(help) - ↑ Chisholm, Hugh, уред. (1911). . Encyclopædia Britannica. 1 (11. изд.). Cambridge University Press. стр. 525–527.
- ↑ de Saussure, Théodore (1807). „Mémoire sur la composition de l'alcohol et de l'éther sulfurique“. Journal de Physique, de Chimie, d'Histoire Naturelle et des Arts. 64: 316–354. Занемарен непознатиот параметар
|name-list-style=(help) In his 1807 paper, Saussure determined ethanol's composition only roughly; a more accurate analysis of ethanol appears on page 300 of his 1814 paper: de Saussure, Théodore (1814). „Nouvelles observations sur la composition de l'alcool et de l'éther sulfurique“. Annales de Chimie et de Physique. 89: 273–305. - ↑ Couper AS (1858). „On a new chemical theory“ (online reprint). Philosophical Magazine. 16 (104–116). Посетено на 3 September 2007.
- ↑ Faraday M (1825). „On new compounds of carbon and hydrogen, and on certain other products obtained during the decomposition of oil by heat“. Philosophical Transactions of the Royal Society of London. 115: 440–466. doi:10.1098/rstl.1825.0022. In a footnote on page 448, Faraday notes the action of sulfuric acid on coal gas and coal-gas distillate; specifically, "The [sulfuric] acid combines directly with carbon and hydrogen; and I find when [the resulting compound is] united with bases [it] forms a peculiar class of salts, somewhat resembling the sulphovinates [i.e., ethyl sulfates], but still different from them."
- ↑ Hennell H (1826). „On the mutual action of sulphuric acid and alcohol, with observations on the composition and properties of the resulting compound“. Philosophical Transactions of the Royal Society of London. 116: 240–249. doi:10.1098/rstl.1826.0021. S2CID 98278290. On page 248, Hennell mentions that Faraday gave him some sulfuric acid in which coal gas had dissolved and that he (Hennell) found that it contained "sulphovinic acid" (ethyl hydrogen sulfate).
- ↑ Hennell H (1828). „On the mutual action of sulfuric acid and alcohol, and on the nature of the process by which ether is formed“. Philosophical Transactions of the Royal Society of London. 118: 365–371. doi:10.1098/rstl.1828.0021. S2CID 98483646. On page 368, Hennell produces ethanol from "sulfovinic acid" (ethyl hydrogen sulfate).
- ↑ Sérullas, Georges-Simon (1828). Guyton de Morveau, Louis-Bernard; Gay-Lussac, Joseph Louis; Arago, François; Michel Eugène Chevreul; Marcellin Berthelot; Éleuthère Élie Nicolas Mascart; Albin Haller (уред.). „De l'action de l'acide sulfurique sur l'alcool, et des produits qui en résultent“. Annales de Chimie et de Physique. 39: 152–186. Занемарен непознатиот параметар
|name-list-style=(help) On page 158, Sérullas mentions the production of alcohol from "sulfate acid d'hydrogène carboné" (hydrocarbon acid sulfate). - ↑ In 1855, the French chemist Marcellin Berthelot confirmed Faraday's discovery by preparing ethanol from pure ethylene. Berthelot, Marcellin (1855). Arago, François; Gay-Lussac, Joseph Louis (уред.). „Sur la formation de l'alcool au moyen du bicarbure d'hydrogène (On the formation of alcohol by means of ethylene)“. Annales de Chimie et de Physique. 43: 385–405. Занемарен непознатиот параметар
|name-list-style=(help) (Note: The chemical formulas in Berthelot's paper are wrong because chemists at that time used the wrong atomic masses for the elements; e.g., carbon (6 instead of 12), oxygen (8 instead of 16), etc.) - ↑ Siegel, Robert (15 February 2007). „Ethanol, Once Bypassed, Now Surging Ahead“. NPR. Посетено на 22 September 2007. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ DiPardo, Joseph. „Outlook for Biomass Ethanol Production and Demand“ (PDF). United States Department of Energy. Архивирано од изворникот (PDF) на 24 септември 2015. Посетено на 22 септември 2007. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ Myers, Richard L.; Myers, Rusty L. (2007). The 100 most important chemical compounds: a reference guide. Westport, CN: Greenwood Press. стр. 122. ISBN 978-0-313-33758-1. Занемарен непознатиот параметар
|name-list-style=(help)
Дополнителна литература
уреди- Boyce, John M; Pittet, Didier (2003). „Hand Hygiene in Healthcare Settings“. Atlanta, GA: Centers for Disease Control. Занемарен непознатиот параметар
|name-list-style=(help). - Onuki, Shinnosuke; Koziel, Jacek A.; van Leeuwen, Johannes; Jenks, William S.; Grewell, David; Cai, Lingshuang (June 2008). Ethanol production, purification, and analysis techniques: a review. 2008 ASABE Annual International Meeting. Providence, RI. Посетено на 16 February 2013. Занемарен непознатиот параметар
|name-list-style=(help) - „Explanation of US denatured alcohol designations“. Sci-toys.
- Lange, Norbert Adolph (1967). John Aurie Dean (уред.). Lange's Handbook of Chemistry (10. изд.). McGraw-Hill.
Надворешни врски
уреди| „Етанол“ на Ризницата ? |
- Alcohol (Ethanol) at The Periodic Table of Videos (University of Nottingham)
- International Labour Organization ethanol safety information
- National Pollutant Inventory – Ethanol Fact Sheet
- CDC – NIOSH Pocket Guide to Chemical Hazards – Ethyl Alcohol
- National Institute of Standards and Technology chemical data on ethanol
- Chicago Board of Trade news and market data on ethanol futures
- Calculation of vapor pressure, liquid density, dynamic liquid viscosity, surface tension of ethanol
- Ethanol History A look into the history of ethanol
- ChemSub Online: Ethyl alcohol
- Industrial ethanol production process flow diagram using ethylene and sulphuric acid