Остеогенезис имперфекта
| Остеогенезис имперфекта (OI) | |
|---|---|
 | |
| Сините склери, како во очите на девојчето погоре, се класичен не-патоген знак на Остеогенезис имперфекта . | |
| Специјалност | Педијатрија, гени, ортопедија |
| Симптоми | Коски кои се кршат лесно, сина нијанса на склерата (белките на окото), ниска висина, хипермобилност на зглобовите, губење на слухот[1] |
| Вообичаена појава | Од раѓање |
| Времетраење | Долго |
| Причинители | Гени (автосомно доминантна илиде ново мутација)[2] |
| Дијагностички метод | Зависно од симптомите, ДНК тестирање |
| Спречување | Генетска дијагноза пред имплантација |
| Лекови | Бисфосфонати[3] |
| Прогноза | Зависно од типот |
| Честота | 1 во15,000–20,000 луѓе[4] |
Остеогенезис имперфекта (ОИ, Osteogenesis imperfecta МКБ 10 Q78.0, Преваленца (распространетост): 1/20.000 - 50.000 новородени) е генетско нарушување на сврзните ткива и се одликува со неможност за синтеза или процесирање на колаген тип 1. Исто така, позната е и како болест на кршливи коски и се одликува со зголемена склоност кон настанување на фрактури и намалена коскена густина.[5][6] Симптоми кои ќе се јават на скелетот но и на другите делови од телото - може да бидат благи до тешки.[1] Други манифестации на болеста се појава на сини склери, низок раст, наглувост во возрасно доба, проблеми со дишењето[7] и проблеми со забите (dentinogenesis imperfecta). Компликации кои потенцијално се опасни по живот вклучуваат: кинење ( дисекција ) на главните артерии, како што е аортата[8] пулмонална валвуларна инсуфициенција секундарна на дисторзија на градниот кош ;[9] и базиларна инвагинација.[10]
Во повеќе од 90% од случаите, ОИ се јавува поради мутации во гените COL1A1 или COL1A2.[11] Овие мутации може да бидат наследни на автосомно доминантен начин, но може да се појават и спонтано (de novo).[12] Постојат четири клинички дефинирани типови: тип I, најмалку тежок; тип IV, умерено тежок; тип III, тежок и прогресивно деформирачки; и тип II, перинатално смртоносни.[6] Од септември 2021[update] познато е дека 19 различни гени предизвикуваат 21 документирани генетски дефинирани типови на ОИ, од кои многу се исклучително ретки и се документирани само кај неколку поединци.[13][14] Дијагнозата често се заснова на симптоми и може да се потврди со колагенска биопсија или секвенционирање на ДНК.[7]
Иако не постои лек, повеќето случаи на ОИ немаат големо влијание врз очекуваниот животен век,[5] смртта за време на детството од самата болест е ретка,[7] и многу возрасни лица со ОИ можат да постигнат значителен степен на автономија и покрај попреченоста.[15] Одржувањето здрав начин на живот со вежбање, балансирана исхрана доволна со витамин Д и калциум и избегнување на пушење може да помогне да се спречат фрактури.[16] Генетско советување може да побараат оние со ОИ за да спречат нивните деца да го наследат нарушувањето од нив. Третманот може да вклучува акутна нега на скршени коски, лекови против болки, физикална терапија, помагала за подвижност како што протези за нозе и инвалидски колички,[7] суплементација на витамин Д и, особено во детството интрамедуларна шипка.[17] Интрамедуларни шипка се поставува по долгите коски (како што е бутната коска ) во обид да ја зајакнат. Медицинските истражувања, исто така, ја поддржуваат употребата на лекови од класата на бифосфонати, како што е памидронатот, за зголемување на густината на коските.[18] Бифосфонатите се особено ефикасни кај децата,[19] сепак не е јасно дали тие или го зголемуваат квалитетот на животот или ја намалуваат стапката на инциденца на фрактури.[3]
ОИ се јавува кај 1 во 15.000 до 20.000 луѓе, што ја прави ретка генетска болест.[4] Исходите зависат од генетската причина за нарушувањето (неговиот тип). Типот I (најмал тежок) е најчест, а другите типови опфаќаат мал број случаи.[20][21] Умерена до тешка ОИ првенствено влијае на мобилноста; ако операцијата со шипки се изведе во детството, некои од оние со потешки типови на ОИ може да стекнат способност за одење.[22] Состојбата е опишана уште од античката историја.[23] Латинскиот термин osteogenesis imperfecta бил измислен од холандскиот анатом Вилем Вролик во 1849 година; во буквален превод значи „несовршено формирање на коските“[23][24]
Знаци и симптоми
уредиПостојат четири карактеристични клинички знаци, а тие се: намалена коскена маса, зголемена фрагилност на коските, сини склери, дентиногенезис имперфекта, наглувост. Други одлики се лигаментарната лабавост и зголемена мобилност на зглобовите, како и лесно повредување.
Ортопедски
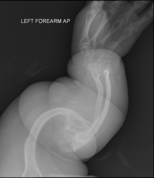
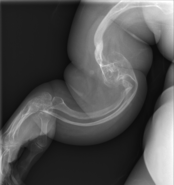
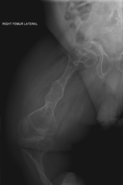
уредиГлавниот симптом на имперфектната остеогенеза се кревките коски со мала минерална густина ; сите видови на ОИ имаат одредена коскена инволвираност.[1] Кај умерена и особено тешка форма на ОИ, долгите коски може да бидат искривени понекогаш и екстремно.[25] Слабоста на коските предизвикува нивна лесно фрактура ; една студија во Пакистан открила во просек 5,8 скршеници годишно кај нелекувани деца.[26]
Долгите коски кај овие пациенти се кратки и тенки, со многу истенчен кортекс. Често се забележуваат повеќе фрактури кои се во различна фаза на заздравување. Пубертетот има стабилизирачки ефект, како последица на хормоналните влијанија,но почнуваат повторно да се зголемуваат кај жените по менопаузата и кај мажите на возраст меѓу 60 и 80 години[5] Многу е важно оваа состојба да се разликува од синдромот на „малтретирано дете“ во првата година.
Исто така, чест клинички знак е и сколиозата, и е тешка во првите две декади на пациентите, како и наглувоста која е последица на отосклерозата и се појавува во 40-тите години.
Зглобната хипермобилност е исто така чест знак на болеста,иако засегнатите гени се исти како оние што предизвикуваат некои видови на Елерс-Данлосов синдром.[1][27][28]
Отолошки
уредиВеќе во 50-годишна возраст, околу 50% од возрасните кои страдаат од ОИ се соочуваат со значително губење на слухот, многу порано во споредба со општата популација.[29] Губењето на слухот кај ОИ може но не мора да биде поврзано со видливи деформитети на коските и внатрешното уво.[30] Губењето на слухот често започнува во текот на втората, третата и четвртата деценија од животот и може да биде спроводливо, сензоневрално или комбинација од двете („мешани“).[31] Ако губењето на слухот не се појави до 50-тата година од животот, значително е помала веројатноста да се појави во годините потоа.[29] Мешаното губење на слухот е најчеста кај оние со ОИ од сите возрасни групи, додека спроводливото губење на слухот најчесто ги погодува постарите луѓе, со сензоневрален губиток на слухот најверојатно да ги погоди децата.[32]
Иако е релативно ретко, губењето на слухот поврзано со ОИ може да започне и во детството; во една студија на четириесет и пет деца на возраст од четири до шеснаесет години, откриена е оваа појава кај две , на возраст од 11 и 15 години.[33] Во една друга студија од 2008 година, бил проверуван слухот на 41 лице со ОИ. Резултатите покажале дека 88% од оние над 20 години имале некаков вид на губење на слухот, за разлика од 38% од оние под 20 години.[34]
Губењето на слухот најчесто се јавува кај типот I ; а поретко кај типовите III и IV.[5] Други делови на внатрешното уво исто така може да бидат погодени од ОИ и да предизвикаат проблеми со рамнотежата ; сепак, само мали студии пронајдоа врски помеѓу вртоглавица и ОИ.ОИ може да го влоши исходот на медицинските третмани кои го коригираат губењето на слухот.
Покрај поврзаноста на ОИ со сензоневрален губиток на слухот, ОИ е поврзан со голем број невролошки абнормалности, кои обично го вклучуваат централниот нервен систем, поради деформитети во скелетните структури. Невролошките компликации, особено базиларната инвагинација, може негативно да влијаат на животниот век. Во ОИ, ова најчесто се должи на нагорна миграција на аксисот,[10][35] одлика на C2 пршлен. Неврохирургија може да биде потребна за да се поправат тешките абнормалности кога тие го ризикуваат животот на пациентот или предизвикуваат големо страдање или неподносливи невролошки дефицити.
Системски
уредиКако што неговите биолошки причини се попрецизно утврдени, општо е прифаетно дека примарниот процес на болеста на ОИ се случува во коските,предизвикани од мутации на генот на колаген тип I - чие влијание е практично на сите органите на човечкото тело на некој начин.[12]
Колагенот тип I може да се најде низ циркулаторниот и респираторниот систем : од коморите на срцето, до срцевите залистоци, до васкулатурата и тој е составен дел на сврзното ткиво на белите дробови. Како такви, кардиоваскуларните компликации како што се аортна инсуфициенција, аортна аневризма и артериски дисекции, понекогаш се коморбидни со ОИ, иако можат да се појават не се толку чести колку што се коморбидни на пример кај Марфанововиот синдром.
Смрта кај ОИ главно настанува како последица на респираторните заболувања. Најчест респираторен проблеми со кој се соочуваат е пулмоналната инсуфициенција која е предизвикана од проблеми во градбата на торакалниот ѕид. Сепак, инфекциите на респираторниот тракт, како што е пневмонијата, е пофатални кај оние со ОИ отколку кај другите луѓе.[36] Кај оние со потешки деформитети на градниот кош, било откриено дека имаат полошо ограничување на белите дробови во истражување од 2012 година, во кое биле вклучени 22 италијански пациенти со ОИ типови III и IV, плус 26 незасегнати контроли.
ОИ а најмногу потешките форми како тип III - исто така имаат ефект врз гастроинтестиналниот систем. Откриено е дека е поврзано со рекурентна абдоминална болка и хроничен запек во две студии кој биле направени на пациенти заразени со ОИ.[37][38] Хроничниот запек е особено чест,а појава отежнувајќи ја асиметрична карлица ( ацетабуларна испакнување ).[38] Особено во детството, запекот поврзан со ОИ може да предизвика чувство на ситост и поврзано одбивање на храна, што може да доведе неухранетост.
Класификација
уредиДенес ОИ може да биде класифицирана според два системи. Првиот, создаден од Дејвид Силенс во 1979 година,според кој пациентите може да припаѓаат во еден од четирите типа или синдроми, според нивната клиничка презентација, без да ја земе предвид генетската причина за нивната болест. Вториот систем е според моделот Silence, но доделува нови нумерирани типови генетски како што доаѓа до нивно отркивање.[39][40] Затоа, луѓето со ОИ може да се опишат како со клинички и генетски тип, кој понекогаш но не секогаш се поклопуваат[40]
Типот I е најчест, а во 90% од случаите е резултат на мутации на COL1A1 или COL1A2. Самата болест различно се манифестира кај различни луѓе , па така симптомите варираат од тип на тип, како и од личност до личност, дури и во исто семејство.[41]
До 2021 година, дефинирани се 21 тип на ОИ кои се прикажани во табелата:[13][14]
| Silence моделот со 4 типа | ||||||
|---|---|---|---|---|---|---|
| Тип | Опис | ген | Менделовско наследување кај човекот | Начин на наследување | Инциденца | Дефинирано [note 1] |
| I | благ | Нулта COL1A1 алел | 166200 | автосомно доминантно, 34% де ново [2] | 1 на 30.000 [42] | 1979 година [40] |
| II | смртоносно во перинаталниот период [1] :1511 | COL1A1, COL1A2 | 166210 | автосомно доминантно, ≈100% де ново [2] | 1 на 40.000 [20] до 1 на 100.000 [42] | |
| III | тешка, прогресивна и деформирачка | COL1A1, COL1A2 | 259420 | автосомно доминантно, 85% де ново[2] | 1 на 60.000 [42] | |
| IV | променливи и деформирачки, но обично со нормални склери [5] :294–296[43] | COL1A1, COL1A2 | 166220 | автосомно доминантно, 50% де ново [2] | 1 на 30.000 [5] :21 | |
| Генетски дефинирани типови | ||||
|---|---|---|---|---|
| Тип | ген | Менделовско наследување кај човекот | Начин на наследување | Дефинирано [note 1] |
| V | <i id="mwAfQ">IFITM5</i> | 610967 | автосомно доминантна [44][45] | 2000 година [46] [note 2] |
| VI | SERPINF1 | 613982 | автосомно рецесивно [44] | 2002 година |
| VII | CRTAP | 610682 | автосомно рецесивно [44] | 2006 година |
| VIII | LEPRE1 | 610915 | автосомно рецесивен | 2007 година |
| IX | PPIB | 259440 | автосомно рецесивен | 2009 година |
| X | SERPINH1 | 613848 | автосомно рецесивен | 2010 година |
| XI | FKBP10 | 610968 | автосомно рецесивен | 2010 година |
| XII | SP7 | 613849 | автосомно рецесивен | 2010 година |
| XIII | BMP1 | 614856 | автосомно рецесивен | 2012 година |
| XIV | TMEM38B | 615066 | автосомно рецесивен | 2012 година |
| XV | WNT1 | 615220 | автосомно рецесивен | 2013 година |
| XVI | CREB3L1 | 616229 | автосомно рецесивен | 2013 година |
| XVII | SPARC | 616507 | автосомно рецесивен | 2015 година |
| XVIII | TENT5A | 617952 | автосомно рецесивен | 2018 година |
| XIX | MBTPS2 | 301014 | Х-поврзан рецесивен | 2016 година |
| XX | MESD | 618644 | автосомно рецесивен | 2019 година |
| XXI | KDELR2 | 619131 | автосомно рецесивен | 2020 година |
Типови според Дејвид Силенс
уреди
Четирите типови кој се поставени од страна на Silence се значајни како од клинички така и од генетски аспект; описите кои се среќаваат подолу се клинички и може да се применат на неколку генетски типови на болеста. Моделот покажува дека клиничките симптоми се навистина предизвикани од мутации во гените COL1A1 или COL1A2 кои се наследени на автосомно доминантен начин.[13]
Тип I
уредиКолагенот иако го има својот нормален квалитет, тој не успева да се произведе во недоволни количини како што е случајот со остатокот од популацијата Коските се кршат полесно отколку во нормални услови, но не толку лесно како потешките типови на ОИ; може се појави сколиоза, иако блага во споредба со типовите III и IV ; зглобовите може да покажат олабавување; може да се појават сини склери на очите; веројатно е да се појави и губење на слухот[43] и може да има мало намалување на висината. Бидејќи постојат случаи кога недостасуваат еден или повеќе од овие симптоми, ОИ тип I во некои случаи останува неоткриен во зрелоста.
Според некои типот I дополнително може да се подели на типови I-A и I-B, дефинирани со отсуството (I-A) или присуството (I-B) на dentinogenesis imperfecta (опалесцентни заби).[43][51] Луѓето со тип I генерално имаат нормален животен век.[52]
Тип II
уредиКолагенот е фатално неисправен на неговиот C-terminus.Повеќето случаи резултираат со смрт веднаш по раѓањето, или во првата година од животот, поради респираторна инсуфициенција . Друга честа причина за смрт се интракранијалните крварења од фрактури на черепот присутни на, или одржани за време или кратко време по раѓањето. Во многу случаи, новороденчето веќе има повеќе скршени коски уште од самото раѓање. Доенчињата од тип II, исто така, покажуваат сериозни респираторни проблеми и имаат сериозно деформирани коски. Шеесет проценти од доенчињата умираат за помалку од 24 часа по раѓањето, а преживувањето по првата година е крајно неверојатно и нормално бара механичка вентилација.[53] Во ретките случаи на доенчиња кои ја преживуваат првата година од животот, се забележуваат сериозни развојни и моторен застој.[54]
Типот II уште нарекуван и „смртоносна перинатална “ форма на ОИ,[55] поради што пациентите не можат да преживеат до зрелоста.[53] Поради слично тешко деформирани коски, понекогаш бебињата со тежок тип III можат погрешно првично да се класифицираат како тип II; штом ќе се покаже долгорочно преживување, наместо тоа се смета дека имаат тип III.[56]
Тип III
уредиТипот III иако располага со количината на колаген која е доволна, неговиот квалитет не е задоволувачки[1] Клиничката разлика помеѓу типовите III и IV не е секогаш очигледна за , и дополнително може да дојде до нивно мешање бидејќи нетретирана возрасна личност со тип IV може да има полоши симптоми од третираната возрасна личност со тип III;[57] одлики кои се среќаваат само во тип III се неговата прогресивно деформирачка природа и присуство на лице со „триаголен“ изглед.[58] Друг диференцирачки фактор помеѓу типот III и IV се сините склери; кај типот III, доенчињата најчесто имаат сини склери кои постепено стануваат бели додека растат, но сините склери најчесто не можат да бидат забележани кај тип IV, иако се забележани во 10% од случаите.[59]
Овој тип се одликува со остеопенични коски кај кои лесно доаѓа до кршење, понекогаш дури и додека се во матката, што често може да резултира со стотици фрактури во текот на животот;[21] рана сколиоза која напредува до пубертетот; џуџест раст (конечна возрасна висина често помала од 120 cm ); лабави зглобови; и можни респираторни проблеми поради малиот волумен на ребрата што предизвикува низок волумен на белите дробови.
Главно поради сериозноста на проблемите кој се појавуват со коските, невролошките нарушувања и нападите се со поголема веројатност да се појават кај тип III.Базиларната инвагинација, која врши притисок врз мозочното стебло, може да предизвика или да придонесе за рана смрт; хируршкиот третман на истиот е покомплексен во случаите на ОИ.
Тип IV
уредиТука количината на колаген е доволна, но проблематичен е неговиот квалитет. Типот IV најчесто се дијагностицира кога симптомите не се ниту како во типовите III, ниту како во I.[43] Според моделот кој го предложил Silence типот IV треба да има нормални склери,[5] :294–296[60] :114модерната класификација им овозможува дури и на оние со сини склери да одговараат на критериумите за тип IV доколку ги исполнуваат сите другите клинички барања од типот.[59]
Во тип IV, коскениот деформитет може да биде благ до тежок, коските лесно се скршуваат (особено пред пубертетот), џуџестиот раст е честа појава, вертебралниот колапс и сколиозата се очигледни, а можно е и губење на слухот,[7] иако невообичаено.[42][43] Типот IV е главно се разликува од типот III и типот I што е клиничка класификација за пациентите некаде во средината помеѓу двата.[1] :1511Како таков, типот IV често се нарекува „променлив“,[60] дури и оние во исто семејство ( со иста генетска мутација) се разликуваат.[43]
Клиничка проценка може да се направи и преку стапките на фрактури на коските пред пубертетот кај типот IV оние со него имаат тенденција да имаат стапки на фрактури од ≈1 годишно, во споредба со ≈3 годишно за тешка ОИ (тип III).[43]
Исто како и типот I така и типот IV може да се подели на типови IV-A и IV-B, дефинирани повторно со отсуството (IV-A) или присуството (IV-B) на dentinogenesis imperfecta.[43][51]
Генетски дефинирани типови (типови V – XXI )
уредиВо 2020 година, генетски се дефинирани петнаесет типови на ОИ кои се прикажани подолу:[13]
- Тип V – имајќи ги истите клинички одлики како типот IV со опсервација на коскената биопсија под микроскоп. Типот V понатаму може да се разликува од другите типови на ОИ со "V тријада": непроѕирна лента (видлива на Х-зраци) во непосредна близина на плочите за раст; хипертрофични калуси (ненормално големи маси на ткиво за заздравување на коскеното ткиво) кои се формираат на местата на фрактура за време на процесот на заздравување;и калцификација на меѓукоскената мембрана на подлактицата,[46] што може да го отежне вртењето на зглобот.[5] Други одлики на оваа состојба може да вклучуваат повлечен лакт и, како и кај другите типови на ОИ, свиткување на долгите коски и губење на слухот.[61] Причините за овој тип е мутацијата на IFITM5 ген на хромозомот 11p15.5.[45][61] Разликата на типот V од типот IV е клиничкиот тип кој првично било предложен уште пред да биде позната нејзината генетска причина, од Glorieux et al. во 2000.[46][62] Типот V е релативно чест во споредба со другите генетски дефинирани типови на ОИ - кај 4% од пациентите со ОИ на одделот за генетика на Бразилската Hospital de Clínicas de Porto Alegre била откриена.[63]
- Тип VI – со исти клинички одлики како типот III,се одликува со коски кои имаат изглед сличен на оној што се гледа во остеомалација. Типот VI е предизвикан од мутација со губење на функцијата на SERPINF1 генот на хромозомот 17p13.3
- Тип VII – предизвикан од мутација на CRTAP генот на хромозомот 3p22.3; клинички близок до типовите II и III, во зависност од засегнатото лице. Типот VII бил првиот потврден рецесивен тип на ОИ, првично пронајден меѓу луѓето во Квембек.[64][65].
- Tип VIII – предизвикан од мутација на генот LEPRE1 на хромозомот 1p34.2; клинички сличен на ОИ типови II и III, во зависност од засегнатото лице.[66]
- Тип IX – предизвикан од хомозиготна или сложена хетерозиготна мутација во генот PPIB на хромозомот 15q22.31.[67]
- Тип X – предизвикан од хомозиготна мутација во генот SERPINH1 на хромозомот 11q13.[68]
- Тип XI – предизвикан од мутации на FKBP10 на хромозомот 17q21. Мутациите предизвикуваат намалување на секрецијата на тримерните проколагенски молекули. Други мутации во овој ген може да предизвикаат автосомно рецесивен Брук синдром, кој е сличен на остеогенезис имперфекта.[69]
- Тип XII – предизвикан од мутавија на поместување на рамката на читање(фрејмшифт мутација) во SP7 на хромозомот 12q13.13. Оваа мутација предизвикува коскени деформитети, фрактури и покасно никнување на забите.[70]
- Тип XIII – предизвикана од мутација на коскеноморфогенска белковина 1(BMP1) ген на хромозомот 8p21.3.[71] Оваа мутација предизвикува повторливи фрактури, висока коскена маса и хипермобилни зглобови.[72]
- Тип XIV – предизвикан од мутации во генот TMEM38B на хромозомот 9q31.2. Оваа мутација предизвикува повторливи фрактури и остеопенија.[73]
- Тип XV – предизвикан од хомозиготни или сложени хетерозиготни мутации во генот WNT1 на хромозомот 12q13.12,автосомно рецесивен.[72]
- Тип XVI – предизвикан од мутации во генот CREB3L1 на хромозомот 11p11.2. Хомозиготната мутација предизвикува пренатален почеток на повторливи фрактури на ребрата и долгите коски, деминерализација, намалена осификација на черепот и сини склери; клинички е тип II или тип III.[74] Членовите на семејството кои се хетерозиготни тип XVI може да имаат повторливи фрактури, остеопенија и сини склери.[74][75]
- Тип XVII – предизвикан од хомозиготна мутација во генот SPARC на хромозомот 5q33, предизвикувајќи абнормалност во белковината остеонектин, што доведува до тешка болест која се одликува со генерализирана платиспондија, зависност од инвалидска количка и повторливи фрактури.[76]
- Тип XVIII – предизвикан од хомозиготна мутација во генот FAM46A на хромозомот 6q14.1. Се одликува со вродено искривување на долгите коски, сини склери, вертебрален колапс и повеќекратни фрактури во првите години од животот.[77]
- Тип XIX – предизвикан од хемизиготна мутација во генот MBTPS2 на хромозомот Xp22.12. Досега тип XIX е единствениот познат тип на ОИ со X-поврзан рецесивен модел на наследување, што го прави единствениот тип што е почест кај мажите отколку кај жените. Типот XIX ја нарушува регулираната интрамембранска протеолиза, која е критична за здраво формирање на коските.[78]
- Тип XX – предизвикан од хомозиготна мутација во генот MESD на хромозомот 15q25.1. Првичните студии од типот XX покажувале дека може да предизвика општ растој во развојот прво меѓу типовите ОИ..[79]
- Тип XXI – предизвикан од хомозиготна мутација во генот KDELR2 на хромозомот 7p22.1. Предизвикува болест клинички слична на типовите II и III, за која се смета дека е поврзана со неспособноста на белковината шаперон HP47 да се одврзе од колагенот тип I, бидејќи за да го стори тоа треба да се врзе за исчезнатата белковина на рецепторот 2 кој ја задржува белковината на ER лумен кодиран од KDELR2.[14]
Со оглед на брзата стапка на откривање на типот, исклучително е веројатно дека постојат и други гени поврзани со ОИ кои допрва треба да бидат откриени или пријавени.[80] : 491–492
Генетика
уредиОстеогенезис имперфекта е група на генетски нарушувања,ретка генетска болест која предизвикуваат кршливост на коските. OI има висока генетска хетерогеност, односно многу различни генетски мутации кои доведуваат до исти или слични групи на забележливи симптоми (фенотипови).[81]
Во повеќето случаи, последица е на мутации на гените COL1A1 и COL1A2.[82] Приближно 90% од луѓето со ОИ се хетерозиготни за мутации или во гените COL1A1 или COL1A2.[83] Постојат неколку биолошки фактори кои се резултат на доминантната форма на ОИ. Овие фактори вклучуваат: внатреклеточен стрес; абнормална минерализација на ткивата; абнормални интеракции помеѓу клетките; абнормални интеракции клетка- матрикс ; компромитирана структура на клеточна матрица; и, абнормална интеракција помеѓу не-колагенските белковини и колагенот.[84].Постојат 11 типови на болеста базирано на клинички и генетски одлики. Традиционално, ОИ се дели според времето на појавување: ОИ конгенита (OI congenita), која се одликува со бројни скршеници при раѓањето на детето и ОИ тарда (OI tarda), при која фрактурите се појавуваат подоцна. Конгениталната форма се одликува со висока стапка на смртност поради интракранијални хеморагии или рекурентни респираторни инфекции. Доцниот тип се случува во првата декада од животот и скршениците не се така бројни и сериозни како кај конгениталните.
Неколку претходните истражувања дошле до верување дека ОИ е автосомно доминантно нарушување со неколку други варијации во геномите.[4] Меѓутоа, со намалувањето на трошоците за секвенционирање на ДНК во пресрет на проектот за човечки геном од 2003 година, идентификувани се автосомно рецесивни форми на нарушување.[85] Рецесивните форми на ОИ во голема мера се поврзани со дефекти во колагенските чаперони одговорни за производство на проколаген и склопување на поврзаните белковини.[86] Примери на колагенски шаперони кои се неисправни кај пациенти со рецесивни форми на ОИ вклучуваат шаперон HSP47 (Кол-Карпентер синдром) и FKBP65.[39] Мутациите во овие шаперони резултираат со неправилна шема на превиткување во колаген 1 белковините што предизвикува рецесивна форма на нарушување.[39] Постојат три значајни типови на ОИ кои се резултат на мутации во колаген пролил 3-хидроксилациониот комплекс (компоненти CRTAP, P3H1 и CyPB)[39] Овие компоненти се одговорни за модификација на колаген α1(l)Pro986.[39] Мутациите во други гени како што се SP7, SERPINF1, TMEM38B и BMP1, исто така, може да доведат до неправилно формирани белковини и ензими кои резултираат со други рецесивни типови на болеста.[39]
Дефектите во белковинскиот пигментен фактор добиен од епител (PEDF) и трансмембранската белковина поттикната од коскено ограничен интерферон (BRIL) се причините за несовршената остеогенеза од типот V и VI.[87] Неправилностите во овие белковини доведуваат до неисправна минерализација на коските што ги предизвикува карактеристичните кршливи коски.[87] Една точкеста мутација во 5' непреведениот регион (5' UTR) на генот IFITM5, кој го кодира BRIL, е директно поврзан со типот V.[61][88]
Во реткиот случај од типот XIX, првпат откриен во 2016 година, ОИ се наследува со Х-поврзано генетско нарушување, со неговите штетни ефекти кои на крајот произлегуваат од мутација на генот MBTPS2.[78] Генетските истражувања се во тек, а неизвесно е кога ќе бидат идентификувани сите генетски причини за ОИ, бидејќи бројот на гени кои треба да се тестираат за да се исклучи нарушувањето продолжува да се зголемува.[80] (стр.491–492)
37 семејства биле вклучени во студија во која било откриено дека шансата дека ОИ се повторува кај повеќе браќа и сестри родени од двајца незасегнати родители е 1,3% - ова е многу повисока стапка отколку што би се очекувало доколку сите такви повторувања се де ново.[89] Причината е генетскиот мозаицизам ; некои од или повеќето од герминативните клетки на еден родител имаат доминантна форма на ОИ, но не доволно од нивните соматски клетки за да предизвикаат симптоми или очигледна попреченост кај родителот - различните клетки на родителот имаат две (или повеќе ) множества на малку поинаква ДНК.[1][89] Клинички е забележано дека ≈5-10% од случаите на ОИ типови II и III се припишуваат на генетски мозаицизам.[5]
Патофизиологија
уредиЛуѓето со ОИ се или родени со неисправно сврзно ткиво или се родени без способност да создаваат колаген во доволни количини или, во најретките генетски типови, родени со недостатоци на други сегменти важни за формирањето на коските, како што се белковините на шаперон, сигналниот пат Wnt, BRIL белковина, итн.[13] Кај тип I самата структура на колагенот е нормална, само неговата количина е мала. Типовите II, III и IV обично, но не секогаш, се поврзани со недостаток на колаген тип I.[90] Еден можен недостаток произлегува од замена на аминокиселина на глицин со поголема аминокиселина, како што е аланин, во структурата на тројната спирала на колагенската белковина. Поголемите странични синџири на аминокиселини доведуваат до стерични ефекти што создаваат испакнатост во колагенскиот комплекс, што пак влијае и на молекуларната наномеханика и на интеракцијата помеѓу молекулите, кои и двете се компромитирани.[91][92] Во зависност од локацијата на супституцијата и од аминокиселината што се користи наместо тоа, се гледаат различни ефекти кои се одговорни за разновидноста на типот во ОИ и покрај тоа што истите два колагенски гени се одговорни за повеќето случаи.[92][93] Замените на глицин со серин или цистеин се поретко забележани кај фаталениот тип II , додека замените со валин, аспарагинска киселина, глутаминска киселина или аргинин се почести.[92]
Кршливоста може да биде предизвикана од односот помеѓу колагенските фибрили и кристалите на хидроксиапатит кој е променет а е задолжен за формирање на коската.[93] Фрактурите на коските се случуваат затоа што стресната состојба во колагенските фибрили е изменета на локациите на мутациите, каде локално поголемите сили на смолкнување доведуваат до брзо откажување на фибрилите дури и при умерени оптоварувања бидејќи се губи хомогената стресна состојба што вообичаено се наоѓа кај здравите колагенски фибрили.[91] Оттука, ОИ е феномен со повеќе размери, каде што дефектите на најмалите нивоа на ткивата (генетско, нано, микро) домино влијаат на макро-нивото на ткивата.[91]
Дијагноза
уредиДијагнозата обично се заснова на медицински слики, вклучувајќи обични рендгенски снимки и симптоми. Во тешките форми знаците вклучуваат абнормалности во сите екстремитети и во ’рбетот.[94] Бидејќи рендгенските снимки често се не можат да укажат на помало губење на коскената густина како кај типот I , може да бидат потребни и DEXA снимки.
Дијагнозата може да се потврди преку анализа на ДНК или колагенска белковина, но во многу случаи, појавата на фрактури на коските и присуството на други клинички одлики како сини склери се доволни за дијагноза. Може да се изврши биопсија на кожата за да се одреди структурата и количината на колагенот од типот I. Иако ДНК-тестирањето може да ја потврди дијагнозата, не може апсолутно да ја исклучи можноста болеста да не постои бидејќи сè уште не се познати и/или тестирани сите мутации што предизвикуваатоОстеогенезис имперфекта.[80] Типот II често се дијагностицира со ултразвук за време на бременоста, каде што веќе може да се видат повеќекратни фрактури и други карактеристични одлики. Во однос на контролата, кортикалната коска покажува зголемена порозност, дијаметар на каналот и поврзаност во микро-компјутерската томографија.[95] ОИ, исто така, може да се открие пред раѓањето со користење на ин витро техника на генетско тестирање, како што е амниоцентрзата.[96]
Генетско тестирање
уредиСо цел да се утврди дали е присутна остеогенезис имперфекта, може да се направи генетско секвенционирање на најчестите проблематични гени, COL1A1, COL1A2 и IFITM5 ;[97] ако не е пронајдена мутација сè уште постои сомневање, може да се тестираат другите 10+ гени за кои се знае дека предизвикуваат остеогенезис имперфекта.
Диференцијална дијагноза
уредиВажна диференцијална дијагноза на ОИ е насилството над децата, бидејќи и кај двете може да се појават повеќекратни фрактури во различни фази на заздравување.Нивното диференцирање може да биде тешко, особено кога нема други карактеристични одлики на ОИ. Ова може да стане проблем во судството; во Соединетите Американски Држави, неколку случаи на насилства над децата биле разрешени со наодот дека остеогенезис имперфекта е вистинската причина за фрактури на детето, што доведе до тужби за барање обесштетување, како што се Алис Веласкес и Соединетите Американски Држави. [98]
Други диференцијални дијагнози кој можат да се појават вклучуваат рахитис и остеомалација, и двете предизвикани од неухранетост, како и ретки скелетни синдроми како Брук синдром, хипофосфатазија, геродерма остеодиспластикум и Елерс-Данлосов синдром. Различни форми на остеопороза, како што се јатрогена остеопороза, идиопатска јувенилна остеопороза, неупотреблива остеопороза и остеопороза поврзана со вежбање, исто така, треба да се земат предвид како објаснувања кога постои сомневање за ОИ.
Третман
уредиТретманот варира во зависност од возраста, зафатеноста и функционалниот статус на пациентот. При блага болест, се препорачува суптилна рестрикција на изложување на ризик-фактори, на пример избегнување на контактни спортови. При среден до тежок тип на болеста потребна е рехабилитација и ортопедски интервенции, како и згрижување на акутните фрактури и сколиозата, додека кај тешките форми има потреба од повеќекратни оперативни зафати за корекција на извиткувањето на долгите коски. Неопходна е и медикаментозна терапија, полови хормони, лекови и минерали вклучени во коскениот метаболизам.. Но специфичен лек не постои.[7] Одржувањето здрав начин на живот со вежбање и избегнување пушење исто така може да биде од корист,[99] како и физикалната терапија и помагала за подвижност како инвалидски.[99]
Дали третманот е успешен или не може тешко да се утврди кај пациентите со ОИ, бидејќи намалените стапки на фрактури на коските може да бидат само случајни. Иако овие стапки често се користат во медицинските студии за да се процени ефикасноста на третманот, норвешката студија на петнаесет лица со ОИ нагласи дека тие сметаат дека лекарите треба да го земат предвид целиот пациент, а не само стапките на фрактури.[100]
Нега на акутна фрактура на коските
уредиФрактурите на коските кај лицата со остеогенезис имперфекта се третираат на ист начин како што се третираат кај општата популација - коската заздравува со иста брзина како и коските кај индивидуи незасегнати од болеста.Поголем акцент е ставен на употребата на лесни материјали за да се имобилизира фрактурата, како кај умерените или тешките типови на ОИ, употребата на тешки гипсови, како што се гипсот на колкот, може да предизвика фрактури на коските како и генерализирана остеопенија. Лесниот гипс потоа се заменуваат со отстранлива ортоза по неколку недели и откако ќе се видат докази за заздравување на рендген. Со цел да се спречи незаздравување или лошо заздравување, сите фрактури треба да се имобилизираат, дури и ако фрактурата изгледа тривијална ( микрофрактура ), бидејќи луѓето со ОИ се изложени на поголем ризик од незаздравување.
Коскените инфекции кои се секундарни по фрактури се третираат со соодветни антибиотици и антисептици, како и кај општата популација.
Лекови
уредиБифосфонати
уредиВо 1998 година, првичното набљудувачко испитување покажало ефективност на интравенозниот памидронат, бифосфонат кој претходно се користел кај возрасни за лекување на остеопороза. Кај тешка форма на ОИ, ова испитување покажало дека памидронатот ја намалува болката во коските, спречува нови скршеници на пршлените, ги преобликува претходно скршените делови на пршлените и го намалува бројот на фрактури на долгите коски.[101]
Иако оралните бифосфонати се попогодни и поевтини, тие исто така не се апсорбираат, а интравенозните бифосфонати се генерално поефикасни, иако ова се проучува. Некои студии пронашле орални и интравенски бифосфонати, како што се орален алендронат и интравенски памидронат, еквивалентни.[102] Во двојно слепо испитување од 2013 година на деца со благ ОИ, оралниот рисдронат ја зголемил густината на коскените минерали и ги намалил невертебралните фрактури. Сепак не дошло до намалување на новите вертебрални фрактури.[103][104] Прегледот во 2016 година заклучи дека иако изгледа дека бифосфонатите ја подобруваат коскената минерална густина, не е сигурно дали тоа води до намалување на фрактурите на коските или до подобрување на квалитетот на животот на лицата со остеогенезис имперфекта.[3] Дури и во испитувањата со дури 125 деца, не е пронајдена причинско-последична врска помеѓу бифосфонати и намалени стапки на фрактури; Плацебо контролираните испитувања, исто така, не можат да докажат дека помагаат во зголемување на силата, моторните движења или намалување на болката.[84]
Бифосфонатите се покажале како не толку ефикасни во зголемувањето на минералната густина на коските кај возрасните.[19]
Додатоци во исхраната
уредиОстеогенезис имперфекта е генетско нарушување и не е предизвикано од недоволно внесување на некој витамин или минерал; суплементацијата не може да ја излечи болеста. Со тоа, луѓето со ОИ имаат тенденција да имаат сериозен недостаток на витамин Д со многу повисока стапка од општата популација, а причината за ова не е разјаснета.[105][106][107] Се смета дека сериозноста на недостатокот и веројатноста за негово појавување се поврзани со сериозноста на ОИ.[106] Може да се препорача суплементација на витамин Д, барем додека нивото на 25(OH)D во крвта не се врати во нормала.[105] Под нормалните нивоа на витамин Д се исто така загрижувачки бидејќи може да ја намалат ефикасноста на бифосфанатите.[105]
Операции
уредиОперацијата од кој било тип инхерентно носи повеќе ризици кога се прави на пациент кој има (особено умерена до тешка) ОИ. Скелетните деформитети и имперфектна дентиногенеза може да го попречат пристапот до дишните патишта. Употребата и исклучувањето на механичката вентилација е исто така потешко да се спроведе кај пациенти со ОИ. За време на самата процедура или процесот на заздравување, абнормалниот колаген може да доведе до крварење на дијатези.
Безбедноста кога се користи анестезија е исто така загрижувачка кај пациентите со ОИ, анестетички компликации се 5,6 пати поверојатни кога пациентот има ОИ тип III.[17][108][109][110]
Родинг
уреди
Металните шипки може хируршки се вметнат во долгите коски за да се подобри силата, процедура развиена од Харолд А. Софиелд кога бил главен на персоналот во детска болница во Чикаго(Shriners Hospitals), болница која нуди ортопедска нега и операции на децата без оглед на можноста нивното семејство да плати.[112] Голем број деца со ОИ доаѓале во болницата Шринерс, а Софиелд експериментирал со различни методи за зајакнување на нивните коски.[113] Во 1959 година, со Едвард А. Милард , Софилд напишал важна статија во која опишувал операција од три дела која изгледала радикална во тоа време: прецизно кршење на коските („фрагментација“), ставање на добиените коскени фрагменти во права линија („преусогласување“), потоа поставување метал прачки во интрамедуларните канали на долгите коски за да се стабилизираат и зајакнат („фиксација на прачка“).[114] Неговиот третман се покажал корисен за зголемување на подвижноста на луѓето со ОИ, и тој е усвоен низ целиот свет - стана стандарден хируршки третман за тешките форми на болеста до 1979 година, во која година Дејвид Сајленс откри дека ≈ 2⁄3 од пациентите што ги испитувал со ОИ тип III биле подложени на најмалку една операција на прачка/шипка.
Родинг операцијата (од англ.Rodding surgery) често се прави со надеж дека ќе понуди можност пациентите да пешачат кај оние каде има умерена или тешка форма. Извештајот од 2020 година во The Journal of Bone and Joint Surgery ( JB&JS ) покажал дека методот останувал популарен: ≈ 2⁄3 од луѓето со ОИ типови III и IV (тешка ОИ) биле подложени на некоја форма на операција на шипки во нивниот живот, на просечна возраст од 4 1⁄10 и 7 1⁄2 години ;[22] Едно можно објаснување за тенденцијата за претходна интервенција кај тип III е дека една половина од засегнатите деца воопшто не можеле да одат без операција, бидејќи нивните екстремитети биле искривени, па затоа се барало решени во операција порано.[22]
Кај оние со тип III кои биле подложени на операција на шипка, 79,5% имале шипки на бутната коска и тибијата на двете нозе.[22] :Table IНајчестата форма на шипки што се користеле се интрамедуларни (IM) прачки, од кои некои, како што е шипката Fassier-Duval IM, се телескопски, што значи дека тие се дизајнирани да растат додека детето расте, во обид да се избегне потребата од операции за ревизија.[115] Телескопските IM прачки се широко распространети,[116] и вообичаената IM прачка Fassier-Duval е дизајнирана да се користи за шипки на бутната коска, тибијата и хумерусот.[117] Операцијата вклучува кршење на долгите коски помеѓу една и три (или повеќе) [116] места, а потоа фиксирање на шипката покрај коската за да остане исправена.[117]
Додека телескопските IM прачки се наменети да растат заедно со бутната коска и тибијата кај децата во развој; хирурзите претпочитаат да користат нетелескопски IM шипки, како што се Раш стапчиња, во тибијата, која расте помалку.[22]
Додека извештајот во JB&JS можел да ги поврзе хируршките интервенции со шипки за да има поголема мобилност кај сите типови на ОИ, кај пациенти со тип IV, операцијата не ја намалила инциденцата на скршени коски во споредба со пациентите без шипка - додека пациентите тип IV со шипка на тибијата искусиле 0,93 фрактури годишно, пациентите без операција доживеале само 0,81. Сепак, кај пациенти со тип III операција со шипка го намали просечниот број на фрактури на тибија годишно од 0,84 на 0,57.[22]
’Рбетно спојување
уреди’Рбетното спојување може да се изврши или како превентивна мерка или за корекција на постоечката сколиоза, иако вродената кршливост на ОИ коските кај оваа болест ја прави операцијата посложена отколку кај пациенти кои имаат адолесцентна идиопатска сколиоза, но нормална коскена густина.[118] Сепак, и покрај ризиците, тројца ортопедски хирурзи од Nemours–duPont кои се специјализирани за хируршка интервенција за остеогенезис имперфекта препорачуваат операција ако искривувањето е поголема од 50 ° откако детето ќе ја надмине максималната висината, бидејќи кривата на ’рбетот може да продолжи да се влошува дури и во зрелоста.[10]
Поради ризикот кој постои , истите хирурзи препорачуваат операција за базиларни отпечатоци и базиларни инвагинации да се изведуваат само ако притисокот што се врши врз ’рбетниот мозок и мозочното стебло предизвикува вистински невролошки симптоми.[10] Штом базиларната инвагинација ќе стане симптоматска, само операцијата може да ја запре или да ја смени прогресијата на невролошките дефицити.
Физикална терапија
уредиФизикална терапија генерално се препорачува, но потребни се индивидуални протоколи поради варијабилноста на ОИ. Физичката терапија се користи за зајакнување на мускулите, подобрување на подвижноста, подобрување на флексибилноста и помош при одржување на тежината, иако тоа мора да се направи на нежен начин за да се минимизира ризикот од фрактура на коските.Кај луѓето со ОИ, вежбањето често вклучува аеробик на вода, вежби со лесен отпор и одење, доколку пациентот е во можност. Сепак, дури и кај пациенти со благ ОИ, контактните спортови, како и активностите кои веројатно ќе предизвикаат непотребен стрес на зглобовите, како што е скокањето, се контраиндицирани поради ризиците што ги претставуваат.
Поединците со поограничена подвижност се охрабруваат редовно да ги менуваат позициите во текот на денот; На луѓето кои седат во инвалидска количка најмногу или цел ден им се препорачува да излегуваат од неа на секои два часа, како форма на вежбање, за да се намали вкочанетоста и да се спречат декубитус.
Лицата со умерена до тешка ОИ, на кои им се потребни помагала за мобилност и приспособени возила, се соочуваат со значителни проблеми кога сакаат да пристапат до базени или спортски сали. Дебелината може да биде очекувана кај оние лицата со тешка форма на болеста (особено по 20-годишна возраст) и може, кај некои, да предизвика дополнително намалување на мобилноста.[119]
Исто така, може да се направи вибрација на целото тело со специјализирана апаратура (tilt table) за да се зголеми подвижноста на долгорочно имобилизираните ( приковани за кревет) пациенти ; во најмалку два случаи им помогнало на децата кои биле врзани за кревет да можат да седат исправено.[84][120]
Заби
уредиПовеќе од 1 од 2 лица со ОИ, исто така, имаат имперфектна дентиногенеза (dentinogenesis imperfecta,DI) - вродена абнормалност во формирањето на дентинот, една од четирите главни компоненти на човечкиот заб.[121] Стоматолошкиот третман може да претставува предизвик како резултат на различните деформитети, скелетни и забни. Децата со ОИ треба да одат на стоматолошки преглед веднаш штом им изникнат забите ; ова може да го минимизира губењето на структурата на забите како резултат на абнормален дентин и тие треба редовно да се следат за да се зачуваат нивните заби и оралното здравје.[121]
Многу луѓе со ОИ се третираат со бифосфонати и можат да се појават компликации со стоматолошки процедури, на пример, остеонекроза на вилицата поврзана со лекови (MRONJ). Сепак, не беше пронајден извештај за MRONJ поврзан со бифосфонати ниту кај дете ниту кај возрасен со ОИ во прегледот на Кокрајн од 2016 година за безбедноста и ефикасноста на бифосфонати за ОИ.[3]
Во развој
уредиМоноклонални антитела
уредиМоноклоналните антитела веќе долго време се разгледуваат како можен лек, но до 2021 година, таквата терапија не е одобрена, ниту во Европската Унија ниту во Соединетите држави. Така, не е јасно дали се безбедни или ефикасни. Меѓу моноклоналните антитела кои се проучувани се ромосозумаб (цели склеростин, од Amgen), фрезолимумаб (TGF-β, Санофи), блозозумаб (склеростин, Лили ) и сетрузумаб (склеростин, започнат од Новартис).[122]
Сетрузумаб, првобитно познат како BPS-804, е моноклонално антитело кое го таргетира склеростинот и е проучуван кај ОИ конкретно повеќе од било кој од другите. Во телото, склеростинот се врзува за рецепторите LRP5 и LRP6, што резултира со инхибиција на ВНГ сигналната патека . Ова го намалува формирањето на коските и не е проблем кога некое лице има здрави коски.[123] Сепак, се смета дека намалувањето на концентрацијата на склеростин во телото може да доведе до формирање на повеќе коски, и тоа е премисата зошто моноклоналните антитела кои ги намалуваат концентрациите на природно настанатиот склеростин може да помогнат во зајакнувањето на ОИ коските.[124] Додека сетрузумаб првпат бил развиен во фармацевтската компанија Новартис, Новартис ги продал своите права за патентирање на лекот на Мерео Биофарма во 2015 година, кој го продолжи својот развој во врска со Ултрагеникс.[122][125] Во 2019 година, Мерео објавил дека завршил со собирање податоци за неговата фаза II-B испитување на сетрузумаб; студијата била завршена на 12 ноември 2020 година[122][126] И покрај тоа што пробните податоци не покажале подобрувања во коскената густина на QCT снимките, нејзината примарна цел, имала подобрувања на DXA снимките.[127] Во соопштението за печатот од септември 2020 година, Мерео рекол дека се обидува да направи проба во фаза III во 2021 година и дека добил ознака за Ретка педијатриска болест (РПД) од американската Администрација за храна и лекови.[128]
Ромозозумаб, кој исто така е моноклонално антитело насочено кон склеростин, е одобрен лек во САД и ЕУ за третман на остеопороза. Аналитичарот на фармацевтската индустрија Evercore забележал дека може да дојде до уништување на економијата на сетрусумабот бидејќи ромосозумабот е поевтини отколку лекот за ретка болест, тврдејќи дека ќе биде „витално“ за профитните маржи на Ultragenyx да се докаже дека неговиот сетрузумаб е поефикасен од romosozumab за лекување на ОИ.[122] Клиничкото испитување со кое се оценува ефикасноста на ромозозумаб кај ОИ започнало во септември 2020 година и од септември 2021 година е во тек.[129] Ultragenyx предвидува дека неговите фази 2/3 испитувања за сетрузумаб ќе бидат завршени во 2026 година.[130][131]
Превенција
уредиКако генетско нарушување, основата на превенцијата на остеогенезис имперфекта во дваесет и првиот век се заснова на пренатална дијагноза. Генетското советување може да им помогне на пациентите и нивните семејства да одредат какви видови испитувања доколку се потребни би можеле да се направат во нивната ситуација. Пациентите може да размислат за генетска дијагноза пред имплантација по ин витро оплодување за да изберат оплодени ембриони кои не се заразени. Вообичаените мутации кои предизвикуваат ОИ може да се фатат со секвенционирање на егзом и секвенционирање на целиот геном . Ако бременоста е веќе во тек, може да се изврши процедура на амниоцентеза за да се види дали фетусот е заразен. Доколку е заразен се остава на семејството да размисли дали сака или не да ја прекине бременоста и да се обиде повторно - покренувајќи прашања за медицинската етика и правото на жената да избира.[132][133]
Без интервенција, пациентите со најчестите мутации кои предизвикуваат остеогенезис имперфекта имаат 50% шанса по бременост да го пренесат нарушувањето, бидејќи овие мутации се наследуваат во автосомно доминантен модел на менделово наследство. Оние со ретките автосомно рецесивни форми на ОИ имаат 25% шанса да го пренесат нарушувањето. Може да се користи генетско тестирање на засегнатите членови на семејството за да се утврди кој модел на наследување се применува.
Типот I може да биде тежок за откривање кај новородено дете, па поради тоа крвта од папочна врвца на детето може да се тестира за да се утврди дали е пренесена болеста ако семејството веќе ги отфрлило поинвазивните методи на генетски скрининг. Во потешки случаи, дијагнозата може да се направи преку ултразвук, особено ако ОИ е веќе можна. Етичката грижа за пренаталниот скрининг за ОИ често се јавува кога родителите се распрашуваат колку сериозно ќе биде погодено нивното дете - на таквите прашања сè уште е тешко да се одговори сигурно.
Ако незасегнатото лице веќе имало дете со ОИ, постои поголема веројатност (иако помала), нивните идни деца да имаат ОИ поради генетски мозаицизам.[89]
Критиката за правата на попреченост на пренаталниот скрининг за ОИ, која ја имаат некои биоетичари и некои засегнати поединци, негативно се споредува со евгениката, со тоа што дури и оние кои не се против абортусот се спротивставуваат на селективни абортуси на етичка основа дека нивното постоење го издава верувањето дека животите на оние со ОИ се „помалку вредни за живот“.
Прогноза
уредиРазличните типови на болеста имаат различна прогноза. Времето кога почнале да се појавуваат фрактурите е важен прогнозирачки фактор за можноста за одење. Преживувањето зависи од локацијата на фрактурите, нивната тежина и општиот изглед на скелетот на радиографии. Децата кои успеале самостојно да седат или одат или обете до 12-годишна возраст, конечно ќе можат да се движат. Децата кои успеале самостојно да седат или стојат или обете до 12-месечна возраст, веројатно ќе можат да се движат.
Очекуваниот животен век
уредиВо благата форма на нарушувањето, тип I, очекуваниот животен век на пациентите е близок до оној на општата популација.[5] Во тип II, сепак, пациентите многу ретко живеат над двегодишна возраст и обично умираат во првите недели од животот.[1] Проценката на очекуваниот животен век на пациентите со типови III и IV е посложен, бидејќи изборот на животниот стил може да предизвика фатално трауматски повреди кои инаку не би се случиле или не би биле фатални кај општата популација. Очекуваниот животен век кај тип IV се смета дека е блиску до нормалата, но кај тип III е помал отколку кај општата популација.[44]
Студија од 2016 година за податоци во данскиот National Patient Register открил дека кај сите видови ОИ, смртноста поради сите причини е три пати поголема, што доведело до губење од околу седум години кај жените и девет години кај мажите.[12] Студија од 1996 година објавена во Британскиот медицински весник покажал дека смртноста кај тип III е значително повисока, при што многу пациенти умираат во нивните 20-ти, 30-ти и 40-ти; Пациентите кои преживувеале до 10-годишна возраст дополнително се покажало дека имаат подолг животен век од новороденчињата.[134]
Мобилност
уредиНа луѓето со благ (тип I) ОИ како возрасни може да имаат потреба од адаптивна опрема,поради моторни задоцнувања.
Дополнителна опрема како што се патерици, моторизирани инвалидски колички, шини, продолжувачи на дофат и/или други модификации во домот, може да им бидат од корист на многу лица со умерен до тежок OI за да постигнат или одржат значителен степен на независност.[15] Со третман и физикална терапија, максималните нивоа на мобилност се очекува да бидат безпомогнато одење во заедница за тип I, пешачење во домаќинството или вежбање за тип III и одење во домаќинство или заедница за тип IV; поради варијабилноста на ОИ помеѓу поединци, постигнатата мобилност варира и може да биде под овој очекуван максимум.[5]
Епидемиологија
уредиВо Соединетите Држави, инциденцата на остеогенезис имперфекта се проценува на едно на 20.000 живородени деца.[135] Се проценува дека 20.000 до 50.000 луѓе се погодени од ОИ во Соединетите Држави.[136]
Најчести типови се I, II, III и IV, додека останатите се многу ретки.[137] Типот I е најчест и е пријавен дека е околу три пати почест од типот II. Преваленцата на типовите III и IV е помала.[20] Во една студија од 1989 година во Данска, било откриено дека типот I опфаќа 71% од случаите, а типот II 12% од случаите, додека другите типови ги сочинуваат останатите 17%.[12] Во една студија од 2015 година во Шведска, типот I бил скоро шест пати почест од типот III и речиси четири пати почест од типот IV.[21]
Повеќето луѓе со ОИ ја добиваат болеста од родител, но во многу случаи, тоа е сосема нова (де ново или „спорадична“) мутација во семејството. Меѓу студијата на пациенти со преживливи типови на ОИ, ОИ тип III е најчесто de novo (85%), проследен со тип IV (50%) и тип I (34%).
Кај некои популации може да се појави поголема инциденца на ОИ отколку што инаку би се очекувало ако имаат поголем од просечниот број на носители на рецесивните форми на болеста.[138]
Компликации
уредиСледните компликации можат да се појават кај пациенти со ОИ:
1. Формирање на хиперпластичен калус;
2. Појава на остеоген сарком;
3. Базиларна инвагинација со вклучување на кранијалните нерви, директна компресија на мозочкото стебло, пореметена динамика на ликворот;
4. Малигна хипертермија, за која треба да се свесни хирургот и анестезиологот при аплицирање на анестезија.
Историја
уредиВидовите ОИ имале разни други имиња низ годините и во различни народи; Сепак, „ остеогенезис имперфекта “ е најшироко прифатеното име за состојбата од крајот на 20 век. Меѓу некои од најчестите алтернативи се „fragilitas ossium“;[140] „Екман-Лобштајн синдром“ и „Вролик синдром“, и двата епоними ; и, колоквијализмот, „болест на кршливи коски“.
Најраните регистрирани случаи
уредиОИ била идентификувана кај староегипетско новороденче мумифицирано околу 1000 п.н.е., кое првично го отфрлиле археолозите дека содржи остатоци од мајмун.[141][142] Нордискиот крал Ивар Бескостениот,[143] се шпекулира дека имал и ОИ.[144]
Николас де Малебранш е заслужен како првиот човек што ги опишал физичките одлики на ОИ во неговата книга The Search after Truth од 1688 година., во која тој опишувал човек на кој цел живот му се скршени коските.[24][142]
Најраните современи научни студии за ОИ започнале во 1788 година од страна на Олоф Јакоб Екман, кој ја опиша состојбата, која тој ја нарекол „вродена остеомалација “, во својата докторска теза и спомнал случаи на нејзино враќање во 1678 година, сите во исто семејство, преку три генерации.[145] Во описот на состојбата на Екман се споменува џуџест раст, кршливост на коските и искривување на долгите коски.[146] Во 1831 година, Едмунд Аксман дал детален опис на тоа во себе и неговите двајца браќа, и бил првиот што ги спомнал сините склери како карактеристичен знак за ОИ.[24] Жан Лобштајн прв ја опишал благата форма на состојбата, денес позната како тип I, во 1833 година, нарекувајќи ја „остео псатироза идиопатска“.[139]
Дури во 1912 година, губењето на слухот било препознаено како симптом на ОИ, првпат споменат во краток труд од англискиот лекар Чарлс Ален Адаир-Дајтон.[142][147]
За терминот
уреди
Вилем Вролик, холандски анатом, кој исто така бил куратор на „Музејот Вроликианум“, поради што бил запознаен со многу примероци на тела со вродени дефекти, го измислил терминот „остеогенезис имперфекта“[24] во неговата двојазична книга за тератологија на латински и холандски јазик, Илустрации на ембриогенезата на луѓето и цицачите, првпат објавена во 1849 година[148]
Вклучен е опис на останките на новороденче кое го имало она што сега е познато како перинатално фатален ОИ тип II[139] (како што е потврдено во повторното испитување на останките од 1998 година од Баљет и сор.).[149] Посмртните останки најпрво му биле дадени на таткото на Вролик, кој не се разбирал. Вролик опишал слабо минерализирани коски, свиткани долги коски и фрактури во различни состојби на заздравување.[150] Вролик точно утврдил дека она што тој го нарекол ОИ кај доенчето не е предизвикано од секундарен рахитис, туку од вродена абнормалност што предизвикува примарна остеопенија ; тој теоретизирал дека ова се должи на недостаток на „внатрешна генеративна енергија“.[149]
За класификација
уредиКласификацијата на ОИ, исто така, еволуирала бидејќи се збогатиле познавањата на болеста. Пред појавата на модерното генетско тестирање, ОИ била класифициран во две широки групи: osteogenesis imperfecta congenita и osteogenesis imperfecta tarda, поделба првпат предложена од германскиот лекар Е. Лосер во 1906 година.[140][151] Терминот Congenita се користел за опишување на современите клинички типови II, III и некои случаи на IV, каде што по раѓањето состојбата е очигледна, или поради искривување на екстремитетите или поради фрактури уште во матката.[60] Додека терминто Tarda се користел за класификација на современиот ОИ тип I и некои случаи од типот IV, каде што вродената кршливост на коските не станува јасна дури долго по раѓањето.[140] Идејата дека овие „доцни“ и „пренатални“ форми се манифестации на истото нарушување за прв пат било предложена во 1897 година од Мартин Бено Шмит ; до 1950-тите овој факт не бил добро прифатен.[139]
Современиот систем од четири типа (I, II, III, IV), во меѓувреме, бил воведен во труд од Дејвид Сајленс, Алисон Сен и Дејвид Данкс во весник за медицинска генетика во 1979 година [60][152] и оттогаш биле воведени стандардни термини меѓу лекарите, пациентите и истражувачите.[40][43][153] Современите генетски типови, (оние со броеви поголеми од IV,) стапиле во употреба бидејќи се повеќе и повеќе рецесивно наследени форми на ОИ биле откриени по откривањето на првиот од Рој Морело и сор. во 2006 година.[4][42][64] Во 2010 година, Меѓународната номенклатурна група за уставни нарушувања на скелетот (INCDS) ги „ослободила“ типовите Silence од молекуларната референца, прифаќајќи се со нивната нова клиничка-прва улога во пресрет на она што за нив беше „изненадувачки“ зголемување на бројот на генетските причини за ОИ.[43][153]
Општество и култура
уредиМногу медицински истражувања се направени за да се откријат причините за остеогенезис имперфекта, од корист не само на оние со ОИ, туку и на медицината ; во десетте години помеѓу 2006 и 2016 година, многуте откритија на рецесивни генски мутации кои не се поврзани со колаген, кои сè уште ги доведоа кај оние што ги имаат до клиничките знаци на ОИ, довеле до бројни откритија во медицинското разбирање на процесот на здрав развој на коските.[4]
Кај животни
уредиКај кучињата, ОИ е автосомно рецесивна состојба, што значи дека кучињата со две копии од алелот ќе бидат засегнати. Многу организации за раси и ветеринари нудат ОИ тестови за да кажат дали кучето е носител.
Природни мутации кои предизвикуваат ОИ се пронајдени кај златни ретривери, дакелови и бигли. ОИ исто така е идентификуван кај зебра рибите и глувците.
Иако кучињата, глувците, рибите и луѓето не се генетски идентични, некои од овие животински модели се официјално признати дека ги претставуваат различните типови на ОИ кај луѓето. На пример, хомозиготните оим / оим глувци доживуваат спонтани фрактури на коските, мала големина на телото и кифоза, што ги прави модел на ОИ тип III. Во меѓувреме, хетерозиготните oim /+ глувци изгледаат нормални, но имаат коски кои се малку послаби од дивите глувци, што ги прави модел за ОИ тип I.[154][155] Како и кај човечкиот ОИ, локацијата на генот што е мутиран влијае на сериозноста на добиената болест - глувчето G859C Col1a1 е модел за ОИ тип II бидејќи погодените глувци умираат во перинаталниот период.[154]
Тестирањето на животни на идентификувани животински модели може да доведе до човечки терапии за ОИ.[154]
Наводи
уреди- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 Rowe DW (2008). „Osteogenesis imperfecta“. Principles of bone biology (3rd. изд.). Amsterdam: Elsevier. стр. 1511–1531. ISBN 978-0-12-373884-4. OCLC 267135745. Архивирано од изворникот на 20 September 2021. Посетено на 15 August 2021.
Dentinogenesis imperfecta (DI) is most frequent in OI types III and IV, and overall, affects about 15% of OI patients among the different phenotypes.
- ↑ 2,0 2,1 2,2 2,3 2,4 „De novo and inherited pathogenic variants in collagen-related osteogenesis imperfecta“. Molecular Genetics & Genomic Medicine. 7 (3): e559. March 2019. doi:10.1002/mgg3.559. PMC 6418448. PMID 30675999.CS1-одржување: display-автори (link)
- ↑ 3,0 3,1 3,2 3,3 „Bisphosphonate therapy for osteogenesis imperfecta“. The Cochrane Database of Systematic Reviews. 2016 (10): CD005088. October 2016. doi:10.1002/14651858.CD005088.pub4. PMC 6611487. PMID 27760454.
- ↑ 4,0 4,1 4,2 4,3 4,4 „Osteogenesis imperfecta“. Lancet. 387 (10028): 1657–1671. April 2016. doi:10.1016/S0140-6736(15)00728-X. PMC 7384887. PMID 26542481.
- ↑ 5,00 5,01 5,02 5,03 5,04 5,05 5,06 5,07 5,08 5,09 5,10 Shapiro JR, Byers PH, Glorieux FH, Sponseller PD (2014). Osteogenesis imperfecta: a translational approach to brittle bone disease (2. изд.). London: Elsevier Inc. ISBN 978-0-12-397165-4. OCLC 876364090.
- ↑ 6,0 6,1 „Osteogenesis imperfecta“. Genetics Home Reference. U.S. National Library of Medicine, National Institutes of Health. 2020-08-18. Архивирано од изворникот на 29 August 2021. Посетено на 2021-08-15.
- ↑ 7,0 7,1 7,2 7,3 7,4 7,5 „Osteogenesis Imperfecta Overview“. National Institute of Arthritis and Musculoskeletal and Skin Diseases. National Institutes of Health. July 2019. Архивирано од изворникот на 2021-05-09. Посетено на 2021-08-21.
- ↑ „Aortic dissection in osteogenesis imperfecta: case report and review of the literature“. Emergency Radiology. 19 (6): 553–556. December 2012. doi:10.1007/s10140-012-1044-1. PMID 22527359.
- ↑ „Rib cage deformities alter respiratory muscle action and chest wall function in patients with severe osteogenesis imperfecta“. PLOS ONE. 7 (4): e35965. 2012-04-27. Bibcode:2012PLoSO...735965L. doi:10.1371/journal.pone.0035965. PMC 3338769. PMID 22558284.
- ↑ 10,0 10,1 10,2 10,3 „The Spine in Patients With Osteogenesis Imperfecta“. The Journal of the American Academy of Orthopaedic Surgeons. 25 (2): 100–109. February 2017. doi:10.5435/JAAOS-D-15-00169. PMID 28009707.
- ↑ Shapiro JR, Sponseller PD (2005-08-23). „10—Osteogenesis Imperfecta“. Во Kleerekoper M, Siris ES, McClung M (уред.). The Bone and Mineral Manual: A Practical Guide (англиски). Elsevier Inc. стр. 45. ISBN 978-0-08-047074-0. Архивирано од изворникот на 20 September 2021. Посетено на 17 September 2021.
- ↑ 12,0 12,1 12,2 12,3 „Mortality and Causes of Death in Patients With Osteogenesis Imperfecta: A Register-Based Nationwide Cohort Study“. Journal of Bone and Mineral Research. 31 (12): 2159–2166. December 2016. doi:10.1002/jbmr.2895. PMID 27345018. Архивирано од изворникот на 26 August 2021. Посетено на 26 August 2021.CS1-одржување: display-автори (link)
- ↑ 13,0 13,1 13,2 13,3 13,4 „Osteogenesis imperfecta: an update on clinical features and therapies“. European Journal of Endocrinology. 183 (4): R95–R106. October 2020. doi:10.1530/EJE-20-0299. PMC 7694877 Проверете ја вредноста
|pmc=(help). PMID 32621590. Архивирано од изворникот на 17 August 2021. Посетено на 17 August 2021. - ↑ 14,0 14,1 14,2 „Interaction between KDELR2 and HSP47 as a Key Determinant in Osteogenesis Imperfecta Caused by Bi-allelic Variants in KDELR2“. American Journal of Human Genetics. 107 (5): 989–999. November 2020. doi:10.1016/j.ajhg.2020.09.009. PMC 7675035 Проверете ја вредноста
|pmc=(help). PMID 33053334 Проверете ја вредноста|pmid=(help). Архивирано од изворникот на 20 September 2021. Посетено на 29 August 2021.CS1-одржување: display-автори (link) - ↑ 15,0 15,1 Donohoe M (2020). „Therapy, Orthotics and Assistive Devices for Osteogenesis Imperfecta“. Во Kruse RW (уред.). Osteogenesis Imperfecta. Osteogenesis Imperfecta: A Case-Based Guide to Surgical Decision-Making and Care (англиски). Springer International Publishing. стр. 21–37. doi:10.1007/978-3-030-42527-2_3. ISBN 978-3-030-42526-5.
- ↑ „What People With Osteogenesis Imperfecta Need To Know About Osteoporosis“. Osteoporosis and Related Bone Diseases National Resource Center. National Institutes of Health. November 2018. Архивирано од изворникот на 18 March 2021. Посетено на 2021-09-18.
- ↑ 17,0 17,1 „Osteogenesis Imperfecta Surgical Management of the Femur and Knee“ (ePub), Osteogenesis Imperfecta: A Case-Based Guide to Surgical Decision-Making and Care (англиски), Springer International Publishing: 147–182, 2020, doi:10.1007/978-3-030-42527-2_10, ISBN 978-3-030-42527-2
- ↑ „Update on the evaluation and treatment of osteogenesis imperfecta“. Pediatric Clinics of North America. 61 (6): 1243–1257. December 2014. doi:10.1016/j.pcl.2014.08.010. PMID 25439022.
- ↑ 19,0 19,1 „Effects of oral alendronate on BMD in adult patients with osteogenesis imperfecta: a 3-year randomized placebo-controlled trial“. Journal of Bone and Mineral Research. 21 (2): 300–306. February 2006. doi:10.1359/JBMR.051015. PMID 16418786.CS1-одржување: display-автори (link)
- ↑ 20,0 20,1 20,2 Subramanian S, Viswanathan VK (2021). Osteogenesis Imperfecta. StatPearls Publishing. StatPearls. PMID 30725642. Архивирано од изворникот на 21 October 2020. Посетено на 30 July 2019. Last Update: February 3, 2019.
- ↑ 21,0 21,1 21,2 „Genetic epidemiology, prevalence, and genotype-phenotype correlations in the Swedish population with osteogenesis imperfecta“. European Journal of Human Genetics. 23 (8): 1042–1050. August 2015. doi:10.1038/ejhg.2015.81. PMC 4795106. PMID 25944380.
- ↑ 22,0 22,1 22,2 22,3 22,4 22,5 „A Multicenter Study of Intramedullary Rodding in Osteogenesis Imperfecta“. JB & JS Open Access. 5 (3): e20.00031. 2020-09-11. doi:10.2106/JBJS.OA.20.00031. PMC 7489747. PMID 32984750.
- ↑ 23,0 23,1 Kelly EB (2012). Encyclopedia of Human Genetics and Disease. ABC-CLIO. стр. 613. ISBN 9780313387135. Архивирано од изворникот на 2017-11-05.
- ↑ 24,0 24,1 24,2 24,3 24,4 24,5 Dang Do AN, Marini JC (2021-01-27). „Osteogenesis imperfecta“. Во Carey JC, Cassidy SB, Battaglia A, Viskochil D (уред.). Cassidy and Allanson's Management of Genetic Syndromes (англиски). John Wiley & Sons. стр. 683–705. ISBN 978-1-119-43267-8. Архивирано од изворникот на 29 August 2021. Посетено на 29 August 2021.
- ↑ „A variant of osteogenesis imperfecta type IV with resolving kyphomelia is caused by a novel COL1A2 mutation“. Journal of Medical Genetics. 39 (2): 128–132. February 2002. doi:10.1136/jmg.39.2.128. PMC 1735034. PMID 11836364.
- ↑ „Journal of the College of Physicians and Surgeons Pakistan“ (PDF). Journal of the College of Physicians and Surgeons Pakistan. 24 (9): 653–657. Архивирано од изворникот (PDF) на 17 August 2021. Посетено на 17 August 2021.
- ↑ „Mutations near amino end of alpha1(I) collagen cause combined osteogenesis imperfecta/Ehlers-Danlos syndrome by interference with N-propeptide processing“. The Journal of Biological Chemistry. 280 (19): 19259–19269. May 2005. doi:10.1074/jbc.m414698200. PMID 15728585. Архивирано од изворникот на 20 September 2021. Посетено на 17 August 2021.CS1-одржување: display-автори (link)
- ↑ „Combined osteogenesis imperfecta and Ehlers–Danlos syndrome 1; OIEDS1“. Online Mendelian Inheritance in Man. Johns Hopkins University. 2020-12-02. 619115. Архивирано од изворникот на 20 September 2021. Посетено на 2021-08-17.
- ↑ 29,0 29,1 „How common is hearing impairment in osteogenesis imperfecta?“. The Journal of Laryngology and Otology. 115 (4): 280–282. April 2001. doi:10.1258/0022215011907442. PMID 11276328. Архивирано од изворникот на 20 September 2021. Посетено на 15 August 2021.
- ↑ „OI Issues: Hearing Loss“. 2005-11-02. Архивирано од изворникот на 2012-01-20. Посетено на 4 November 2018.
- ↑ „Otopathology in Osteogenesis Imperfecta“. Otology & Neurotology. 33 (9): 1562–1566. December 2012. doi:10.1097/MAO.0b013e31826bf19b. PMC 3498599. PMID 22996160.
- ↑ „Hearing loss in osteogenesis imperfecta: characteristics and treatment considerations“. Genetics Research International. Hindawi. 2011: 983942. 2011-12-14. doi:10.4061/2011/983942. PMC 3335494. PMID 22567374.
- ↑ „Hearing loss in children with osteogenesis imperfecta“. European Journal of Pediatrics. 159 (7): 515–519. July 2000. doi:10.1007/s004310051322. PMID 10923226. Архивирано од изворникот на 15 August 2021. Посетено на 15 August 2021.
- ↑ „Audiological findings in osteogenesis imperfecta“. Journal of the American Academy of Audiology. 19 (8): 595–601. September 2008. doi:10.3766/jaaa.19.8.3. PMID 19323351.
- ↑ „Craniospinal abnormalities and neurologic complications of osteogenesis imperfecta: imaging overview“. Radiographics. 32 (7): 2101–2112. 2012-12-01. doi:10.1148/rg.327125716. PMID 23150860. Архивирано од изворникот на 18 August 2021. Посетено на 18 August 2021.
- ↑ „Cardiorespiratory complications in patients with osteogenesis imperfecta“. Paediatria Croatica (англиски). 61 (3): 106–111. 2017-09-25. ISSN 1330-1403. Архивирано од изворникот на 20 September 2021. Посетено на 29 August 2021.
- ↑ „Acetabular protrusion in osteogenesis imperfecta“. Journal of Pediatric Orthopedics. 22 (5): 622–625. September 2002. doi:10.1097/01241398-200209000-00010. PMID 12198464.
- ↑ 38,0 38,1 „Gastrointestinal problems in patients who have type-III osteogenesis imperfecta“. The Journal of Bone and Joint Surgery. American Volume. 77 (9): 1352–1356. September 1995. doi:10.2106/00004623-199509000-00010. PMID 7673285.
- ↑ 39,0 39,1 39,2 39,3 39,4 39,5 „New genes in bone development: what's new in osteogenesis imperfecta“. The Journal of Clinical Endocrinology and Metabolism. 98 (8): 3095–3103. August 2013. doi:10.1210/jc.2013-1505. PMC 3733862. PMID 23771926.
- ↑ 40,0 40,1 40,2 40,3 „Classification of Osteogenesis Imperfecta revisited“. European Journal of Medical Genetics. 53 (1): 1–5. 2010-01-01. doi:10.1016/j.ejmg.2009.10.007. PMID 19878741. Архивирано од изворникот на 21 August 2021. Посетено на 21 August 2021.
In 1979 Sillence proposed a classification of Osteogenesis Imperfecta (OI) in OI types I, II, III and IV. In 2004 and 2007 this classification was expanded with OI types V–VIII because of distinct clinical features and/or different causative gene mutations.
- ↑ „Osteogenesis imperfecta, type I; OI1“. Online Mendelian Inheritance in Man (англиски). Johns Hopkins University. 2018-10-23. 166200. Архивирано од изворникот на 26 March 2021. Посетено на 2021-08-17.
- ↑ 42,0 42,1 42,2 42,3 42,4 „Osteogenesis Imperfecta: A Review with Clinical Examples“. Molecular Syndromology. 2 (1): 1–20. December 2011. doi:10.1159/000332228. PMC 3343766. PMID 22570641.
- ↑ 43,00 43,01 43,02 43,03 43,04 43,05 43,06 43,07 43,08 43,09 „Osteogenesis imperfecta: clinical diagnosis, nomenclature and severity assessment“. American Journal of Medical Genetics. Part A. 164A (6): 1470–1481. June 2014. doi:10.1002/ajmg.a.36545. PMC 4314691. PMID 24715559.
- ↑ 44,0 44,1 44,2 44,3 Steiner RD, Pepin MG, Byers PH, Pagon RA, Bird TD, Dolan CR, Stephens K, Adam MP (2021-05-06). „COL1A1/2 Osteogenesis Imperfecta“. Во Adam MP, Ardinger HH, Pagon RA, и др. (уред.). GeneReviews [Internet]. University of Washington, Seattle. PMID 20301472. Архивирано од изворникот на 18 January 2017. Посетено на 2021-08-26.
- ↑ 45,0 45,1 „Phenotypic variability of osteogenesis imperfecta type V caused by an IFITM5 mutation“. Journal of Bone and Mineral Research. 28 (7): 1523–1530. July 2013. doi:10.1002/jbmr.1891. PMC 3688672. PMID 23408678.CS1-одржување: display-автори (link)
- ↑ 46,0 46,1 46,2 „Type V osteogenesis imperfecta: a new form of brittle bone disease“. Journal of Bone and Mineral Research. 15 (9): 1650–1658. September 2000. doi:10.1359/jbmr.2000.15.9.1650. PMID 10976985.CS1-одржување: display-автори (link)
- ↑ Rudd A (2016-03-26). „Jordanne Whiley: 'To achieve perfection is impossible. You should be who you are because someone will find you attractive'“. The Times (англиски). ISSN 0140-0460. Посетено на 2022-03-26.
- ↑ Harvey K (March 6, 2015). „The Middle star says it's OK to be a nerd“. Stuff. New Zealand: Stuff Ltd. Посетено на May 25, 2018.
- ↑ „Schauspieler und Kämpfer für Behindertenrechte: Peter Radtke ist tot“ [Actor and campaigner for disability rights Peter Radtke has died]. Der Spiegel (германски). 2020-11-30. ISSN 2195-1349. Посетено на 2022-03-26.
- ↑ „Theresia Haidlmayr“. Behinderte Menschen in Not (германски). Архивирано од изворникот на 2016-03-04. Посетено на 2022-03-26.
- ↑ 51,0 51,1 „Mortality in various types of osteogenesis imperfecta“. Journal of Insurance Medicine. 33 (3): 216–220. 2001. PMID 11558400. Архивирано од изворникот на 15 August 2021. Посетено на 15 August 2021.
- ↑ „Osteogenesis Imperfecta: Types, Symptoms & Management“. Cleveland Clinic. 2021-05-05. Архивирано од изворникот на 17 August 2021. Посетено на 2021-08-17.
- ↑ 53,0 53,1 „Osteogenesis imperfecta: recent findings shed new light on this once well-understood condition“ (PDF). Genetics in Medicine. 11 (6): 375–385. June 2009. doi:10.1097/GIM.0b013e3181a1ff7b. PMID 19533842. Архивирано од изворникот (PDF) на 20 September 2021. Посетено на 19 August 2021.
- ↑ „Determinants of survival in osteogenesis imperfecta (OI) Type II“. Bone Abstracts. 7: 31. 2019-07-31. doi:10.1530/boneabs.7.P31. ISSN 2052-1219. Архивирано од изворникот на 20 September 2021. Посетено на 19 August 2021.
- ↑ „Intramuscular VEGF repairs the failing heart: role of host-derived growth factors and mobilization of progenitor cells“. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 297 (5): R1503–R1515. November 2009. doi:10.1152/ajpregu.00227.2009. PMC 2777764. PMID 19759338.
- ↑ „Genotype-phenotype correlations in autosomal dominant osteogenesis imperfecta“. Journal of Osteoporosis. 2011: 540178. 2011-09-06. doi:10.4061/2011/540178. PMC 3170785. PMID 21912751.
For example, it can occur that a fetus is diagnosed with OI type II, the lethal form, on prenatal ultrasound, but after birth turns out to be less severely affected than initially thought and is eventually reclassified as OI type III or even type VI, if adequate management is initiated early on.
- ↑ „Surgical treatment in Osteogenesis Imperfecta - 10 years experience“. Journal of Medicine and Life. 6 (2): 205–213. June 2013. PMC 3725451. PMID 23904885.
- ↑ Chen H (2006). „Triangular face“. Atlas of genetic diagnosis and counseling. Totowa, NJ: Humana Press. стр. 771. ISBN 978-1-58829-681-8. Архивирано од изворникот на 8 June 2013.
- ↑ 59,0 59,1 „A variant of osteogenesis imperfecta type IV with resolving kyphomelia is caused by a novel COL1A2 mutation“. Journal of Medical Genetics. 39 (2): 128–132. February 2002. doi:10.1136/jmg.39.2.128. PMC 1735034. PMID 11836364.
The persistent pale blue sclera is uncommon in OI type IV, but can be seen in up to 10% of affected subjects.
- ↑ 60,0 60,1 60,2 60,3 „Genetic heterogeneity in osteogenesis imperfecta“. Journal of Medical Genetics. 16 (2): 101–116. April 1979. doi:10.1136/jmg.16.2.101. PMC 1012733. PMID 458828.
- ↑ 61,0 61,1 61,2 „A single recurrent mutation in the 5'-UTR of IFITM5 causes osteogenesis imperfecta type V“. American Journal of Human Genetics. 91 (2): 343–348. August 2012. doi:10.1016/j.ajhg.2012.06.005. PMC 3415533. PMID 22863190.CS1-одржување: display-автори (link)
- ↑ „Expanding the Clinical Spectrum of Osteogenesis Imperfecta Type V: 13 Additional Patients and Review“. Frontiers in Endocrinology. 10: 375. 2019-06-12. doi:10.3389/fendo.2019.00375. PMC 6581704. PMID 31244780.
- ↑ „Clinical and Molecular Characterization of Osteogenesis Imperfecta Type V“. Molecular Syndromology (англиски). 6 (4): 164–172. October 2015. doi:10.1159/000439506. PMC 4662268. PMID 26648832.
- ↑ 64,0 64,1 „CRTAP is required for prolyl 3- hydroxylation and mutations cause recessive osteogenesis imperfecta“. Cell. 127 (2): 291–304. October 2006. doi:10.1016/j.cell.2006.08.039. PMID 17055431.CS1-одржување: display-автори (link)
- ↑ „Deficiency of cartilage-associated protein in recessive lethal osteogenesis imperfecta“. The New England Journal of Medicine. 355 (26): 2757–2764. December 2006. doi:10.1056/NEJMoa063804. PMC 7509984 Проверете ја вредноста
|pmc=(help). PMID 17192541.CS1-одржување: display-автори (link) - ↑ „Prolyl 3-hydroxylase 1 deficiency causes a recessive metabolic bone disorder resembling lethal/severe osteogenesis imperfecta“. Nature Genetics. 39 (3): 359–365. March 2007. doi:10.1038/ng1968. PMC 7510175 Проверете ја вредноста
|pmc=(help). PMID 17277775.CS1-одржување: display-автори (link) - ↑ „PPIB mutations cause severe osteogenesis imperfecta“. American Journal of Human Genetics. 85 (4): 521–527. October 2009. doi:10.1016/j.ajhg.2009.09.001. PMC 2756556. PMID 19781681.CS1-одржување: display-автори (link)
- ↑ „Homozygosity for a missense mutation in SERPINH1, which encodes the collagen chaperone protein HSP47, results in severe recessive osteogenesis imperfecta“. American Journal of Human Genetics. 86 (3): 389–398. March 2010. doi:10.1016/j.ajhg.2010.01.034. PMC 2833387. PMID 20188343.CS1-одржување: display-автори (link)
- ↑ „Mutations in the gene encoding the RER protein FKBP65 cause autosomal-recessive osteogenesis imperfecta“. American Journal of Human Genetics. 86 (4): 551–559. April 2010. doi:10.1016/j.ajhg.2010.02.022. PMC 2850430. PMID 20362275.CS1-одржување: display-автори (link)
- ↑ „Osteogenesis Imperfecta“. Indian Journal of Endocrinology and Metabolism. 21 (6): 903–908. 2017. doi:10.4103/ijem.IJEM_220_17. PMC 5729682. PMID 29285457.
- ↑ Shapiro JR (2014). „Clinical and Genetic Classification of Osteogenesis Imperfecta and Epidemiology“. Osteogenesis Imperfecta. Elsevier. стр. 15–22. doi:10.1016/b978-0-12-397165-4.00002-2. ISBN 9780123971654.
- ↑ 72,0 72,1 „Osteogenesis Imperfecta“. Indian Journal of Endocrinology and Metabolism. 21 (6): 903–908. 2017-11-01. doi:10.4103/ijem.IJEM_220_17. PMC 5729682. PMID 29285457.
- ↑ „Study of autosomal recessive osteogenesis imperfecta in Arabia reveals a novel locus defined by TMEM38B mutation“. Journal of Medical Genetics. 49 (10): 630–635. October 2012. doi:10.1136/jmedgenet-2012-101142. PMID 23054245.CS1-одржување: display-автори (link)
- ↑ 74,0 74,1 „Homozygosity for CREB3L1 premature stop codon in first case of recessive osteogenesis imperfecta associated with OASIS-deficiency to survive infancy“. Bone. 114: 268–277. September 2018. doi:10.1016/j.bone.2018.06.019. PMID 29936144. Архивирано од изворникот на 29 August 2021. Посетено на 29 August 2021.CS1-одржување: display-автори (link)
- ↑ „Monoallelic and biallelic CREB3L1 variant causes mild and severe osteogenesis imperfecta, respectively“. Genetics in Medicine. 20 (4): 411–419. April 2018. doi:10.1038/gim.2017.115. PMC 5816725. PMID 28817112.CS1-одржување: display-автори (link)
- ↑ „Recessive osteogenesis imperfecta caused by missense mutations in SPARC“. American Journal of Human Genetics. 96 (6): 979–985. June 2015. doi:10.1016/j.ajhg.2015.04.021. PMC 4457955. PMID 26027498.CS1-одржување: display-автори (link)
- ↑ „FAM46A mutations are responsible for autosomal recessive osteogenesis imperfecta“. Journal of Medical Genetics. The BMJ. 55 (4): 278–284. April 2018. doi:10.1136/jmedgenet-2017-104999. PMID 29358272. Архивирано од изворникот на 29 August 2021. Посетено на 29 August 2021.CS1-одржување: display-автори (link)
- ↑ 78,0 78,1 „MBTPS2 mutations cause defective regulated intramembrane proteolysis in X-linked osteogenesis imperfecta“. Nature Communications. 7 (1): 11920. July 2016. Bibcode:2016NatCo...711920L. doi:10.1038/ncomms11920. PMC 4935805. PMID 27380894.CS1-одржување: display-автори (link)
- ↑ „Autosomal-Recessive Mutations in MESD Cause Osteogenesis Imperfecta“. American Journal of Human Genetics. 105 (4): 836–843. October 2019. doi:10.1016/j.ajhg.2019.08.008. PMC 6817720. PMID 31564437.CS1-одржување: display-автори (link)
- ↑ 80,0 80,1 80,2 „Recessively Inherited Forms of Osteogenesis Imperfecta“. Annual Review of Genetics (англиски). 46 (1): 475–497. 2012-12-15. doi:10.1146/annurev-genet-110711-155608. ISSN 0066-4197. PMID 23145505.
- ↑ „Mutation analysis of the COL1A1 and COL1A2 genes in Vietnamese patients with osteogenesis imperfecta“. Human Genomics. 10 (1): 27. August 2016. doi:10.1186/s40246-016-0083-1. PMC 4983065. PMID 27519266.CS1-одржување: display-автори (link)
- ↑ „Osteogenesis imperfecta: diagnosis and treatment“. Current Opinion in Endocrinology, Diabetes and Obesity. 24 (6): 381–388. December 2017. doi:10.1097/MED.0000000000000367. PMID 28863000.
- ↑ „What is new in genetics and osteogenesis imperfecta classification?“. Jornal de Pediatria. 90 (6): 536–541. 18 July 2014. doi:10.1016/j.jped.2014.05.003. PMID 25046257.
- ↑ 84,0 84,1 84,2 „New perspectives on osteogenesis imperfecta“. Nature Reviews. Endocrinology. 7 (9): 540–557. June 2011. doi:10.1038/nrendo.2011.81. PMC 3443407. PMID 21670757.
- ↑ „Recent Advances in the Genetics of Fractures in Osteoporosis“. Frontiers in Endocrinology (англиски). 10: 337. 2019-06-04. doi:10.3389/fendo.2019.00337. PMC 6559287. PMID 31231309.
- ↑ „Recessive osteogenesis imperfecta: clinical, radiological, and molecular findings“. American Journal of Medical Genetics. Part C, Seminars in Medical Genetics. 160C (3): 175–189. August 2012. doi:10.1002/ajmg.c.31334. PMID 22791419.
- ↑ 87,0 87,1 „Osteogenesis imperfecta due to mutations in non-collagenous genes: lessons in the biology of bone formation“. Current Opinion in Pediatrics. 26 (4): 500–507. August 2014. doi:10.1097/MOP.0000000000000117. PMC 4183132. PMID 25007323.
- ↑ „IFITM5 mutations and osteogenesis imperfecta“. Journal of Bone and Mineral Metabolism. 34 (2): 123–131. March 2016. doi:10.1007/s00774-015-0667-1. PMID 26031935.
- ↑ 89,0 89,1 89,2 „Recurrence of perinatal lethal osteogenesis imperfecta in sibships: parsing the risk between parental mosaicism for dominant mutations and autosomal recessive inheritance“. Genetics in Medicine. 13 (2): 125–130. February 2011. doi:10.1097/GIM.0b013e318202e0f6. PMID 21239989.
- ↑ „Osteogenesis imperfecta“. Lancet. 363 (9418): 1377–1385. April 2004. doi:10.1016/S0140-6736(04)16051-0. PMID 15110498.
- ↑ 91,0 91,1 91,2 „Molecular and mesoscale mechanisms of osteogenesis imperfecta disease in collagen fibrils“. Biophysical Journal. 97 (3): 857–865. August 2009. Bibcode:2009BpJ....97..857G. doi:10.1016/j.bpj.2009.04.059. PMC 2718154. PMID 19651044.
- ↑ 92,0 92,1 92,2 „Osteogenesis imperfecta missense mutations in collagen: structural consequences of a glycine to alanine replacement at a highly charged site“. Biochemistry. 50 (50): 10771–10780. December 2011. doi:10.1021/bi201476a. PMC 3292618. PMID 22054507.
- ↑ 93,0 93,1 „Current concepts in osteogenesis imperfecta: bone structure, biomechanics and medical management“. Journal of Children's Orthopaedics. 13 (1): 1–11. February 2019. doi:10.1302/1863-2548.13.180190. PMC 6376438. PMID 30838070.
- ↑ „A systematized approach to radiographic assessment of commonly seen genetic bone diseases in children: A pictorial review“. J Musculoskelet Surg Res. 1 (2): 25. 15 November 2017. doi:10.4103/jmsr.jmsr_28_17.
- ↑ Jameson JR, Albert CI, Busse B, Smith PA, Harris GF (March 29, 2013). „3D micron-scale imaging of the cortical bone canal network in human osteogenesis imperfecta (OI)“. Во Weaver JB, Molthen RC (уред.). Medical Imaging 2013: Biomedical Applications in Molecular, Structural, and Functional Imaging. 8672. International Society for Optics and Photonics. стр. 86721L. doi:10.1117/12.2007209. Архивирано од изворникот на 7 June 2020. Посетено на 26 August 2020.
- ↑ „Stem cell transplantation before birth - a realistic option for treatment of osteogenesis imperfecta?“. Prenatal Diagnosis. 35 (9): 827–832. September 2015. doi:10.1002/pd.4611. PMID 25962526.
- ↑ „What every clinical geneticist should know about testing for osteogenesis imperfecta in suspected child abuse cases“. American Journal of Medical Genetics. Part C, Seminars in Medical Genetics. 169 (4): 307–313. December 2015. doi:10.1002/ajmg.c.31459. PMID 26566591.
- ↑ „Parents Get $1 Million in False Abuse Case“. Washington Post (англиски). 2005-10-25. ISSN 0190-8286. Посетено на 2022-02-04.
- ↑ 99,0 99,1 „What Is Osteogenesis Imperfecta? Fast Facts: An Easy-to-Read Series of Publications for the Public“. NIAMS. November 2014. Архивирано од изворникот на 18 October 2016. Посетено на 15 October 2016.
- ↑ „Incorporating the patient perspective in the study of rare bone disease: insights from the osteogenesis imperfecta community“. Osteoporosis International. 30 (2): 507–511. February 2019. doi:10.1007/s00198-018-4690-7. PMC 6449303. PMID 30191258.
- ↑ „Cyclic administration of pamidronate in children with severe osteogenesis imperfecta“. The New England Journal of Medicine. 339 (14): 947–952. October 1998. doi:10.1056/NEJM199810013391402. PMID 9753709.Free full text
- ↑ „Two-year clinical trial of oral alendronate versus intravenous pamidronate in children with osteogenesis imperfecta“. Journal of Bone and Mineral Research. 21 (1): 132–140. January 2006. doi:10.1359/JBMR.051006. PMID 16355282.
- ↑ „Risedronate in children with osteogenesis imperfecta: a randomised, double-blind, placebo-controlled trial“. Lancet. 382 (9902): 1424–1432. October 2013. doi:10.1016/S0140-6736(13)61091-0. PMID 23927913.CS1-одржување: display-автори (link)
- ↑ „Oral bisphosphonates for paediatric osteogenesis imperfecta?“. Lancet. 382 (9902): 1388–1389. October 2013. doi:10.1016/S0140-6736(13)61531-7. PMID 23927912.
- ↑ 105,0 105,1 105,2 „PO-0077 Vitamin D Deficiency In Children With Osteogenesis Imperfecta“. Archives of Disease in Childhood (англиски). 99 (Suppl 2): A275. 2014-10-01. doi:10.1136/archdischild-2014-307384.747. ISSN 0003-9888. Архивирано од изворникот на 18 September 2021. Посетено на 18 September 2021.
- ↑ 106,0 106,1 „Predictors and correlates of vitamin D status in children and adolescents with osteogenesis imperfecta“. The Journal of Clinical Endocrinology and Metabolism. 96 (10): 3193–3198. October 2011. doi:10.1210/jc.2011-1480. PMID 21832107.
- ↑ „Study of the Determinants of Vitamin D Status in Pediatric Patients With Osteogenesis Imperfecta“. Journal of the American College of Nutrition. 35 (4): 339–345. 2016-05-18. doi:10.1080/07315724.2015.1057776. PMID 26709914.
- ↑ „Anesthesia in children with osteogenesis imperfecta: Retrospective chart review of 83 patients and 205 anesthetics over 7 years“. Pediatric Anesthesia. 28 (11): 1050–1058. November 2018. doi:10.1111/pan.13504. PMID 30295359. Архивирано од изворникот на 29 August 2021. Посетено на 29 August 2021.
- ↑ Houck JP (2014). „Osteogenesis imperfecta“. Во Houck JP, Hache M, Sun LS (уред.). Handbook of Pediatric Anesthesia. New York: McGraw-Hill Education. ISBN 9780071769358. Архивирано од изворникот на 29 August 2021. Посетено на 29 August 2021.
- ↑ „Anesthetic and Post-operative Pain Management“ (ePub), Osteogenesis Imperfecta: A Case-Based Guide to Surgical Decision-Making and Care (англиски), Springer International Publishing: 111–125, 2020, doi:10.1007/978-3-030-42527-2_8, ISBN 978-3-030-42527-2
- ↑ 111,0 111,1 Behera P, Santoshi JA, Geevarughese NM, Meena UK, Selvanayagam R (2020-02-28). „Dislodgement of Telescopic Nail from the Epiphysis: A Case Report with an Analysis of Probable Mechanism“. Cureus (англиски). 12 (2): e7130. doi:10.7759/cureus.7130. ISSN 2168-8184. PMC 7105006. PMID 32257675.
- ↑ „Financial Assistance“. Shriners Hospitals for Children. Архивирано од изворникот на 2021-03-03. Посетено на 2021-08-21.
Shriners Hospitals for Children is committed to providing specialized care to children with orthopaedic conditions [...] regardless of the families' ability to pay.
- ↑ „A Leader in the Treatment of Osteogensis Imperfecta (OI)“. Shriners International. Архивирано од изворникот на 2007-09-28. Посетено на 2007-07-05.
- ↑ „Fragmentation, Realignment, and Intramedullary Rod Fixation of Deformities of the Long Bones in Children: A Ten-Year Appraisal“. The Journal of Bone and Joint Surgery (англиски). 41 (8): 1371–1391. 1959-12-01. doi:10.2106/00004623-195941080-00001. ISSN 0021-9355.
- ↑ „The Fassier-Duval Telescopic IM System“. Pega Medical (англиски). Laval, Quebec. Архивирано од изворникот на 15 August 2021. Посетено на 2021-08-15.
- ↑ 116,0 116,1 „Osteosynthesis in Osteogenesis Imperfecta, telescopic versus non-telescopic nailing“. Journal of Medicine and Life. 8 (4): 563–565. 2015. PMC 4656972. PMID 26664490.
- ↑ 117,0 117,1 „Fassier–Duval Telescopic IM System Surgical Technique“ (PDF). Pega Medical. Laval, Quebec. 2021. FD-ST-EN Revision K. Архивирано од изворникот (PDF) на 15 August 2021. Посетено на 2021-08-15.
- ↑ „Spinal fusion in children with osteogenesis imperfecta: A nationwide retrospective comparative cohort study over a 12-year period“. Current Orthopaedic Practice (англиски). 31 (1): 72–75. 2020-01-01. doi:10.1097/BCO.0000000000000805. ISSN 1940-7041.
- ↑ „Weight loss surgery improves quality of life in pediatric patients with osteogenesis imperfecta“. Surgery for Obesity and Related Diseases. Elsevier Inc. 13 (1): 41–44. January 2017. doi:10.1016/j.soard.2015.11.029. PMC 5965274. PMID 26948942.
- ↑ „Preliminary results on the mobility after whole body vibration in immobilized children and adolescents“. Journal of Musculoskeletal & Neuronal Interactions. 7 (1): 77–81. 2007-01-01. PMID 17396011. Архивирано од изворникот на 18 August 2021. Посетено на 18 August 2021.
- ↑ 121,0 121,1 „Dentinogenesis imperfecta associated with osteogenesis imperfecta“. Dental Research Journal. 9 (4): 489–494. July 2012. PMC 3491340. PMID 23162594.
- ↑ 122,0 122,1 122,2 122,3 „Recycling pays off for Mereo“. Evaluate Vantage (англиски). 2020-12-18. Архивирано од изворникот на 18 September 2021. Посетено на 2021-09-18.
- ↑ „Role and mechanism of action of sclerostin in bone“. Bone. 96: 29–37. March 2017. doi:10.1016/j.bone.2016.10.007. PMC 5328835. PMID 27742498.
- ↑ „BPS804 Anti-Sclerostin Antibody in Adults With Moderate Osteogenesis Imperfecta: Results of a Randomized Phase 2a Trial“. Journal of Bone and Mineral Research. 32 (7): 1496–1504. July 2017. doi:10.1002/jbmr.3143. PMID 28370407.CS1-одржување: display-автори (link)
- ↑ „Ultragenyx and Mereo BioPharma Announce Collaboration and License Agreement for Setrusumab in Osteogenesis Imperfecta“. Ultragenyx Pharmaceutical Inc. (англиски). 2020-12-17. Архивирано од изворникот на 18 September 2021. Посетено на 2021-09-18.
- ↑ „A Study in Adult Patients With Type I, III or IV Osteogenesis Imperfecta Treated With BPS804 (ASTEROID)“. United States National Library of Medicine. 2021-04-01. NCT03118570. Посетено на 2021-09-18. Наводот journal бара
|journal=(help) - ↑ „Setrusumab ready to advance into pivotal studies“. Trinity Delta (англиски). 2019-11-25. Архивирано од изворникот на 18 September 2021. Посетено на 2021-09-18.
- ↑ „Mereo setrusumab gets FDA rare pediatric disease designation for osteogenesis imperfecta“. BioTuesdays (англиски). 2020-09-24. Архивирано од изворникот на 18 September 2021. Посетено на 2021-09-18.
- ↑ „Study to Evaluate Romosozumab in Children and Adolescents With Osteogenesis Imperfecta“. United States National Library of Medicine. 2021-07-23. NCT04545554. Архивирано од изворникот на 18 September 2021. Посетено на 2021-09-18. Наводот journal бара
|journal=(help) - ↑ Out of Ignorance (2022-09-02). „Ultragenyx Stock: Downward Trajectory Likely to Continue“. Seeking Alpha (англиски). Посетено на 2022-09-24.
- ↑ Ultragenyx Pharmaceutical Inc (2022-09-15). „A Randomized, Double-Blind, Placebo-Controlled, Phase 2/3 Study to Assess the Efficacy and Safety of Setrusumab in Subjects With Osteogenesis Imperfecta“. Mereo BioPharma. Наводот journal бара
|journal=(help) - ↑ „Brittle Bone Disease Forced Mother Into 'No Easy Choice'“. Hartford Courant (англиски). 2012-03-11. Посетено на 2021-09-16.
- ↑ „'Incompatible with life': Mother's account of her difficult decision to request a late-term abortion sheds light on 'live-born' debate“. National Post (англиски). 2013-02-06. Посетено на 2021-09-16.
- ↑ „Life expectancy in osteogenesis imperfecta“. BMJ. 312 (7027): 351. February 1996. doi:10.1136/bmj.312.7027.351. PMC 2350292. PMID 8611834.
- ↑ „Genetics of Osteogenesis Imperfecta“. 29 February 2016. Архивирано од изворникот на 2010-12-30.
- ↑ „2.4: The Frequency of Bone Disease“. Bone Health and Osteoporosis: A Report of the Surgeon General (PDF) (англиски). Rockville, Maryland: Office of the Surgeon General of the United States, U.S. Department of Health and Human Services. 2004. стр. 68. WE 225 B71259 2004.
- ↑ „Osteogenesis Imperfecta Panel“. University of Nebraska Medical Center. Архивирано од изворникот на 30 July 2019. Посетено на 2019-07-30.
- ↑ „Frequency of Recessive Osteogenesis Imperfecta in a Turkish Cohort and Genetic Causes“. ESPE Abstracts (англиски). Bioscientifica. 86: 131. 2016-08-19. Архивирано од изворникот на 26 August 2021. Посетено на 26 August 2021.CS1-одржување: display-автори (link)
- ↑ 139,0 139,1 139,2 139,3 „Osteogenesis imperfecta“. Archives of Disease in Childhood. 31 (159): 346–353. October 1956. doi:10.1136/adc.31.159.346. PMC 2011939. PMID 13363481.
- ↑ 140,0 140,1 140,2 Roger S, Francis MJ, Houghton GR (1983). The brittle bone syndrome: osteogenesis imperfecta. London: Butterworth-Heinemann. стр. 4. ISBN 978-0-407-00211-1. OCLC 9784850.
- ↑ „Osteogenesis imperfecta in a 3,000-year-old mummy“. Child's Nervous System. 25 (5): 515–516. May 2009. doi:10.1007/s00381-009-0817-7. PMID 19212769.
- ↑ 142,0 142,1 142,2 „History of osteogenesis imperfecta or brittle bone disease: a few stops on a road 3000 years long“. B-Ent. 3 (3): 157–173. 2007. PMID 17970442. Архивирано од изворникот на 29 August 2021. Посетено на 29 August 2021.
- ↑ „Ivar the Boneless“. World History Encyclopedia (англиски). Ancient History Encyclopedia Limited. 2018-11-12. Архивирано од изворникот на 2021-08-21. Посетено на 2021-08-21.
- ↑ „Ivar the Boneless“. Encyclopedia Britannica (англиски). 2019-01-08. Архивирано од изворникот на 24 June 2021. Посетено на 2021-08-21.
- ↑ „Osteogenesis imperfecta: a case report and review of literature“. Annals of Medical and Health Sciences Research. Nigerian Medical Association. 4 (Suppl 1): S1–S5. March 2014. doi:10.4103/2141-9248.131683. PMC 4083720. PMID 25031897.
- ↑ „Anatomical Study of a Short-Limbed Dwarf, With Special Reference To Osteogenesis Imperfecta and Chondrodystrophia Foetalis“. The American Journal of the Medical Sciences. J. B. Lippincott & Co. 125 (5): 751–769. May 1903. doi:10.1097/00000441-190305000-00001. ISBN 978-0-243-38392-4. Архивирано од изворникот на 16 August 2021. Посетено на 16 August 2021.
- ↑ „Four generations of blue sclerotics“. The Ophthalmoscope. London: George Pulman & Sons, Ltd. 10: 188–189. 1912. OCLC 1049881577 – преку Internet Archive.
- ↑ Vrolik W (1849). Tabulae ad illustrandam embryogenesin hominis et mammalium, tam naturalem quam abnormem — De Vrucht van den Mensch en van de Zoogdieren afgebeeld en beschreven in hare regelmatige en onregelmatige Ontwikkeling [Illustrations of human and mammalian embryogenesis, both normal and abnormal] (латински и холандски). Amsterdam: G.M.P. Londonck. стр. 562–566. OCLC 489920691. Архивирано од изворникот на 29 August 2021. Посетено на 29 August 2021.
- ↑ 149,0 149,1 „Aspects of the history of osteogenesis imperfecta (Vrolik's syndrome)“. Annals of Anatomy - Anatomischer Anzeiger. 184 (1): 1–7. January 2002. doi:10.1016/S0940-9602(02)80023-1. PMID 11876477. Архивирано од изворникот на 12 June 2018. Посетено на 29 August 2021.
- ↑ Baljet B (2002). „Willem Vrolik and "his" Syndrome“. Во Rauschmann MA, Thomann KD, Zichner, L (уред.). Deutsches Orthopädisches Geschichts und Forschungsmuseum. 4. Heidelberg: Verlag Theodor Steinkopff. стр. 133–144. doi:10.1007/978-3-642-57510-5_15. ISBN 978-3-642-57510-5. Архивирано од изворникот на 8 June 2018. Посетено на 29 August 2021.
- ↑ „Zur Kenntnis der Osteogenesis Imperfecta Congenita et Tarda (sogenannte idiopathische Osteopsatyrosis)“ [On awareness of osteogenesis imperfecta congenita and tarda (so-called "idiopathic osteopsatyrosis")]. Mitteilungen aus den Grenzgebieten der Medizin und Chirurgie (Dispatches from the Frontier of Medicine and Surgery) (германски). 15: 161–207. 1906. Архивирано од изворникот на 21 August 2021. Посетено на 21 August 2021.
- ↑ Rasmussen C, Danks A (2010). Double helix, double joy: David Danks, the father of clinical genetics in Australia (англиски). Carlton, Victoria: Melbourne University Press. стр. 116. ISBN 978-0-522-85799-3. OCLC 906592657. Архивирано од изворникот на 28 August 2021. Посетено на 28 August 2021.
- ↑ 153,0 153,1 „Nosology and classification of genetic skeletal disorders: 2010 revision“. American Journal of Medical Genetics. Part A. 155A (5): 943–968. May 2011. doi:10.1002/ajmg.a.33909. PMC 3166781. PMID 21438135.CS1-одржување: display-автори (link)
- ↑ 154,0 154,1 154,2 „Animal models of osteogenesis imperfecta: applications in clinical research“. Orthopedic Research and Reviews. 8: 41–55. September 2016. doi:10.2147/ORR.S85198. PMC 6209373. PMID 30774469.
- ↑ „Heterozygous oim mice exhibit a mild form of osteogenesis imperfecta“. Bone. 19 (6): 575–579. December 1996. doi:10.1016/S8756-3282(96)00305-5. PMID 8968022. Архивирано од изворникот на 30 June 2018. Посетено на 28 August 2021.
Грешка во наводот: Има ознаки <ref> за група именувана како „note“, но нема соодветна ознака <references group="note"/>.