Флавин аденин динуклеотид
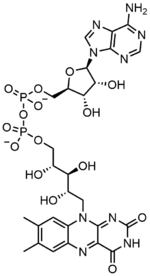
Флавин аденин динуклеотид (FAD) е редокс кофактор, поточно простетична група на белковина, која учествува во неколку значајни ензимски реакции во метаболизмот. Флавобелковина е белковина која во својот состав содржи флавинска група, која може да биде во форма на FAD или во форма на флавин мононуклеотид (FMN). Меѓу позначајните флавобелковини во метаболизмот на клетката спаѓаат: комплексот на сукцинат дехидрогеназа, алфа-кетоглутарат дехидрогеназата и компонента на комплексот на пируват дехидрогеназата.[1]
| |

| |
| Назнаки | |
|---|---|
| 146-14-5 | |
| 3DMet | B04792 |
| Бајлштајн | 1208946 |
| ChEBI | CHEBI:16238 |
| ChEMBL | ChEMBL1232653? |
| DrugBank | DB03147 |
| EC-број | 205-663-1 |
| 108834 | |
| |
IUPHAR/BPS
|
5184 |
| 3Д-модел (Jmol) | Слика |
| KEGG | C00016 |
| MeSH | Flavin-Adenine+Dinucleotide |
| PubChem | 643975 |
| |
| UNII | ZC44YTI8KK |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | Бели, стаклести кристали |
| log P | -1.336 |
| Киселост (pKa) | 1.128 |
| Константа на базицитет (pKb) | 12.8689 |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
FAD може да постои во четири различни редокс состојби: флавин-N(5)-оксид, хинонска форма, полухинонска форма и хидрохинонска форма.[2] FAD се претвора помеѓу овие четири состојби со примање или предавање на електрони. Во својата целосно оксидирана форма, односно хинонска форма, FAD е способен да прими два електрона и два протона за да стане FADH2 (хидрохинонска форма). Полухинонската форма (FADH•) може да се формира со редукција на FAD преку примање на еден електрон и еден протон или со оксидација на FADH2 преку оддавање на еден електрон и еден протон. Сепак, некои белковини создаваат и одржуваат супероксидирана форма на флавинскиот кофактор, флавин-N(5)-оксид.[3][4]
Историја
уредиФлавобелковините за првпат биле откриени во 1879 година, со одвојување на компонентите на кравјо млеко. Тие првично биле наречени лактохроми, поради нивното млечно потекло и нивната жолта боја.[5] Биле потребни 50 години за научната заедница да направи значителен напредок во идентификацијата на пигментните молекули одговорни за жолтата боја. Дури во 1930-тите години се интензивирале истражувањата на полето на коензимите, кога биле објавени структурите на флавинските и никотинамидските деривати и била разбрана нивната главна улога во катализата на биолошките редокс реакции. Во 1932 година, германските научници Ото Варбург и Валтер Кристијан откриле жолто обоена белковина во квасец, за кој се покажало дека е неопходен за клеточната респирација. Нивниот колега, Хуго Теорел, успеал да го раздели овој жолт ензим на безбоен апоензим и жолт пигмент, и покажал дека ниту апоензимот ниту пигментот не се способни самостојно да го оксидираат NADH, но кога ќе се врзат повторно заедно активноста се обновува. Во 1937 година, Теорел потврдил дека пигментот е фосфатен естер на рибофлавинот, флавин мононуклеотид (FMN), што претставувал прв директен доказ за постоењето на ензимски кофактори.[6] Потоа, во 1938 година, Варбург и Кристијан експериментално пронашле дека FAD е кофактор на оксидазата на D-аминокиселини.[7] Работата на Ото Варбург во поврзувањето на никотинамидот со хидридниот трансфер и откривањето на флавините го отвори патот за многу научници во 1940-тите и 1950-тите години да откријат голем број на редокс биохемиски процеси и да ги поврзат во поголеми метаболни патишта, како што се циклусот на лимонската киселина и синтезата на ATP.
Својства
уредиФлавин аденин динуклеотид се состои од два главни дела: аденински нуклеотид (аденозин монофосфат) и флавински мононуклеотид, врзани преку нивните фосфатни групи. Аденинот е врзан за циклична рибоза на 1’C-атомот, додека фосфатот е врзан за рибозата на 5’C-атомот за да го формира аденинскиот нуклеотид. Рибофлавинот се состои од C-N врска помеѓу изоалоксазин и рибитол. Потоа фосфатната група се врзува за терминалниот C-атом на рибозата, за да формира FMN. Бидејќи врската помеѓу изоалоксазин и рибитолот не е гликозидна врска, флавин мононуклеотидот не е вистински нуклеотид. Затоа името „динуклеотид“ е погрешно; сепак флавин мононуклеотидната група е многу слична на групата кај нуклеотидот во однос на нејзината структура и хемиски својства.
FAD може да се редуцира во FADH2 со примање на 2H+ и 2е-. FADH2, пак, може да се оксидира со губење на 1H+ и 1е- во FADH, а потоа, со дополнително губење на 1H+ и 1е-, да се оксидира во FAD. Формирањето на FAD може да се случи и преку редукција и дехидратација на флавин-N(5)-оксид.[8] Во воден раствор, флавините добиваат специфични бои во зависност од нивната оксидациона состојба: флавин-N(5)-оксидот (супероксидирана форма) е жолто-портокалов, FAD (целосно оксидирана форма) е жолт, FADH (полуредуцирана форма) е син или црвен во зависност од pH вредноста на растворот, а FADH2 (целосно редуцирана форма) е безбоен.[3][9] Промената на оксидационата состојба на флавините може да има големо влијание и на другите хемиски својства. На пример, FAD, целосно оксидираната форма, може да биде цел на нуклеофилен напад, FADH2, целосно редуцираната форма, има висока поларизација, додека полуредуцираната форма, FADH, е нестабилна во воден раствор.[10] FAD е ароматичен хетероцикличен прстен, додека FADH2 не е; ова значи дека FADH2 е на повисоко енергетско ниво од FAD, бидејќи кај него недостасува стабилизацијата преку резонанца, која се среќава во ароматичната структура. Затоа, FADH2 е молекула-носител на енергија, која, откако ќе се оксидира и ќе ја поврати ароматичноста, ја ослободува таа енергија во околината како резултат на преминот од помалку стабилна во постабилна состојба.
Спектроскопските својства на FAD и неговите варијанти овозможуваат следење на реакцијата со употреба на UV-VIS апсорпциона спектроскопија и флуоресцентна спектроскопија. Секоја од различните форми на FAD имаат различни апсорпциони спектри, што овозможува лесно следење на промените во оксидационата состојба.[10] Главниот локален апсорпционен максимум на FAD е на 450 нанометри, со вредност на коефициентот на изумирање од 11,300.[11] Кога не се врзани за белковина, флавините покажуваат флуоресцентна активност. Оваа особина се користи за испитување на врзувањето за белковини, имено губитокот на флуоресцентната активност означува дека флавинот се наоѓа во врзана состојба.[10] Оксидираните флавини имаат високи апсорбанци на околу 450 нанометри бранова должина, а флуоресцираат на околу 515-520 нанометри.[9]
Хемиски својства
уредиВо биолошките системи, FAD во својата целосно оксидирана состојба дејствува како акцептор на хидридни јони (H-) и електрони (е-), како акцептор или дарител во FADH формата и како дарител во целосно редуцираната форма FADH2. Дијаграмот подолу ги сумира потенцијалните промени на кои може да подлегне молекулата на FAD.
Освен формите кои се прикажани погоре, може да се формираат и други реактивни форми на FAD. Овие реакции вклучуваат пренос на електрони и формирање/раскинување на хемиски врски. Преку овие различни реакциони механизми, FAD е способен да придонесе за хемиските активности во биолошките системи.
Механизмите 1 и 2 прикажани на сликите подолу, претставуваат пренос на хидриден јон (еден протон и два електрона) на молекулата на FAD. Механизмите 3 и 4 претставуваат создавање на радикал и губиток на хидрид. Радикалите содржат атоми со неспарен електрон и хемиски се многу реактивни. Механизмите 5 и 6 претставуваат нуклеофилна адиција и реакција во која учествува јаглероден радикал.
Биосинтеза
уредиFAD има важна улога како ензимски кофактор, заедно со флавин мононуклеотид (FMN), кој е друг дериват на рибофлавинот.[8] Бактериите, габите и растенијата самите можат да го синтетизираат рибофлавинот, но другите еукариоти, вклучувајќи го и човекот, ја изгубиле таа способност во текот на еволуцијата.[9] Затоа организмите кои не можат самите да го синтетизираат мораат да го внесуваат со исхраната како витамин Б2.[12] Рибофлавинот главно се апсорбира во тенкото црево, а потоа се транспортира до клетките каде е потребен, со посебни носачки белковини.[9] Рибофлавин киназата (ЕС 2.7 јануари 26) додава фосфатна група на рибофлавинот за да се добие флавин мононуклеотид, а потоа FAD синтетазата додава аденински нуклеотид за да се добие FAD. И за двата од овие биохемиски чекори потребна е молекула на АТР.[9] Бактериите обично имаат еден двофункционален ензим, додека археите и еукариотите обично имаат два различни ензими.[9] Најновите истражувања покажале дека постојат различни изоформи на овие ензими во цитозолот и митохондриите.[9] Се чини дека FAD се синтетизира и во двете места, а потоа се транспортира таму каде што е потребен.[10]
Функција
уредиФлавобелковините ја користат уникатната и разновидна структура на флавинските кофактори за катализирање на тешки редокс реакции. Бидејќи флавините имаат повеќе редокс состојби, тие можат да учествуваат во процеси кои вклучуваат пренос на еден или два електрона, на водородни атоми или хидрониумови јони. N5 и C4a атомите од целосно оксидираниот флавински прстен се подложни на нуклеофилен напад.[6] Големиот вариетет на јонизација и модификација на флавинскиот кофактор може да се припише на системот на изоалоксазинскиот прстен и способноста на флавобелковините драстично да ги променат кинетичките параметри на флавините по врзување, вклучувајќи го и флавин аденин динуклеотидот (FAD).
Бројот на гените кои кодираат флавин-врзувачки белковини во геномот (флавопротеом) зависи од видот, а може да варира од 0.1 - 3.5 % (човекот, на пример, има 90 гени кои кодираат за флавобелковини).[13] FAD е почестата и покомплексна форма на флавин, а се проценува дека околу 75% од сите флавобелковини врзуваат FAD,[13] а кај човекот таа вредност е 84%.[14] Клеточните концентрации на слободните или нековалентно врзаните флавини кај различни култивирани клеточни линии на цицачи биле измерени за FAD (2.2 – 17.0 amol/клетка) и за FMN (0.46 – 3.4 amol/клетка).[15]
FAD има попозитивен редукционен потенцијал од NAD+ и е многу јак оксидирачки агенс. Клетката ја искористува оваа особина на FAD во многу енергетски тешки реакции на оксидација, како што е дехидрогенација на C-C врската до алкен. FAD-зависните белковини функционираат во голем број на метаболни патишта, вклучувајќи ги транспортот на електрони, поправка на оштетена ДНК, биосинтеза на нуклеотиди, бета-оксидација на масни киселини, катаболизам на аминокиселини, синтеза на кофактори како што е коензим А, коензим Q и хем. Сукцинат дехидрогеназата (комплекс II во ланецот за транспорт на електрони) бара ковалентно врзан FAD за да ја катализира оксидацијата на сукцинат во фумарат, спарувајќи ја со редукцијата на убихинон во убихинол.[10] Високоенергетските електрони од оваа реакција привремено се складираат во FAD, на тој начин што тој се редуцира во FADH2. FADH2 потоа повторно се оксидира во FAD со тоа што ги испушта двата високоенергетски електрони во ланецот за транспорт на електрони; енергијата во FADH2 е доволна за продукција на 1.5 еквиваленти на АТР по пат на оксидативна фосфорилација.[16] Постојат и редокс флавобелковини кои нековалентно врзуваат FAD, како што се ацетил-коензим А дехидрогеназите, кои се вклучени во бета-оксидацијата на масните киселини и катаболизмот на аминокиселини како леуцин (изовалерил-КоА дехидрогеназа), изолеуцин (кратка/разгранет ланец ацил-КоА дехидрогеназа), валин (изобутирил-КоА дехидрогеназа) и лизин (глутарил-КоА дехидрогеназа).[17] Дополнителни примери за FAD-зависни ензими кои го регулираат метаболизмот се: глицерол-3-фосфат дехидрогеназа (синтеза на триглицериди) и ксантин оксидазата (катаболизам на пурински нуклеотиди). FAD може да има и некаталитички функции кај некои флавобелковини, како што се структурни улоги, како фотон-апсорбирачки хромофор во фоторецептори осетливи на сина светлина кои ги регулираат биолошките часовници и развојот, или како емитер на светлина кај биолуминисцентни бактерии.[17]
Флавобелковини
уредиФлавобелковините имаат или FMN или FAD како простетична група, која може да биде ковалентно врзана или врзана со силни нековалентни врски. Само околу 5 – 10% од флавобелковините имаат ковалентно врзана FAD група и тие имаат поголема редокс моќност.[10] Во некои случаи, FAD може да обезбеди структурна поддршка за активни места или да обезбеди стабилизација на меѓупроизводи во тек на биохемиска реакција.[17] Врз основа на достапните структурни податоци, сите познати врзувачки места за FAD можат да се поделат на повеќе од 200 типови.[18]
Има 90 флавобелковини во човечкиот геном; околу 84% од нив врзуваат FAD, а околу 16% врзуваат FMN, додека 5 белковини ги врзуваат и двата кофактора.[14] Флавобелковините главно се наоѓаат во митохондриите, каде највеќе се застапени редокс процесите. Од сите флавобелковини, 90% учествуваат во редокс реакции, а останатите 10% се трансферази, лиази, изомерази и лигази.[13]
Оксидација на хемиска врска меѓу јаглерод и хетероатом
уредиЈаглерод-азот
уредиМоноамин оксидазата (МАО) е екстензивно проучуван флавоензим поради неговата биолошка улога во катаболизмот на норепинефрин, серотонин и допамин. МАО оксидира првични, вторични и третични амини, кои неезиматски хидролизираат од имин до алдехид или кетон. Иако овој ензим бил екстензивно проучуван, неговиот механизам на делување сѐ уште е тема на дебата. Предложени се два механизма: механизам со радикал и нуклеофилен механизам. Механизмот со радикал е помалку прифатен, бидејќи сѐ уште не постојат спектрални докази или докази од електронска парамагнетна резонанца кои го покажуваат присуството на радикал како меѓупроизвод во реакцијата. Нуклеофилниот механизам е повеќе фаворизиран бидејќи е поддржан од истражувања со насочена мутагенеза, при кои биле мутирани два тирозински остатоци, за кои се очекувало да ја зголемат нуклеофилноста на супстратите.[19]
Јаглерод-кислород
уредиГликоза оксидазата (GOX) ја катализира оксидацијата на β-D-гликозата во D-гликоно-δ-лактон со истовремена редукција на флавинот врзан за ензимот. GOX е хомодимерна белковина, при што секоја подединица врзува по една FAD молекула. Кристалните структури покажуваат дека FAD се врзува во длабок жлеб на ензимот, во близина на допирната површина меѓу двата димери. Истражувањата покажале дека по замена на FAD со 8-хидрокси-5-карба-5-деаза FAD, стереохемијата на реакцијата можно е да се утврди. Биле забележани и неутралните и анјонските полухинони во тек на реакцијата, што укажува на механизам со радикал.[19]
Јаглерод-сулфур
уредиПренилцистеин лиазата (ПЦЛаза) е ензим кој го катализира раскинувањето на пренилцистеин (белковинска модификација) за да се формира изопреноиден алдехид и слободен цистеински остаток на белковината. FAD е нековалентно врзан во ПЦЛазата. Не се направени многу механистички студии за испитување на реакциите на флавинот, а предложениот механизам е прикажан подолу. Се претпоставува дека се одвива пренос на хидриден јон од С1 на пренилот на FAD, што резултира со негова редукција во FADН2 и формирање на карбокатјон кој е стабилизиран од соседниот сулфурен атом. FADН2 потоа реагира со молекуларен кислород за да се обнови оксидираниот ензим.[19]
Јаглерод-јаглерод
уредиUDP-N-ацетиленолпирувилгликозамин редуктаза (MurB) е ензим кој ја катализира NADPH-зависната редукција на енолпирувил-UDP-N-ацетил-гликозамин (супстрат) во соодветното D-лактил соединение UDP-N-ацетил-мураминска киселина (производ). MurB е мономер кој содржи една FAD молекула. Пред да може супстратот да се претвори во производ, FAD прво мора да биде редуциран од NADPH. Штом NADP+ дисоцира од ензимот, супстратот може да се врзе и да биде редуциран од редуцираниот FAD.[19]
Тиолна и дисулфидна хемија
уредиГлутатион редуктазата (GR) ја катализира редукцијата на глутатион дисулфидот (GSSG) во глутатион (GSН). На овој ензим му се потребни и FAD и NADPH за катализирање на реакцијата, така што најпрво мора да се трансферира хидрид од NADPH на FAD. Редуцираниот флавин потоа може да дејствува како нуклеофил за да го нападне дисулфидот, со што се формира С4а-цистеински адукт. Елиминацијата на овој адукт резултира со флавин-тиолатен комплекс за пренос на полнеж.[19]
Реакции на пренос на електрони
уредиРедуктазата на микросомалните Р450 системи, цитохром Р450 редуктаза (CPR), содржи и FAD и FMN кофактори. Електроните се пренесуваат од NADPH на FAD кофакторот на CPR, потоа на FMN кофакторот и, конечно, на хем кофакторот на цитохромите Р-450. Во редуктивните титрации, FAD и FMN можат да постојат како неутрални полухинони. Флавините се оддалечени само околу 4 ангстреми, што укажува на тоа дека трансферот на електрони е директен меѓу нив.[19]
Редуктазата на митохондријалните Р450 системи, адренодоксин редуктаза, содржи FAD кофактор кој е сместен во FAD-врзувачкиот домен на ензимот.[20] Ензимот исто така врзува NADPH во NADP-врзувачкиот домен. Структурата на овој ензим е високо сочувана за да се одржи точната позиција на дарителот на електрони NADPH и акцепторот на електрони FAD, за ефикасно пренесување на електроните од едниот на другиот.[20]
Структурите на редуктазата на микросомалниот систем и редуктазата на Р450 системите се сосема различни меѓусебе и не покажуваат никаква хомологија.[21]
Редокс реакции
уредиp-Хидроксибензоат хидроксилазата (РНВН) ја катализира оксигенацијата на p-хидроксибензоат (pOHB) во 3,4-дихидроксибензоат (3,4-diOHB); FAD и NADPH и молекуларен кислород се потребни за оваа реакција. Прво NADPH трансферира хидриден еквивалент на FAD, со што се добива FADН-, а потоа NADP+ дисоцира од ензимот. Редуцираниот РНВН потоа реагира со молекуларен кислород за да формира флавин-С(4а)-хидропероксид. Флавин хидропероксидот брзо го хидроксилира pOHB, а потоа ја елиминира водата за регенерирање на оксидираниот флавин.[19] Алтернативен механизам на оксигенација, посредуван од флавин, вклучува употреба на флавин-N(5)-оксид наместо флавин-С(4а)-(хидро)пероксид.[3][4]
Реакции кои не се редокс
уредиХоризмат синтазата (CS) го катализира последниот чекор од патот на шикими киселината – формирањето на хоризмат. Постојат две класи на CS, кои и двете имаат потреба од FMN, но се поделени според нивната потреба на NADPH како редуцирачки агенс. Предложениот механизам за дејството на CS вклучува радикали. Флавинскиот радикал не е забележан спектроскопски без употреба на супстратен аналог, што укажува на тоа дека е краткотраен. Меѓутоа, кога се користи флуориран супстрат, се детектира присуство на неутрален флавински полухинон.[19]
Комплексни флавоензими
уредиГлутамат синтазата ја катализира претворањето на 2-оксоглутарат во L-глутамат, со L-глутамин како извор на азот во реакцијата. Сите глутамат синтази се флавобелковини кои содржат железо-сулфурен кластер и FMN. Трите класи на глутамат синтази се категоризирани врз основа на нивните низи и биохемиски својства. Иако постојат три класи на овој ензим, се верува дека сите функционираат преку истиот механизам, а се разликуваат само по тоа која молекула прва го редуцира FMN. Ензимот создава две молекули на глутамат: едната со хидролизa на глутамин (при што се добива глутамат и амонијак), а другата од амонијакот создаден при првата реакција, кој го напаѓа 2-оксоглутаратот, кој се редуцира до глутамат од страна на FMN.[19]
Дополнителни слики
уреди-
Рибофлавин (витамин Б2)
-
Флавин мононуклеотид (FMN)
-
FADH2
Поврзано
уредиНаводи
уреди- ↑ Nelson, David L.; Cox, Michael M. (2017-01-01). Lehninger Principles of Biochemistry (англиски) (Seventh. изд.). New York NY: W. H. Freeman. стр. 312f, 525–526, 526f, 712–714, 716t. ISBN 9781464126116.CS1-одржување: датум и година (link)
- ↑ Teufel, Robin; Agarwal, Vinayak; Moore, Bradley S. (4 2016). „Unusual flavoenzyme catalysis in marine bacteria“. Current Opinion in Chemical Biology. 31: 31–39. doi:10.1016/j.cbpa.2016 јануари 001 Проверете ја вредноста
|doi=(help). ISSN 1879-0402. PMC 4870101. PMID 26803009. Проверете ги датумските вредности во:|date=(help)CS1-одржување: PMC-формат (link) - ↑ 3,0 3,1 3,2 Teufel, Robin; Miyanaga, Akimasa; Michaudel, Quentin; Stull, Frederick; Louie, Gordon; Noel, Joseph P.; Baran, Phil S.; Palfey, Bruce; Moore, Bradley S. (2013-11-28). „Flavin-mediated dual oxidation controls an enzymatic Favorskii-type rearrangement“. Nature. 503 (7477): 552–556. doi:10.1038/nature12643. ISSN 1476-4687. PMC 3844076. PMID 24162851.CS1-одржување: PMC-формат (link)
- ↑ 4,0 4,1 Teufel, Robin; Stull, Frederick; Meehan, Michael J.; Michaudel, Quentin; Dorrestein, Pieter C.; Palfey, Bruce; Moore, Bradley S. (2015-07-01). „Biochemical Establishment and Characterization of EncM's Flavin-N5-oxide Cofactor“. Journal of the American Chemical Society. 137 (25): 8078–8085. doi:10.1021/jacs.5b03983. ISSN 1520-5126. PMC 4720136. PMID 26067765.CS1-одржување: PMC-формат (link)
- ↑ Abbas, Charles A.; Sibirny, Andriy A. (2011-6). „Genetic control of biosynthesis and transport of riboflavin and flavin nucleotides and construction of robust biotechnological producers“. Microbiology and molecular biology reviews: MMBR. 75 (2): 321–360. doi:10.1128/MMBR.00030-10. ISSN 1098-5557. PMC 3122625. PMID 21646432. Проверете ги датумските вредности во:
|date=(help)CS1-одржување: PMC-формат (link) - ↑ 6,0 6,1 Hayashi, Hideyuki; Do, Bernard; Ahm, M. H.; Bettendorff, Lucien; Shibata, K.; Fukuwatari, T.; Lildballe, Dorla L.; Yagi, T.; Rychlik, Micheal (2012-10-23). Preedy, Victor R. (уред.). B Vitamins and Folate: Chemistry, Analysis, Function and Effects (англиски) (2. изд.). Cambridge: Royal Society of Chemistry. ISBN 9781849733694.
- ↑ Warburg, O; Christian, W (1938). „Isolierung der prosthetischen Gruppe der d-Aminosaureoxydase“. Biochemische Zeitschrift. 298: 150–168.
- ↑ 8,0 8,1 „Textbook of Biochemistry with Clinical Correlations, 7th“. Wiley.com (англиски). 2010-01-19. Посетено на 2018-08-27.
- ↑ 9,0 9,1 9,2 9,3 9,4 9,5 9,6 Barile, Maria; Giancaspero, Teresa Anna; Brizio, Carmen; Panebianco, Concetta; Indiveri, Cesare; Galluccio, Michele; Vergani, Lodovica; Eberini, Ivano; Gianazza, Elisabetta (2013). „Biosynthesis of flavin cofactors in man: implications in health and disease“. Current Pharmaceutical Design. 19 (14): 2649–2675. ISSN 1873-4286. PMID 23116402.
- ↑ 10,0 10,1 10,2 10,3 10,4 10,5 Kim, Hyung J.; Winge, Dennis R. (2013-5). „Emerging concepts in the flavinylation of succinate dehydrogenase“. Biochimica Et Biophysica Acta. 1827 (5): 627–636. doi:10.1016/j.bbabio.2013 јануари 012 Проверете ја вредноста
|doi=(help). ISSN 0006-3002. PMC 3626088. PMID 23380393. Проверете ги датумските вредности во:|date=(help)CS1-одржување: PMC-формат (link) - ↑ Lewis, Jeffrey A.; Escalante-Semerena, Jorge C. (2006-8). „The FAD-dependent tricarballylate dehydrogenase (TcuA) enzyme of Salmonella enterica converts tricarballylate into cis-aconitate“. Journal of Bacteriology. 188 (15): 5479–5486. doi:10.1128/JB.00514-06. ISSN 0021-9193. PMC 1540016. PMID 16855237. Проверете ги датумските вредности во:
|date=(help)CS1-одржување: PMC-формат (link) - ↑ Kuppuraj, Gopi; Kruise, Dennis; Yura, Kei (2014-11-26). „Conformational behavior of flavin adenine dinucleotide: conserved stereochemistry in bound and free states“. The Journal of Physical Chemistry. B. 118 (47): 13486–13497. doi:10.1021/jp507629n. ISSN 1520-5207. PMID 25389798.
- ↑ 13,0 13,1 13,2 Macheroux, Peter; Kappes, Barbara; Ealick, Steven E. (2011-8). „Flavogenomics--a genomic and structural view of flavin-dependent proteins“. The FEBS journal. 278 (15): 2625–2634. doi:10.1111/j.1742-4658.2011.08202.x. ISSN 1742-4658. PMID 21635694. Проверете ги датумските вредности во:
|date=(help) - ↑ 14,0 14,1 Lienhart, Wolf-Dieter; Gudipati, Venugopal; Macheroux, Peter (2013-07-15). „The human flavoproteome“. Archives of Biochemistry and Biophysics. 535 (2): 150–162. doi:10.1016/j.abb.2013 февруари 015 Проверете ја вредноста
|doi=(help). ISSN 1096-0384. PMC 3684772. PMID 23500531.CS1-одржување: PMC-формат (link) - ↑ Hühner, Jens; Ingles-Prieto, Álvaro; Neusüß, Christian; Lämmerhofer, Michael; Janovjak, Harald (2015-2). „Quantification of riboflavin, flavin mononucleotide, and flavin adenine dinucleotide in mammalian model cells by CE with LED-induced fluorescence detection“. Electrophoresis. 36 (4): 518–525. doi:10.1002/elps.201400451. ISSN 1522-2683. PMID 25488801. Проверете ги датумските вредности во:
|date=(help) - ↑ Jeremy M. Berg, John L. Tymoczko, Lubert Stryer (2011-04-01). Biochemistry (англиски) (7. изд.). New York, NY: Palgrave MacMillan. ISBN 9781429276351.CS1-одржување: повеќе имиња: список на автори (link) CS1-одржување: датум и година (link)
- ↑ 17,0 17,1 17,2 Mansoorabadi, Steven O.; Thibodeaux, Christopher J.; Liu, Hung-wen (2007-08-17). „The diverse roles of flavin coenzymes--nature's most versatile thespians“. The Journal of Organic Chemistry. 72 (17): 6329–6342. doi:10.1021/jo0703092. ISSN 0022-3263. PMC 2519020. PMID 17580897.CS1-одржување: PMC-формат (link)
- ↑ Garma, Leonardo D.; Medina, Milagros; Juffer, André H. (2016-09-16). „Structure-based classification of FAD binding sites: A comparative study of structural alignment tools“. Proteins: Structure, Function, and Bioinformatics (англиски). 84 (11): 1728–1747. doi:10.1002/prot.25158. ISSN 0887-3585.
- ↑ 19,0 19,1 19,2 19,3 19,4 19,5 19,6 19,7 19,8 Mander, Lewis; Liu, Hung-Wen, уред. (2010-05-20). Comprehensive Natural Products II: Chemistry and Biology (англиски) (1. изд.). Amsterdam: Elsevier Science. ISBN 9780080453811.
- ↑ 20,0 20,1 Hanukoglu, Israel (2017). „Conservation of the Enzyme-Coenzyme Interfaces in FAD and NADP Binding Adrenodoxin Reductase-A Ubiquitous Enzyme“. Journal of Molecular Evolution. 85 (5–6): 205–218. doi:10.1007/s00239-017-9821-9. ISSN 1432-1432. PMID 29177972.
- ↑ „Electron Transfer Proteins of Cytochrome P450 Systems“. Advances in Molecular and Cell Biology (англиски). 14: 29–56. 1996-01-01. doi:10.1016/S1569-2558(08)60339-2. ISSN 1569-2558.
Надворешни врски
уреди- FAD врзан за белковини на Protein Data Bank (PDB) (англиски)
- FAD на NIH базата на податоци за хемија (англиски)