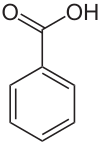
Бензоева киселина
Бензоева киселина — бело (или безбојно) цврсто органско соединение со формула C
6H
5COOH, чија структура се состои од бензенски прстен (C
6H
6)со карбоксилна група (–C(=O)OH) како супституент. Бензоилната група често се пишува скратено како „Bz“ (да не се меша со „Bn“ што се користи за бензил), така што бензоевата киселина се означува и како BzOH, бидејќи бензоил групата ја има формулата C
6H
5CO. Таа е наједноставната ароматична карбоксилна киселина. Името е изведено од гумата бензоин, која долго време беше нејзиниот единствен извор.
| |||

| |||
| Систематско име | Бензенкарбоксилна киселина | ||
Други називи
| |||
| Назнаки | |||
|---|---|---|---|
| 65-85-0 | |||
| 3DMet | B00053 | ||
| Бајлштајн | 636131 | ||
| ChEBI | CHEBI:30746 | ||
| ChEMBL | ChEMBL541 | ||
| ChemSpider | 238 | ||
| DrugBank | DB03793 | ||
| EC-број | 200-618-2 | ||
| 2946 | |||
| |||
| 3Д-модел (Jmol) | Слика | ||
| KEGG | D00038 | ||
| MeSH | benzoic+acid | ||
| PubChem | 243 | ||
| RTECS-бр. | DG0875000 | ||
| |||
| UNII | 8SKN0B0MIM | ||
| Својства | |||
| Хемиска формула | |||
| Моларна маса | 0 g mol−1 | ||
| Изглед | Безбојна кристална цврста супстанца | ||
| Мирис | Слаб, пријатен мирис | ||
| Густина | 1.2659 g/cm3 (15 °C) 1.0749 g/cm3 (130 °C)[2] | ||
| Точка на топење | |||
| Точка на вриење | |||
| 1.7 g/L (0 °C) 2.7 g/L (18 °C) 3.44 g/L (25 °C) 5.51 g/L (40 °C) 21.45 g/L (75 °C) 56.31 g/L (100 °C)[2][3] | |||
| Растворливост | Растворлива во ацетон, бензен, CCl4, CHCl3, етанол, етил етер, хексан, фенили, течен амонијак, ацетати | ||
| Растворливост во метанол | 30 g/100 g (−18 °C) 32.1 g/100 g (−13 °C) 71.5 g/100 g (23 °C)[2] | ||
| Растворливост во етанол | 25.4 g/100 g (−18 °C) 47.1 g/100 g (15 °C) 52.4 g/100 g (19.2 °C) 55.9 g/100 g (23 °C)[2] | ||
| Растворливост во ацетон | 54.2 g/100 g (20 °C)[2] | ||
| Растворливост во маслиново масло | 4.22 g/100 g (25 °C)[2] | ||
| Растворливост во 1,4-диоксан | 55.3 g/100 g (25 °C)[2] | ||
| log P | 1.87 | ||
| Парен притисок | 0.16 Pa (25 °C) 0.19 kPa (100 °C) 22.6 kPa (200 °C)[4] | ||
| Киселост (pKa) | |||
| −70.28·10−6 cm3/mol | |||
| Показател на прекршување (nD) | 1.5397 (20 °C) 1.504 (132 °C)[2] | ||
| Вискозност | 1.26 mPa (130 °C) | ||
| Структура | |||
| Кристална структура | Моноклинична | ||
| Геометрија на молекулата | Планарна | ||
| Диполен момент | 1.72 D in диоксан | ||
| Термохемија | |||
| Ст. енталпија на образување ΔfH |
−385.2 kJ/mol[2] | ||
| Ст. енталпија на согорување ΔcH |
−3228 kJ/mol[4] | ||
| Стандардна моларна ентропија S |
167.6 J/mol·K[2] | ||
| Специфичен топлински капацитет, C | 146.7 J/mol·K[4] | ||
| Опасност | |||
| Безбедност при работа: | |||
Главни опасности
|
Раздразнувач | ||
| GHS-ознаки: | |||
Пиктограми
|
  [7] [7]
| ||
Сигнални зборови
|
Опасност | ||
Изјави за опасност
|
H318, H335[7] | ||
Изјави за претпазливост
|
P261, P280, P305+P351+P338[7] | ||
| NFPA 704 | |||
| Температура на запалување | 121.5 °C (250.7 °F; 394.6 K)[8] | ||
| 571 °C (1,060 °F; 844 K)[8] | |||
| Смртоносна доза или концентрација: | |||
LD50 (средна доза)
|
1700 mg/kg (стаорец, орално) | ||
| Безбедносен лист | JT Baker | ||
| Дополнителни податоци | |||
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |||
| Наводи | |||
Бензоевата киселина природно се јавува во многу растенија[9] и служи како посредник во биосинтезата на многу секундарни метаболити. Солите на бензоевата киселина се користат како конзерванси за храна. Бензоевата киселина е важен прекурсор за индустриската синтеза на многу други органски материи. Солите и естрите на бензоевата киселина се познати како бензоати. /ˈbɛnzoʊ.eɪt/.
Историја
уредиБензоевата киселина е откриена во шеснаесеттиот век. Сувата дестилација на бензоин гума првпат ја опишал Нострадамус (1556), а потоа Алексиус Педемонтанус (1560) и Блез де Вигенер (1596).[10]
Јустус фон Либиг и Фридрих Волер го утврдија составот на бензоевата киселина.[11] Тие исто така истражуваа како хипуричната киселина е поврзана со бензоевата киселина.
Во 1875 година Салковски ги открил противгабичните својства на бензоевата киселина, која долго време се користела за зачувување на плодовите кои содржат бензоат.[12]
Производство
уредиИндустриско производство
уредиБензоевата киселина комерцијално се произведува со делумна оксидација на толуен со кислород. Процесот се катализира со кобалт или манган нафтенати. Процесот користи изобилство на материјали и има висок принос.[13]
Првиот индустриски процес вклучува реакција на бензотрихлорид (трихлорометил бензен) со калциум хидроксид во вода, користејќи железо или железни соли како катализатор. Добиениот калциум бензоат се претвора во бензоева киселина со хлороводородна киселина. Производот содржи значителни количини на деривати на хлорирана бензоева киселина. Поради оваа причина, бензоевата киселина која се користи за човечка исхрана се добива со сува дестилација на бензоин гума. Бензоевата киселина со чистота за храна сега се произведува синтетички.
Лабораториска синтеза
уредиБензоевата киселина е евтина и лесно достапна, па затоа лабораториската синтеза на бензоевата киселина главно се практикува поради нејзината педагошка вредност. Тоа е вообичаена подготовка за додипломски студии.
Бензоевата киселина може да се прочисти со прекристализација во вода поради високата растворливост во топла вода и слабата растворливост во ладна вода. Избегнувањето на органски растворувачи за рекристализација го прави овој експеримент особено безбеден. Овој процес обично дава принос од околу 65%.[14]
Со хидролиза
уредиКако и другите нитрили и амиди, бензонитрилот и бензамидот може да се хидролизираат до бензоева киселина или нејзина конјугирана база во киселински или базни услови.
Од Grignard-ов реагенс
уредиБромобензенот може да се конвертира во бензоева киселина со „карбоксилација“ на интермедиерниот фенилмагнезиум бромид.[15] Оваа синтеза нуди пригодна вежба за студентите да спроведат Grignard-овa реакција, важeн тип на реакција на формирање јаглерод-јаглерод врска во органската хемија.[16][17][18][19][20]
Оксидација на бензилни соединенија
уредиБензил алкохолот[21] и бензил хлоридот и практично сите бензил деривати лесно се оксидираат до бензоева киселина
Употреба
уредиБензоевата киселина главно се троши во производството на фенол со оксидативна декарбоксилација на 300-400 °C:[22]
Потребната температура може да се намали на 200 °C со додавање на каталитички количини на бакар(II) соли. Фенолот може да се претвори во циклохексанол, кој е почетен материјал за синтеза на најлон.
Прекурсор на пластификатори
уредиБензоатните пластификатори, како што се гликол-, диетиленгликол- и триетиленгликол естрите, се добиваат со трансестерификација на метил бензоат со соодветниот диол.[22] Овие пластификатори, кои се користат слично на оние добиени од естер на терефтална киселина, претставуваат алтернативи на фталатите.[22]
Прекурсор на натриум бензоат и сродни конзерванси
уредиБензоевата киселина и нејзините соли се користат како конзерванси за храна, претставени со Е броевите E210, E211, E212 и E213. Бензоевата киселина го инхибира растот на мувлата, квасецот[23] и некои бактерии. Се додава директно или се создава при реакции на неговата натриумова, калиумова или калциумова сол. Механизмот започнува со апсорпција на бензоева киселина во клетката. Ако внатреклеточната pH вредност се промени на 5 или помала, анаеробната ферментација на гликозата преку фосфофруктокиназата се намалува за 95%. Според тоа, ефикасноста на бензоевата киселина и бензоатот зависи од pH вредноста на храната.[24] Бензоевата киселина, бензоатите и нивните деривати се користат како конзерванси за кисела храна и пијалоци како што се цитрусните сокови (лимонска киселина), газирани пијалоци (јаглерод диоксид), безалкохолни пијалоци (фосфорна киселина), кисели краставички (оцетна киселина) и друга закиселена храна.
Типичните концентрации на бензоева киселина како конзерванс во храната се помеѓу 0,05 и 0,1%. Храната во која може да се користи бензоева киселина и максималните нивоа за нејзина примена се контролирани со локалните закони за храна.[25][26]
Изразена е загриженост дека бензоевата киселина и нејзините соли може да реагираат со аскорбинска киселина (витамин Ц) во некои безалкохолни пијалоци, формирајќи мали количини на канцероген бензен.[27]
Медицинска
уредиБензоевата киселина е составен дел на Whitfield-овата маст која се користи за третман на габични заболувања на кожата како што се рингворм и спортско стапало.[28][29] Како главна компонента на бензоин гумата, бензоевата киселина е исто така главна состојка и во тинктурата од бензоин и во балсамот на Friar. Таквите производи имаат долга историја на употреба како локални антисептици и деконгестиви за инхалација.
Бензоевата киселина била користена како експекторанс, аналгетик и антисептик на почетокот на 20 век[30]
Лабораториски употреби
уредиВо наставните лаборатории, бензоевата киселина е вообичаен стандард за калибрирање на калориметриска бомба.[31]
Биологија и здравствени ефекти
уредиБензоевата киселина се јавува природно како и нејзините естри кај многу растителни и животински видови. Значителни количини се наоѓаат во повеќето бобинки (околу 0,05%). Зрелите плодови од неколку видови Vaccinium (на пример, брусница, V. vitis macrocarpon ; боровинка, V. myrtillus ) содржат дури 0,03-0,13% слободна бензоева киселина. Бензоевата киселина се формира и во јаболката по инфекцијата со габата Nectria galligena . Помеѓу животните, бензоевата киселина е идентификувана првенствено кај сештојади или фитофаги видови, на пр., во внатрешните органи и мускулите на еребица камењарка (Lagopus muta ), како и во секретите на жлездите на машкото мошусно говедо (Ovibos moschatus ) или азиските слонови (Elephas maximus ).[32] Бензоин гумата содржи до 20% бензоева киселина и 40% естри на бензоева киселина.[33]
Во однос на неговата биосинтеза, бензоатот во растенијата се произведува од циметната киселина.[34] Идентификуван е синтетски пат на фенол преку 4-хидроксибензоат.[35]
Реакции
уредиРеакциите на бензоевата киселина може да се појават или кај ароматичниот прстен или кај карбоксилната група.
Ароматичен прстен
уредиЕлектрофилната ароматична супституциона реакција се одвива главно во позиција 3 поради карбоксилната група која што влече електрони; т.е. бензоевата киселина е мета-насочувачка.[36]
Карбоксилна група
уреди• Реакциите типични за карбоксилните киселини се однесуваат и на бензоевата киселина.[22]
- Бензоатните естри се производ на кисело катализирана реакција со алкохоли.
- Амидите на бензоевата киселина обично се подготвуваат од бензоил хлорид.
- Дехидратацијата до бензоев анхидрид е индуцирана со оцетен анхидрид или фосфор пентооксид.
- Високо реактивни киселински деривати како што се киселинските халиди лесно се добиваат со мешање со средства за халогенирање како фосфор хлориди или тионил хлорид.
- Ортоестрите може да се добијат со реакција на алкохоли во услови на одсуство на закиселена вода со бензонитрил.
- Редукција до бензалдехид и бензил алкохол е можно со користење на DIBAL-H, LiAlH4 или натриум борхидрид.
- Декарбоксилацијата на бензен може да се изврши со загревање во кинолин во присуство на бакарни соли. Hunsdiecker декарбоксилацијата може да се постигне со загревање на сребрена сол.
Безбедност и метаболизам кај цицачите
уредиСе излачува како хипурина киселина.[37] Бензоевата киселина се метаболизира со бутират-CoA лигаза во интермедиерен производ, бензоил-CoA,[38] кој потоа се метаболизира со глицин '' N '' -ацилтрансфераза во хипурина киселина.[39] Луѓето го метаболизираат толуенот кој исто така се излачува како хипурина киселина.[40]
За луѓето, Меѓународната програма за хемиска безбедност на Светската здравствена организација (IPCS) сугерира дека привремениот толерантен внес би бил 5 mg/kg телесна маса на ден.[32] Мачките имаат значително помала толеранција на бензоева киселина и нејзините соли од стаорците и глувците. Смртоносната доза за мачки може да биде до 300 mg/kg телесна маса.[41] Оралниот LD50 за стаорци е 3040 mg/kg, за глувците е 1940–2263 mg/kg.[32]
Во Тајпеј, Тајван, една градска здравствена анкета во 2010 година покажа дека 30% од сушената и киселата храна имаат бензоева киселина.[42]
Наводи
уреди- ↑ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. стр. 745. doi:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 „benzoic acid“. chemister.ru. Архивирано од изворникот на 2014-05-23. Посетено на 24 October 2018.
- ↑ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand.
- ↑ 4,0 4,1 4,2 Benzoic acid in Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD) (посетено на 2014-05-23)
- ↑ Harris, Daniel (2010). Quantitative Chemical Analysis (8. изд.). New York: W. H. Freeman and Company. стр. AP12. ISBN 9781429254366.
- ↑ Olmstead, William N.; Bordwell, Frederick G. (1980). „Ion-pair association constants in dimethyl sulfoxide“. The Journal of Organic Chemistry. 45 (16): 3299–3305. doi:10.1021/jo01304a033.
- ↑ 7,0 7,1 7,2 Sigma-Aldrich Co., Benzoic acid. Посетено на 2014-05-23.
- ↑ 8,0 8,1 Грешка во наводот: Погрешна ознака
<ref>; нема зададено текст за наводите по имеGESTIS. - ↑ „Scientists uncover last steps for benzoic acid creation in plants“. Purdue Agriculture News. Архивирано од изворникот на 2021-01-25. Посетено на 2023-02-18.
- ↑ Neumüller O-A (1988). Römpps Chemie-Lexikon (6. изд.). Stuttgart: Frankh'sche Verlagshandlung. ISBN 978-3-440-04516-9. OCLC 50969944.
- ↑ Liebig J; Wöhler F (1832). „Untersuchungen über das Radikal der Benzoesäure“. Annalen der Chemie. 3 (3): 249–282. doi:10.1002/jlac.18320030302. hdl:2027/hvd.hxdg3f.
- ↑ Salkowski E (1875). Berl Klin Wochenschr. 12: 297–298. Отсутно или празно
|title=(help) - ↑ Wade, Leroy G. (2014). Organic Chemistry (Pearson new international. изд.). Harlow: Pearson Education Limited. стр. 985. ISBN 978-1-292-02165-2.
- ↑ D. D. Perrin; W. L. F. Armarego (1988). Purification of Laboratory Chemicals (3. изд.). Pergamon Press. стр. 94. ISBN 978-0-08-034715-8.
- ↑ Donald L. Pavia (2004). Introduction to Organic Laboratory Techniques: A Small Scale Approach. Thomson Brooks/Cole. стр. 312–314. ISBN 978-0-534-40833-6.
- ↑ Shirley, D. A. (1954). „The Synthesis of Ketones from Acid Halides and Organometallic Compounds of Magnesium, Zinc, and Cadmium“. Org. React. 8: 28–58.
- ↑ Huryn, D. M. (1991). „Carbanions of Alkali and Alkaline Earth Cations: (ii) Selectivity of Carbonyl Addition Reactions“. Во Trost, B. M.; Fleming, I. (уред.). Comprehensive Organic Synthesis, Volume 1: Additions to C—X π-Bonds, Part 1. Elsevier Science. стр. 49–75. doi:10.1016/B978-0-08-052349-1.00002-0. ISBN 978-0-08-052349-1.
- ↑ „The Grignard Reaction. Preparation of Benzoic Acid“ (PDF). Portland Community College. Архивирано од изворникот (PDF) на 26 February 2015. Посетено на 2015-03-12.>
- ↑ „Experiment 9: Synthesis of Benzoic Acid via Carbonylation of a Grignard Reagent“ (PDF). University of Wisconsin-Madison. Архивирано од изворникот (PDF) на 23 September 2015. Посетено на 12 March 2015.
- ↑ „Experiment 3: Preparation of Benzoic Acid“ (PDF). Towson University. Архивирано од изворникот (PDF) на 13 април 2015. Посетено на 12 март 2015.>
- ↑ Santonastaso, Marco; Freakley, Simon J.; Miedziak, Peter J.; Brett, Gemma L.; Edwards, Jennifer K.; Hutchings, Graham J. (2014-11-21). „Oxidation of Benzyl Alcohol using in Situ Generated Hydrogen Peroxide“. Organic Process Research & Development. 18 (11): 1455–1460. doi:10.1021/op500195e. ISSN 1083-6160.
- ↑ 22,0 22,1 22,2 22,3 Maki, Takao; Takeda, Kazuo (2000), Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a03_555.
- ↑ A D Warth (1 December 1991). „Mechanism of action of benzoic acid on Zygosaccharomyces bailii: effects on glycolytic metabolite levels, energy production, and intracellular pH“. Appl Environ Microbiol. 57 (12): 3410–4. Bibcode:1991ApEnM..57.3410W. doi:10.1128/AEM.57.12.3410-3414.1991. PMC 183988. PMID 1785916.
- ↑ Pastrorova I, de Koster CG, Boom JJ (1997). „Analytic Study of Free and Ester Bound Benzoic and Cinnamic Acids of Gum Benzoin Resins by GC-MS HPLC-frit FAB-MS“. Phytochem Anal. 8 (2): 63–73. doi:10.1002/(SICI)1099-1565(199703)8:2<63::AID-PCA337>3.0.CO;2-Y.
- ↑ GSFA Online Food Additive Group Details: Benzoates (2006) Архивирано на 26 септември 2007 г.
- ↑ EUROPEAN PARLIAMENT AND COUNCIL DIRECTIVE No 95/2/EC of 20 February 1995 on food additives other than colours and sweeteners (Consleg-versions do not contain the latest changes in a law) Архивирано на 19 април 2003 г.
- ↑ „Indications of the possible formation of benzene from benzoic acid in foods, BfR Expert Opinion No. 013/2006“ (PDF). German Federal Institute for Risk Assessment. 1 December 2005. Архивирано (PDF) од изворникот 2006-04-26. Посетено на 30 March 2022.
- ↑ „Whitfield Ointment“. Архивирано од изворникот на 9 October 2007. Посетено на 15 October 2007.
- ↑ Charles Owens Wilson; Ole Gisvold; John H. Block (2004). Wilson and Gisvold's Textbook of Organic Medicinal and Pharmaceutical. Lippincott Williams & Wilkins. стр. 234. ISBN 978-0-7817-3481-3.
- ↑ Lillard, Benjamin (1919). „Troches of Benzoic Acid“. Practical Druggist and Pharmaceutical Review of Reviews.
- ↑ Experiment 2: Using Bomb Calorimetry to Determine the Resonance Energy of Benzene Архивирано на 9 март 2012 г.
- ↑ 32,0 32,1 32,2 „Concise International Chemical Assessment Document 26: BENZOIC ACID AND SODIUM BENZOATE“.
- ↑ Tomokuni K, Ogata M (1972). „Direct Colorimetric Determination of Hippuric Acid in Urine“. Clin Chem. 18 (4): 349–351. doi:10.1093/clinchem/18.4.349. PMID 5012256.
- ↑ Vogt, T. (2010). „Phenylpropanoid Biosynthesis“. Molecular Plant. 3: 2–20. doi:10.1093/mp/ssp106. PMID 20035037.
- ↑ Juteau, Pierre; Valérie Côté; Marie-France Duckett; Réjean Beaudet; François Lépine; Richard Villemur; Jean-Guy Bisaillon (January 2005). „Cryptanaerobacter phenolicus gen. nov., sp. nov., an anaerobe that transforms phenol into benzoate via 4-hydroxybenzoate“. International Journal of Systematic and Evolutionary Microbiology. 55 (1): 245–250. doi:10.1099/ijs.0.02914-0. PMID 15653882.
- ↑ Brewster, R. Q.; Williams, B.; Phillips, R. (1955). „3,5-Dinitrobenzoic Acid“. Organic Syntheses.; Collective Volume, 3, стр. 337
- ↑ Cosmetic Ingredient Review Expert Panel Bindu Nair (2001). „Final Report on the Safety Assessment of Benzyl Alcohol, Benzoic Acid, and Sodium Benzoate“. Int J Tox. 20 (Suppl. 3): 23–50. doi:10.1080/10915810152630729. PMID 11766131. S2CID 13639993.
- ↑ „butyrate-CoA ligase“. BRENDA. Technische Universität Braunschweig. Посетено на 7 May 2014. Substrate/Product
- ↑ „glycine N-acyltransferase“. BRENDA. Technische Universität Braunschweig. Посетено на 7 May 2014. Substrate/Product
- ↑ Krebs HA, Wiggins D, Stubbs M (1983). „Studies on the mechanism of the antifungal action of benzoate“. Biochem J. 214 (3): 657–663. doi:10.1042/bj2140657. PMC 1152300. PMID 6226283.
- ↑ Bedford PG, Clarke EG (1972). „Experimental benzoic acid poisoning in the cat“. Vet Rec. 90 (3): 53–58. doi:10.1136/vr.90.3.53. PMID 4672555. S2CID 2553612.
- ↑ Chen, Jian; Y.L. Kao (18 January 2010). „Nearly 30% dried, pickled foods fail safety inspections“. The China Post.
Надворешни врски
уреди- Бензоева киселина на Ризницата ?
- Меѓународна картичка за хемиска безбедност 0103 (англиски)
- СНСН: Првичен извештај за проценката за Benzoic Acid од Организацијата за економска соработка и развој (OECD) (англиски)
- ChemicalLand