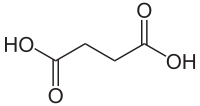
Килибарна киселина
Килибарна киселина или сукцинска киселина — дикарбоксилна киселина со хемиска формула (CH2)2(COOH)2.[4] Името на ова соединение доаѓа од латинсккиот збор succinum што значи килибар. Во живите организми килибарната киселина се јавува во форма на анјон, сукцинат, кој има мноштво биолошки функции како метаболен меѓупроизвод. Ензимот сукцинат дехидрогеназа го претвора сукцинатот во фумарат во комплекс 2 од електронскиот транспортен синџир.[5] Сукцинатот се создава во митохондриите како меѓупроизвод во тек на Кребсовиот циклус,[6] меѓутоа тој може да го напушти митохондриската матрица и да извршува важни улоги во цитоплазмата на клетката, како и во вонклеточниот простор. Некои од тие функции се промени во генетската експресија, модулација на епигенетските сигнали или хормонска сигнализација.[5] Како таков, сукцинатот го поврзува клеточниот метаболизам, особено синтезата на ATP, со регулација на клеточната функција. Нерегулираност во синтезата на сукцинат, а со тоа и синтезата на ATP, се случува кај некои генетски митохондријални заболувања, како што е Leighs и Melas заболувањата, а неговото распаѓање може да доведе до патолошки состојби како злоќудна трансформација, воспаление и оштетување на ткивото.[5][7][8]
| |

| |

| |
Други називи Килибарна киселина[1] | |
| Назнаки | |
|---|---|
| 110-15-6 | |
| ChEBI | CHEBI:15741 |
| ChEMBL | ChEMBL576 |
| ChemSpider | 1078 |
| DrugBank | DB00139 |
| |
IUPHAR/BPS
|
3637 |
| 3Д-модел (Jmol) | Слика |
| PubChem | 1110 |
| |
| UNII | AB6MNQ6J6L |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Густина | 1.56 g/cm3 |
| Точка на топење | |
| Точка на вриење | |
| 58 g/L (20 °C) или 100 mg/mL[2] | |
| Растворливост во Метанол | 158 mg/mL[2] |
| Растворливост во Етанол | 54 mg/mL[2] |
| Растворливост во Ацетон | 27 mg/mL[2] |
| Растворливост во Глицерол | 50 mg/mL[2] |
| Растворливост во Етер | 8.8 mg/mL[2] |
| Киселост (pKa) | pKa1 = 4.2 pKa2 = 5.6 |
| -57.9·10−6 cm3/mol | |
| Опасност | |
| Температура на запалување | 206 °C (403 °F; 479 K)[3] |
| Слични супстанци | |
| Други анјони | натриум сукцинат |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Физички својства
уредиКилибарната киселина е цврста супстанца со бела боја и изразено кисел вкус.[4] Во воден раствор таа се јонизира за да ја даде својата конјугирана база – сукцинат. Како дипротична киселина, таа подлежи на две последователни реакции на депротонација:
- (CH2)2(CO2H)2 → (CH2)2(CO2H)(CO2)− + H+
- (CH2)2(CO2H)(CO2)− → (CH2)2(CO2)22− + H+
pKa вредностите на овие процеси се 4.3 и 5.6, соодветно. И двата анјона се безбојни и можат да се изолираат како соли, на пример Na(CH2)2(COOH)(COO)- и Na(CH2)2(COO2)2-. Во живите организми, килибарната киселина е присутна во форма на нејзиниот анјон сукцинат, а не во неутрална форма.
Радикалот на килибарната киселина е познат како сукцинилна група.[9]
Како повеќето моно- и дикарбоксилни киселини, таа не е штетна, но може да биде раздразнувач за кожата и очите.[4]
Добивање и најчести реакции
уредиХемиски реакции
уредиКилибарната киселина може да биде оксидирана до фумарна киселина или да биде претворена во диестри, како што е диетил сукцинатот (CH2CO2CH2CH3)2. Овој диетил естер е супстрат на Стобеовата кондензација. Дехидратацијата на килибарната киселина дава анхидрид на килибарна киселина.[10] Сукцинатот може да се користи за добивање на 1,4-бутандиол, анхидрид на малеинска киселина, сукцинимид и тетрахидрофуран.[11]
Комерцијално добивање
уредиИсториски, килибарната киселина била добивана со дестилација на килибар, па оттука името килибарна киселина.[12] Денес, оваа киселина се добива синтетски или со процес на ферментација.[11] Најчести индустриски методи за синтеза на килибарната киселина вклучуваат: парцијална хидрогенација на малеинска киселина, оксидација на 1,4-бутандиол и карбонилација на етилен гликол.[12] Во скорешно време, генетскиот инжинеринг на микроорганизмите како E. coli Saccharomyces cerevisiae, овозможува добивање на големи количини килибарна киселина преку ферментација на гликоза.[11][13] Глобалното производство се проценува на 16,000 до 30,000 тони годишно, со годишен прираст од 10%.
Употреба
уредиПретходник на полимери, смоли и растворувачи
уредиКилибарната киселина е претходник на некои полиестри и влегува во состав на некои алкиди.[12] 1,4-бутандиолот може да се синтетизира со употреба на килибарната киселина како претходник.[14] Автомобилската и електронската индустрија во големи мери го користат 1,4-бутандиолот во производство на изолатори, конектори, раткапни, менувачи итн.[15] Килибарната киселина може да се користи како појдовен материјал за синтеза на оредени биоразградливи полимери.[16]
Во исхрана
уредиКилибарната киселина е признаена како безбедна од американската FDA (Food and Drug Administration) за употреба како прехранбен адитив и диетарен додаток.[17] Таа најчесто се користи како регулатор на киселост во индустријата за храна и пијалаци. Се користи и како средство за подобрување на вкусот бидејќи дава кисел и астригентен вкус. Во фармацевтските производи може да се користи како ексципиенс за контрола на киселоста[18] или како каунтерјон.[11] Лекови кои имаат во составот сукцинат се на пр. метопролол сукцинат, суматриптан сукцинат, доксиламин сукцинат и солифенацин сукцинат.
Биосинтеза
уредиКребсов циклус
уредиСукцинатот е клучен меѓупроизвод во циклусот на лимонска киселина. Тој се добива од сукцинил-КоА под дејство на ензимот сукцинил-КоА синтетаза, во чекор кој дава GTP/ATP како продукт:[6]
Сукцинил-КоA + NDP + Pi → Сукцинат + КоA + NTP
По овој чекор, сукцинатот се оксидира во фумарат, со делување на ензимот сукцинат дехидрогеназа (SDH).[6]
Сукцинат + FAD → Фумарат + FADH2
Сукцинат дехидрогеназа е всушност респираторниот комплекс 2 во состав на митохондријалниот електронско-транспортен синџир. Овој ензимски комплекс е составен од мембранско-врзан липобелковина изградена од 4 подединици, а ја поврзува оксидацијата на сукцинатот со редукцијата на убихинонот преку електронско-носачките посредници FAD и 2Fe-2S кластерите. На овој начин, сукцинатот претставува директен дарител на електрони на електронско-транспортниот синџир.[19]
Редуктивен Кребсов циклус
уредиДруг метаболен пат на добивање на сукцинатот е реверзната активност на сукцинат дехидрогеназата (SDH). Кај одредени бактериски видови (A. succinogenes, A. succiniproducens, M. succiniproducens) во анаеробни услови, циклусот на лимонска киселина се одвива во обратна насока, така што гликозата ја трансформираат во сукцинат преку интермедиерите оксалоацетат, малат и фумарат.[20] Овој метаболен пат се користи во метаболното инжинерство за добивање на сукцинат за човечка употреба.[20]
Акумулацијата на фумаратот може да ја поттикне реверзната активност на SDH, и на овој начин да се зголеми концентрацијата на сукцинат. При физиолошки и патолошки услови, концентрацијата на митохондријалниот фумарат може да се зголеми со активноста на малатно-аспартатниот шант или шантот на пуринските нуклеотиди.[21]
Глиоксалатен циклус
уредиВо тек на глиоксалатниот циклус, две дво-јаглеродни ацетилни единици се претвораат во еден 4-јаглероден сукцинат. Овој циклус е присутен во многу бактериски, растителни и габични видови, а им овозможува на овие организми да користат како извор на енергија ацетат или соединенија кои се разградуваат до ниво на ацетил-КоА. Глиоксалатниот метаболен пат е сличен со Кребсовиот циклус, иако овде не се одвиваат чекорите на декарбоксилација присутни во Кребсовиот циклус. Избегнувањето на овие чекори е овозможено со дејството на ензимот изоцитрат лиаза, кој го разградува изоцитратот на сукцинат и глиоксалат. Вака добиениот сукцинат може да се користи како извор на енергија или во анаболни процеси (на пр. гликонеогенеза).[6]
GABA шант
уредиШантот на гама-аминобутерна киселина (GABA шант) е алтернативен пат за претворање на алфа-кетоглутарат во сукцинат, со што се заобиколува интермедиерот сукцинил-КоА, а наместо него, како интермедиер се добива GABA. Оваа аминокиселина се добива со трансаминација и декарбоксилација на алфа-кетоглутаратот. Ензимот GABA-трансаминаза потоа ја метаболизира GABA во сукцински полуалдехид. На крај, сукцинскиот полуалдехид се оксидира во сукцинат со помош на ензимот сукцинска полуалдехидна дехидрогеназа (SSADH). GABA шантот се одвива во невроните, глија клетките, макрофагите и клетките на панкреасот.[22]
Клеточен метаболизам
уредиМетаболен меѓупроизвод
уредиСукцинатот се создава и концентрира во митохондриите на клетката, а неговата примарна биолошка функција е на метаболен меѓупроизвод.[5][6] Сите метаболни патишта кои се меѓусебно поврзани преку Кребсовиот циклус, вклучувајќи ги метаболизмот на јаглехидратите, аминокиселините, масните киселини, холестеролот и хемот, поминуваат низ фаза на привремено формирање на сукцинат.[5] Сукцинатот е достапен за биосинтетските процеси преку повеќе патишта, вклучувајќи ја редуктивната гранка на Кребсовиот циклус или глиоксилатниот циклус, преку кои се добива сукцинатот.[20][22] Кај глодачите, митохондриската концентрација на сукцинат е околу ~ 0,5 mM,[5] додека концентрацијата во плазмата е само 2-20 μM.[23]
Создавање на реактивни кислородни видови (ROS)
уредиСукцинат дехидрогеназата (SDH), која го претвора сукцинатот во фумарат, може да учествува во продукцијата на митохондријални реактивни кислородни видови (анг. reactive oxygen species ROS) преку насочување на протокот на електрони во електронскиот транспортен синџир.[5][19] Во услови на акумулација на сукцинат, брзата оксидација на сукцинатот од страна на SDH може да доведе до обратен електронски транспорт (анг. reverse electron transport RET).[24] Доколку митохондријалниот респираторен комплекс III не е способен доволно брзо да го прима вишокот на електрони добиени од оксидацијата на сукцинат, тој ги принудува електроните да течат назад низ електронскиот транспортен синџир. RET кај митохондријалниот респираторен комплекс I, комплексот што нормално претходи на SDH во електронскиот транспортен синџир, доведува до продукција на ROS, што создава оксидирачка микросредина.[24]
Дополнителни биолошки функции
уредиПокрај неговите метаболни улоги, сукцинатот служи и како внатреклеточна и вонклеточна сигнална молекула.[5][21] Екстра-митохондријалниот сукцинат го менува епигенетскиот пејзаж со инхибиција на семејството на 2-оксоглутарат-зависните диоксигенази.[21] Исто така, сукцинатот може да се ослободи во вонклеточната течност и крвотокот, каде што го препознаваат целните рецептори.[25] Општо земено, излегувањето на сукцинатот од митохондриите се случува поради негова прекумерна продукција или недоволна потрошувачка, а тие можат да се јават поради редуцирана, реверзна или сосема отсутна активност на SDH или други промени во метаболната состојба. Мутациите во SDH, хипоксијата или енергетски дисбаланс се поврзани со промена на флуксот низ циклусот на лимонска киселина и акумулација на сукцинат.[5][21][26] По напуштањето на митохондриите, сукцинатот служи како сигнал за метаболната состојба, сигнализирајќи на соседните клетки колку метаболички е активна популацијата на клетките од каде потекнува.[21] Како таков, сукцинатот ја поврзува дисфункцијата на Кребсовиот циклус или метаболичките промени со клетка-клетка комуникацијата и со одговорите кон оксидативен стрес.
Транспортери на сукцинат
уредиЗа движење на сукцинатот низ митохондриската и плазматската мембрана потребни се специфични транспортери. Тој излегува од митохондриската матрица и поминува низ внатрешната митохондриска мембрана со помош на дикарбоксилатни транспортери, првенствено SLC25A10, транспортер на сукцинат-фумарат/малат.[25] Во вториот чекор на излезот низ митохондријата, сукцинат лесно ја преминува надворешната митохондриска мембрана преку порини, неспецифични белковински канали кои ја олеснуваат дифузијата на молекулите помали од 1,5 kDa.[25] Транспортот низ плазматската мембрана најверојатно е специфичен за различните типови на ткиво. Кандидат за транспортер е INDY (анг. I'm not dead yet), натриум-независен анјонски разменувач, кој ги транспортира и дикарбоксилатот и цитратот во крвотокот.[25]
Вонклеточна сигнализација
уредиВонклеточниот сукцинат може да дејствува како сигнална молекула со функција слична на хормон, насочена кон различни ткива како што се крвни клетки, масното ткиво, имунолошките клетки, црниот дроб, срцето, ретината, а особено бубрезите. G –белковина-зависниот рецептор, GPR91, познат и како SUCNR1, служи како детектор на вонклеточен сукцинат.[27] Аминокиселинските остатоци на Arg99, His103, Arg252 и Arg281 во близина на центарот на рецепторот создаваат позитивно наелектризирано место за врзување на негативно наелектризираниот сукцинат.[27] Специфичноста на лигандот за GPR91 била ригорозно тестирана со употреба на 800 фармаколошки активни соединенија и 200 карбоксилни соединенија слични на сукцинат, кои покажаа значително понизок афинитет на врзување.[27] Генерално, EC50 (половина максимална делотворна концентрација) за сукцинат-GPR91 е во опсегот 20-50 uM.[25] Во зависност од типот на клетки, GPR91 може да комуницира со повеќе G-белковини, вклучувајќи ги и Gs, Gi и Gq, и давајќи различни одговори на сигнализацијата.[25]
Ефект врз адипоцитите
уредиКај адипоцитите, каскадата за сигнализирање на GPR91, активирана од сукцинат, ја инхибира липолизата.[25]
Ефект врз црниот дроб и мрежницата
уредиСигнализација на сукцинат често се јавува како одговор на хипоксични состојби. Во црниот дроб, сукцинат служи како паракрински сигнал, ослободен од аноксични хепатоцити, и цели на ѕвездестите клетки преку GPR91.[25] Ова доведува до активирање на ѕвездестата клетка и фиброгенеза. Така, се смета дека сукцинат игра улога во хомеостазата на црниот дроб. Во мрежницата, сукцинатот се акумулира во клетките на ретиналните ганглии како одговор на исхемични состојби. Сигнализацијата од автокриниот сукцинат поттикнува ретинална неоваскуларизација, предизвикувајќи активирање на ангиогени фактори како што е ендотелниот фактор на раст (VEGF).[25][27]
Ефект врз срцето
уредиВонклеточниот сукцинат ја регулира вијабилноста на кардиомиоцитите преку активирање на GPR91; долготрајното изложување на сукцинат води до патолошка хипертрофија на кардиомиоцитите.[25] Стимулацијата на GPR91 предизвикува најмалку две сигнални патишта во срцето: патека MEK1/2 и ERK1/2 која активира хипертрофична генска експресија и патека на фосфолипаза C која го менува моделот на навлегување и дистрибуција на Ca2+ и предизвикува CaM-зависна хипертрофична генска активација.[25]
Ефект врз имунолошките клетки
уредиSUCNR1 е високо изразен кај незрелите дендритични клетки, при што врзувањето на сукцинат ја стимулира хемотаксата.[27] Понатаму, SUCNR1 синергизира со толичните рецептори за зголемување на продукцијата на проинфламаторни цитокини како што се TNF алфа и интерлеукин-1бета.[7][27] Сукцинатот може да го подобри адаптивниот имунитет со активирање на активноста на антиген-презентирачките клетки кои, пак, ги активираат Т-клетките.[7]
Ефект врз тромбоцитите
уредиSUCNR1 е еден од најмногу изразените G-белковински рецептори на човечките тромбоцити, присутни на нивоа слични на P2Y12, иако се дебатира за улогата на сукцинатна сигнализација во тромбоцитната агрегација. Повеќекратните студии покажаа агрегација предизвикана од сукцинат, но ефектот има голема интер-поединечна варијабилност.[23]
Ефект врз бубрезите
уредиСукцинатот служи како модулатор на крвниот притисок преку стимулирање на ослободување на ренин во macula densa и јукстагломеруларните клетки преку GPR91.[28] Терапиите кои целат на сукцинатот за намалување на кардиоваскуларниот ризик и хипертензија се во фаза на истражување.[23]
Внатреклеточна сигнализација
уредиАкумулацијата на фумарат или сукцинат ја намалува активноста на 2-оксоглутарат-зависни диоксигеназите, вклучувајќи ги деметилазите на хистони и ДНК, пролил хидроксилази и колагенски пролил-4-хидроксилази, преку компетитивна инхибиција.[29] На 2-оксоглутарат-зависните диоксигенази потребен им е железен кофактор за катализирање на хидроксилациите, десатурациите и затворањето на прстените.[30] Заедно со оксидацијата на супстратот, тие го претвораат 2-оксоглутаратот во сукцинат и СО2. 2-оксоглутарат-зависните диоксигенази го врзуваат супстратот на низен, правилен начин.[30] Прво, 2-оксоглутаратот координира со Fe(II) јон врзан за сочуваната 2-хистидинил-1-аспартил/глутамил тријада на остатоци присутни во ензимскиот центар. Потоа, примарниот супстрат влегува во врзувачкото место, за да на крај кислородот се врзе за комплексот ензим-супстрат. Оксидативната декарбоксилација потоа создава железен меѓупроизвод координиран за сукцинатот, кој служи за оксидација на врзаниот примарен супстрат.[30] Сукцинатот може да интерферира со ензимскиот процес така што прв ќе се врзе за Fe(II) центарот, попречувајќи го врзувањето на 2-оксоглутарат. На тој начин, со ензимска инхибиција, зголемената концентрација на сукцинат може да доведе до промени во активноста на транскрипциониот фактор и промени метилацијата на хистони и ДНК-низ геномот.
Епигенетски ефекти
уредиСукцинат и фумарат ја инхибираат ТЕТ (анг. ten-eleven translocation) групата на 5-метилцитозински ДНК модифицирачки ензими и хистонските лизин деметилази кои содржат JmjC домен (анг. JmjC domain-containing histone lysine demethylase).[31] Патолошки покачените нивоа на сукцинат водат до хиперметилација, епигенетско замолчување и промени во невроендокрината диференцијација, потенцијално индуцирајќи го развојот на рак.[32]
Генска регулација
уредиИнхибицијата на пролил хидроксилазите (PHD) од страна на сукцинат го стабилизира транскрипциониот фактор наречен хипоксија-индуцибилен фактор (HIF) 1α (анг. hypoxia inducible factor (HIF)1α).[33] PHDs го хидроксилираат пролинот, а истовремено оксидативно го декарбоксилираат 2-оксоглутарат во сукцинат и СО2. Кај луѓето, три HIF пролил 4-хидроксилази ја регулираат стабилноста на HIF ензимите.[33] Хидроксилацијата на два пролински остатоци во HIF1α го олеснува врзувањето за убиквитинот, и на тој начин ја обележува за протеолитичко разградување со патот на убиквитин/протеазом. Бидејќи за PDH молекуларниот кислород е неопходен, овој процес е потиснат во услови на хипоксија, овозможувајќи HIF1α да избегне разградување. Високите концентрации на сукцинат имитираат состојба на хипоксија со потиснување на PHD,[32] па затоа го стабилизираат HIF1α и индуцираат транскрипција на HIF1-зависните гени, дури и при нормална заситеност со кислород. Познато е дека HIF1 индуцира транскрипција на повеќе од 60 гени, вклучувајќи ги и гените одговорни за васкуларизација и ангиогенеза, енергетски метаболизам, преживувањето на клетките и туморската инвазија.[33]
Поврзано
уредиНаводи
уреди- ↑ 1,0 1,1 Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. стр. 747. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 „Product Information Sheet: Succinic Acid“ (PDF). Sigma Aldrich. Архивирано од изворникот (PDF) на 2017-11-07. Посетено на 7 November 2015.
- ↑ Грешка во наводот: Погрешна ознака
<ref>; нема зададено текст за наводите по имеGESTIS. - ↑ 4,0 4,1 4,2 „SUCCINIC ACID - National Library of Medicine HSDB Database“. toxnet.nlm.nih.gov. Посетено на 2018-07-13.
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 5,6 5,7 5,8 Tretter, Laszlo; Patocs, Attila; Chinopoulos, Christos (2016-8). „Succinate, an intermediate in metabolism, signal transduction, ROS, hypoxia, and tumorigenesis“. Biochimica Et Biophysica Acta. 1857 (8): 1086–1101. doi:10.1016/j.bbabio.2016 март 012 Проверете ја вредноста
|doi=(help). ISSN 0006-3002. PMID 26971832. Проверете ги датумските вредности во:|date=(help) - ↑ 6,0 6,1 6,2 6,3 6,4 Berg, Jeremy M.; Tymoczko, John L.; Stryer, Lubert (2002). „The Glyoxylate Cycle Enables Plants and Bacteria to Grow on Acetate“. Biochemistry. 5th edition (англиски).
- ↑ 7,0 7,1 7,2 Mills, Evanna; O'Neill, Luke A. J. (2014-5). „Succinate: a metabolic signal in inflammation“. Trends in Cell Biology. 24 (5): 313–320. doi:10.1016/j.tcb.2013 ноември 008 Проверете ја вредноста
|doi=(help). ISSN 1879-3088. PMID 24361092. Проверете ги датумските вредности во:|date=(help) - ↑ Chouchani, Edward T.; Pell, Victoria R.; Gaude, Edoardo; Aksentijević, Dunja; Sundier, Stephanie Y.; Robb, Ellen L.; Logan, Angela; Nadtochiy, Sergiy M.; Ord, Emily N. J. (2014-11-20). „Ischaemic accumulation of succinate controls reperfusion injury through mitochondrial ROS“. Nature. 515 (7527): 431–435. doi:10.1038/nature13909. ISSN 1476-4687. PMC 4255242. PMID 25383517.CS1-одржување: PMC-формат (link)
- ↑ „Definition of SUCCINYL“. www.merriam-webster.com (англиски). Посетено на 2018-07-13.
- ↑ „http://www.orgsyn.org/demo.aspx?prep=CV2P0560“. www.orgsyn.org (англиски). Посетено на 2018-07-13. Надворешна врска во
|title=(help) - ↑ 11,0 11,1 11,2 11,3 Thakker, Chandresh; Martínez, Irene; San, Ka-Yiu; Bennett, George N. (2012-2). „Succinate production in Escherichia coli“. Biotechnology Journal. 7 (2): 213–224. doi:10.1002/biot.201100061. ISSN 1860-7314. PMC 3517001. PMID 21932253. Проверете ги датумските вредности во:
|date=(help)CS1-одржување: PMC-формат (link) - ↑ 12,0 12,1 12,2 Cornils, Boy; Lappe, Peter (2000-06-15). „Dicarboxylic Acids, Aliphatic“. Ullmann's Encyclopedia of Industrial Chemistry (англиски). Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. doi:10.1002/14356007.a08_523. ISBN 3527306730.
- ↑ Otero, José Manuel; Cimini, Donatella; Patil, Kiran R.; Poulsen, Simon G.; Olsson, Lisbeth; Nielsen, Jens (2013). „Industrial systems biology of Saccharomyces cerevisiae enables novel succinic acid cell factory“. PloS One. 8 (1): e54144. doi:10.1371/journal.pone.0054144. ISSN 1932-6203. PMC 3549990. PMID 23349810.CS1-одржување: PMC-формат (link)
- ↑ Ashford's Dictionary of Industrial Chemicals (англиски). London: Wavelength Publications. 1994. ISBN 9780952267409.
- ↑ „1,4 Butanediol Market Size, Share | 1,4 BDO Industry Report 2018-2025“. www.grandviewresearch.com (англиски). Посетено на 2018-07-13.
- ↑ Barrett, Devin G.; Yousaf, Muhammad N. (2009-10-12). „Design and Applications of Biodegradable Polyester Tissue Scaffolds Based on Endogenous Monomers Found in Human Metabolism“. Molecules (англиски). 14 (10): 4022–4050. doi:10.3390/molecules14104022.
- ↑ Zeikus, J. G.; Jain, M. K.; Elankovan, P. (1999-05-31). „Biotechnology of succinic acid production and markets for derived industrial products“. Applied Microbiology and Biotechnology (англиски). 51 (5): 545–552. doi:10.1007/s002530051431. ISSN 0175-7598.
- ↑ „Overview of pharmaceutical excipients used in tablets and capsules - - Drug Topics“. 2012-02-19. Архивирано од изворникот на 2012-02-19. Посетено на 2018-07-13.CS1-одржување: бот: непознат статус на изворната URL (link)
- ↑ 19,0 19,1 Dröse, Stefan (2013-5). „Differential effects of complex II on mitochondrial ROS production and their relation to cardioprotective pre- and postconditioning“. Biochimica Et Biophysica Acta. 1827 (5): 578–587. doi:10.1016/j.bbabio.2013 јануари 004 Проверете ја вредноста
|doi=(help). ISSN 0006-3002. PMID 23333272. Проверете ги датумските вредности во:|date=(help) - ↑ 20,0 20,1 20,2 Cheng, Ke-Ke; Wang, Gen-Yu; Zeng, Jing; Zhang, Jian-An (2013). „Improved succinate production by metabolic engineering“. BioMed Research International. 2013: 538790. doi:10.1155/2013/538790. ISSN 2314-6141. PMC 3652112. PMID 23691505.CS1-одржување: PMC-формат (link)
- ↑ 21,0 21,1 21,2 21,3 21,4 Haas, Robert; Cucchi, Danilo; Smith, Joanne; Pucino, Valentina; Macdougall, Claire Elizabeth; Mauro, Claudio (5 2016). „Intermediates of Metabolism: From Bystanders to Signalling Molecules“. Trends in Biochemical Sciences. 41 (5): 460–471. doi:10.1016/j.tibs.2016 февруари 003 Проверете ја вредноста
|doi=(help). ISSN 0968-0004. PMID 26935843. Проверете ги датумските вредности во:|date=(help) - ↑ 22,0 22,1 Olsen, Richard W.; DeLorey, Timothy M. (1999). „GABA Synthesis, Uptake and Release“. Basic Neurochemistry: Molecular, Cellular and Medical Aspects. 6th edition (англиски).
- ↑ 23,0 23,1 23,2 Ariza, Ana Carolina; Deen, Peter Meinardus T.; Robben, Joris Hubertus (2012). „The succinate receptor as a novel therapeutic target for oxidative and metabolic stress-related conditions“. Frontiers in Endocrinology. 3: 22. doi:10.3389/fendo.2012.00022. ISSN 1664-2392. PMC 3355999. PMID 22649411.CS1-одржување: PMC-формат (link)
- ↑ 24,0 24,1 Pell, Victoria R.; Chouchani, Edward T.; Frezza, Christian; Murphy, Michael P.; Krieg, Thomas (7 15, 2016). „Succinate metabolism: a new therapeutic target for myocardial reperfusion injury“. Cardiovascular Research. 111 (2): 134–141. doi:10.1093/cvr/cvw100. ISSN 1755-3245. PMID 27194563. Проверете ги датумските вредности во:
|date=(help) - ↑ 25,00 25,01 25,02 25,03 25,04 25,05 25,06 25,07 25,08 25,09 25,10 de Castro Fonseca, Matheus; Aguiar, Carla J.; da Rocha Franco, Joao Antônio; Gingold, Rafael N.; Leite, M. Fatima (2016-01-12). „GPR91: expanding the frontiers of Krebs cycle intermediates“. Cell communication and signaling: CCS. 14: 3. doi:10.1186/s12964-016-0126-1. ISSN 1478-811X. PMC 4709936. PMID 26759054.CS1-одржување: PMC-формат (link)
- ↑ Bardella, Chiara; Pollard, Patrick J.; Tomlinson, Ian (2011). „SDH mutations in cancer“. Biochimica Et Biophysica Acta. 1807 (11): 1432–1443. doi:10.1016/j.bbabio.2011 јули 003 Проверете ја вредноста
|doi=(help). ISSN 0006-3002. PMID 21771581. - ↑ 27,0 27,1 27,2 27,3 27,4 27,5 Gilissen, Julie; Jouret, François; Pirotte, Bernard; Hanson, Julien (2016-3). „Insight into SUCNR1 (GPR91) structure and function“. Pharmacology & Therapeutics. 159: 56–65. doi:10.1016/j.pharmthera.2016 јануари 008 Проверете ја вредноста
|doi=(help). ISSN 1879-016X. PMID 26808164. Проверете ги датумските вредности во:|date=(help) - ↑ Peti-Peterdi, János; Gevorgyan, Haykanush; Lam, Lisa; Riquier-Brison, Anne (2013-1). „Metabolic control of renin secretion“. Pflugers Archiv: European Journal of Physiology. 465 (1): 53–58. doi:10.1007/s00424-012-1130-y. ISSN 1432-2013. PMC 4574624. PMID 22729752. Проверете ги датумските вредности во:
|date=(help)CS1-одржување: PMC-формат (link) - ↑ Xiao, Mengtao; Yang, Hui; Xu, Wei; Ma, Shenghong; Lin, Huaipeng; Zhu, Honguang; Liu, Lixia; Liu, Ying; Yang, Chen (2012-06-15). „Inhibition of α-KG-dependent histone and DNA demethylases by fumarate and succinate that are accumulated in mutations of FH and SDH tumor suppressors“. Genes & Development. 26 (12): 1326–1338. doi:10.1101/gad.191056.112. ISSN 1549-5477. PMC 3387660. PMID 22677546.CS1-одржување: PMC-формат (link)
- ↑ 30,0 30,1 30,2 Hewitson, K. S.; Granatino, N.; Welford, R. W. D.; McDonough, M. A.; Schofield, C. J. (2005-04-15). „Oxidation by 2-oxoglutarate oxygenases: non-haem iron systems in catalysis and signalling“. Philosophical Transactions. Series A, Mathematical, Physical, and Engineering Sciences. 363 (1829): 807–828, discussion 1035–1040. doi:10.1098/rsta.2004.1540. ISSN 1364-503X. PMID 15901537.
- ↑ Yang, Ming; Pollard, Patrick J. (2013-06-10). „Succinate: a new epigenetic hacker“. Cancer Cell. 23 (6): 709–711. doi:10.1016/j.ccr.2013 мај 015 Проверете ја вредноста
|doi=(help). ISSN 1878-3686. PMID 23763995. - ↑ 32,0 32,1 Yang, Ming; Soga, Tomoyoshi; Pollard, Patrick J. (2013-9). „Oncometabolites: linking altered metabolism with cancer“. The Journal of Clinical Investigation. 123 (9): 3652–3658. doi:10.1172/JCI67228. ISSN 1558-8238. PMC 3754247. PMID 23999438. Проверете ги датумските вредности во:
|date=(help)CS1-одржување: PMC-формат (link) - ↑ 33,0 33,1 33,2 Koivunen, Peppi; Hirsilä, Maija; Remes, Anne M.; Hassinen, Ilmo E.; Kivirikko, Kari I.; Myllyharju, Johanna (2007-02-16). „Inhibition of hypoxia-inducible factor (HIF) hydroxylases by citric acid cycle intermediates: possible links between cell metabolism and stabilization of HIF“. The Journal of Biological Chemistry. 282 (7): 4524–4532. doi:10.1074/jbc.M610415200. ISSN 0021-9258. PMID 17182618.
Надворешни врски
уреди- Килибарна киселина (на англиски)
- Сметач: Активитети на вода и растворена супстанца во воден раствор на килибарна киселина Архивирано на 11 мај 2009 г. (на англиски)