Неврогеномика
Неврогеномика ― студија за тоа како геномот на еден организам влијае на развојот и функцијата на неговиот нервен систем.[1] Ова поле има намера да ги обедини функционалната геномика и невронауката со цел да биде разбран нервниот систем како целина од геномско гледиште.
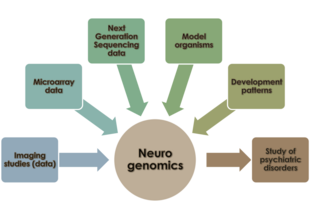
Нервниот систем кај 'рбетниците е составен од два главни видови клетки - невроглиски клетки и неврони. Стотици различни видови неврони постојат кај луѓето, со различни функции - некои од нив обработуваат надворешни дразби; други создаваат одговор на стимули; други се организираат во централизирани структури (мозок, рбетни ганглии) кои се одговорни за сознавањето, перцепцијата и регулирањето на моторните функции. Невроните во овие централизирани места имаат тежнеење да се организираат во огромни мрежи и опширно да општат едни со други. Пред достапноста на изразувачки низи и методологии за секвенционирање на ДНК, истражувачите се обиделе да го разберат клеточното однесување на невроните (вклучувајќи создавање на синапси и развој на невроните и регионализација во човечкиот нервен систем) во однос на основната молекуларна биологија и биохемија, без никакво разбирање на влијанието на геномот на невронот врз неговиот развој и однесување. Како што било проширено разбирањето за геномот, улогата на мрежите на генски заемодејства во одржувањето на функцијата и однесувањето на невроните предизвика интерес во истражувачката заедница за невронаука. Неврогеномиката им овозможува на научниците да го проучуваат нервниот систем на организмите во контекст на овие основни регулаторни и транскрипциски мрежи. Овој пристап се разликува од неврогенетиката, која ја нагласува улогата на поединечни гени без контекст на мрежно заемодејство при проучување на нервниот систем.[2]
Пристапи
уредиДоаѓањето на биологијата со висока пропусност
уредиВо 1999 година, Чирели и Тонони[3] првпат ја пријавиле поврзаноста на профилирањето на мозочното генско изразување на целиот геном (со користење на микронизи) со фенотип на однесување кај глувците. Оттогаш, податоците за општото изразување на мозочните гени, добиени од микронизите, се усогласени со различни однесувачките квантитативни локуси со особини и пријавени во неколку публикации.[4][5][6] Сепак, пристапите засновани на микронизи имаат свои проблеми што ја мешаат анализата - заситеноста на сондата може да резултира со многу мала мерлива варијанса на генското изразување помеѓу генетски единствени поединки,[7] и присуството на единечни нуклеотидни полиморфизми може да резултира со артефакти на хибридизација.[8][9] Понатаму, поради нивната природа заснована на сонда, микронизите може да пропуштат многу видови транскрипти (изоформи на некодирачка РНК, микро РНК и информациска РНК). Сондите исто така може да имаат сврзувачки афинитети специфични за видовите што може да ја збунат споредбената анализа.
Имено, поврзаноста помеѓу моделите на однесување и единечните генски локуси со висока пенетрантност спаѓа во делот на истражувањето за неврогенетика, каде што фокусот е да биде идентификувана едноставна причинско-последична врска помеѓу еден, ген со висока пенетрантност и набљудувана функција/однесување. Сепак, била покажана дека неколку невролошки болести имаат тежнеење да бидат полигени, под влијание на повеќе различни гени и регулаторни региони наместо само еден ген. Оттука, дојде до промена од пристапите од еден ген кон мрежни пристапи за проучување на невролошкиот развој и болестите, промена која во голема мера била поттикната од доаѓањето на методологиите за масивното напоредно секвенционирање.
Пристапи за масивното напоредно секвенционирање
уредиСтудиите за близнаци откриле дека шизофренијата,[10] биполарното растројство,[11] нарушувањето на спектарот на аутизам,[12][13] и нарушувањето на хиперактивноста со недостаток на внимание[14] се многу наследни, генетски сложени душевни нарушувања. Сепак, студиите за поврзување во голема мера не успеале да ги идентификуваат предизвикувачките варијанти за душевни нарушувања како овие, првенствено поради нивната сложена генетска архитектура. Повеќекратните варијанти на ризик со ниска пенетрантност може да бидат собрани кај засегнатите поединци и семејства, а групите варијанти на предизвикувачот може да варираат во семејствата. Студиите по овие линии утврдиле полигена основа за неколку душевни нарушувања.[15] Утврдено е дека неколку независни „де ново мутации“ кај пациенти Алцхајмеровата болест го нарушуваат заедничкиот сет на функционални патишта кои се вклучени во невронската сигнализација, на пример.[16] Оттука, барањето за разбирање на предизвикувачката биологија на душевните нарушувања е многу потпомогната од способноста да бидат анализирани цели геноми на засегнати и незасегнати поединци на непристрасен начин.[17]
Со достапноста на масовно напоредни методологии за секвенционирање, научниците можеле да погледнат подалеку од фаќањата на изразени гени засновани на сонда. Секвенционирање на РНК, на пример, идентификува 25-60% повеќе изразени гени отколку микронизите. Во претстојното поле на неврогеномиката, се надеваме дека со разбирање на геномските профили на различни делови од мозокот, можеби ќе можеме да го подобриме нашето разбирање за тоа како замнодејствата помеѓу гените и патиштата влијаат на клеточната функција и развој. Овој пристап е очекуван да може да ги идентификува секундарните генски мрежи кои се нарушени при невролошки нарушувања, што последователно ќе им помогне на стратегиите за развој на лекови за мозочни заболувања.[18] Иницијативата за истражување на мозокот преку унапредување на иновативни невротехнологии започната во 2013 година, на пример, се стреми да го „информира развојот на идните третмани за мозочни нарушувања, вклучително и Алцхајмерова болест, епилепсија и трауматски повреди на мозокот“.
Студиите за поврзаност на ретки варијанти ја истакнале улогата на „де ново“ мутациите во неколку вродени и рани нарушувања од детството, како што е аутизмот.[19][20] Неколку од овие мутации кои ја нарушуваат белковината биле во можност да бидат идентификувани само со помош на напорите за секвенционирање на целиот геном и потврдени со секвенционирање на РНК. Дополнително, овие мутации не се статистички збогатени со поединечни гени, туку покажуваат модели на статистичко збогатување во групи на гени поврзани со мрежи кои го регулираат невролошкиот развој и одржување. Таквото откритие би било невозможно со претходни геноцентрични пристапи (неврогенетика, невронаука на однесувањето). Неврогеномиката овозможува системски пристап со висок пропусен опсег за разбирање на полигенската основа на душевните нарушувања.[17]
Студии за отсликување и оптичко картирање
уредиКога аутизмот бил идентификуван како посебно биолошко нарушување во 1980-тите, истражувачите откриле дека аутистичните лица покажале абнормалност на растот во малиот мозок во нивните рани развојни години.[21] Последователните истражувања покажале дека 90% од децата со аутизам имаат поголем волумен на мозокот од нивните врсници на возраст од 2 до 4 години и покажуваат проширување на содржината на белата и сивата материја во големиот мозок.[22] Белата и сивата материја во големиот мозок се поврзани со учењето и сознавањето соодветно, а создавањето на амилоидни точки во белата маса е поврзано со Алцхајмерова болест. Овие наоди го истакнале влијанието на структурната варијанса во мозокот врз душевните нарушувања и ја мотивирале употребата на технологии за отсликување за картирање на регионите на дивергенција помеѓу здрави и болни мозоци. Понатаму, иако можеби не е секогаш можно да бидат извлечени биолошки примероци од различни области на живиот човечки мозок, техниките за невросликање нудат неинвазивни средства за разбирање на биолошката основа на невролошките нарушувања. Се надеваме дека разбирањето на шаблоните на наоѓање на различни психијатриски болести би можело да ги информира студиите за анализа на мрежата во неврогеномиката.
Магнетна резонанција
уредиСтруктурната магнетна резонанција може да биде користена за да биде идентификуван структурниот состав на мозокот. Особено во контекст на неврогеномиката, магнетната резонанција одиграла голема улога во проучувањето на Алцхајмеровата болест во последните четири децении. Првично била користена за да бидат исклучени други причини за деменција,[16] но неодамнешните студии покажале присуство на карактеристични промени кај пациенти со Алцхајмерова болест. Како резултат на тоа, скенирањата со магнетна резонанција моментално се користени како алатка за невросликиње за да биде помогнато во идентификувањето на временската и просторната патофизиологија на Алцхајмеровата болест, како што се специфичните церебрални промени и амилоидното снимање.[16]
Леснотијата и неинвазивната природа на скеновите со магнетна резонанција ги мотивирало истражувачките проекти кои го следат развојот и почетокот на душевните болести во мозокот. Алцхајмеровата болест станала клучен кандидат во овој топографски пристап кон психијатриските болести. На пример, скенирањата со магнетна резонанција во моментов се користени за следење на функционалните профили на мозокот зависни од одмор и задачи кај деца со автосомно доминантна Алцхајмерова болест.[23] Овие студии пронашле индикации за ран почеток на мозочни промени кај лица изложени на ризик за Алцхајмерова болест.[16] Аутистичкиот центар за извонредност при Универзитетот во Калифорнија, Сан Диего, исто така, спроведува студии со магнетни резонанци од деца помеѓу 12 и 42 месеци, со надеж дека ќе ги карактеризира абнормалности во развојот на мозокот кај децата кои покажуваат симптоми на аутизам во однесувањето.[24]
Дополнителни истражувања покажале дека постојат специфични модели на атрофија во големиот мозок (како реперкусија на невродегенерација) кај различни невролошки нарушувања и болести. Овие шеми на напредок на атрофија специфични за болеста може да бидат идентификувани со скенирање со магнетна резонанција и да обезбедат контекст на клинички фенотип за неврогеномско истражување. Временските информации за напредокот на болеста обезбедени со овој пристап, исто така, може потенцијално да го информираат толкувањето на пертурбациите на ниво на генска мрежа кај душевните болести.[16]
Оптичко картирање
уредиЕдна забранувачка особина на методологиите со масивното напоредно секвенционирање е горната граница на геномскиот опсег до кој може да биде пристапен со спарување. Оптичкото картирање е нова методологија што е користена за опфат на варијанти од големи размери кои обично не можат да бидат откриени со помош на спарени крајни отчитувања. Овој пристап е успешно применет за откривање на структурни варијанти кај олигодендроглиом, вид рак на мозокот.[25] Неодамнешната работа, исто така, ја истакнала разновидноста на оптичките карти во подобрувањето на постоечките склопови на геномот. Хромозомските преуредувања, микробришењата и големите транслокации се поврзани со нарушена невролошка и когнитивна функција, на пример кај наследна невропатија и неврофиброматоза. Оптичкото картирање може значително да го подобри откривањето на варијантите и да ги информира моделите на мрежата за заемодејство на гените за заболената состојба кај невролошките нарушувања.
Проучување на други мозочни заболувања
уредиПокрај невролошките нарушувања, постојат дополнителни болести кои се манифестираат во мозокот и правеле примерни сценарија за употреба за примена на отсликување на мозокот во мрежната анализа. Во класичен пример на анализи за геномски отсликување, една истражувачка студија во 2012 година ги споредила скенирањата со магнетна резонанција и профилите на генско изразување на 104 пациенти со глиома со цел да бидат разликувани исходите од третманот и да бидат идентификувани новите геномски патеки што се насочени кон повеќеобличен глиобластом. Истражувачите откриле две различни групи на пациенти со значително различна организација на белата маса (инвазивна наспроти неинвазивна). Последователната анализа на патеката на податоците за генската експресија укажа на митохондријалната дисфункција како врвна канонска патека во агресивен фенотип на повеќеобличниот глиобластом со ниска смртност.[26]
Проширувањето на пристапите за сликање на мозокот кон други болести може да биде користено за да бидат исклучени други медицински болести додека се дијагностицирани душевни нарушувања, но не може да биде користено за да биде информирано за присуството или отсуството на душевно нарушување.
Истражувачки развојни модели
уредиКај луѓето
уредиСегашните пристапи за собирање податоци за генско изразување во човечкиот мозок се микронизите или преку секвенционирање на РНК. Во моментов, ретко е собирано „живо“ мозочно ткиво - само кога третманите вклучуваат операција на мозокот, постои можност мозочното ткиво да биде собрано за време на процедурата. Ова е случај со епилепсијата.
Во моментов, податоците за генското изразување обично се собирани на мозоци по смртта и тоа често е пречка за истражување на неврогеномиката кај луѓето.[27][28] По смртта, временскиот период помеѓу смртта и кога се собирани податоците од мозокот на починатиот е познат како послесмртен интервал. Бидејќи РНК се разградува по смртта, свеж мозок е оптимален - но не секогаш достапен. Ова за возврат може да влијае на различни анализи низводно. Треба да бидат земени во предвид следниве фактори кога се работи со омички податоци собирани од мозоци од починати:
- Идеално, човечкиот мозок треба да биде контролиран за послесмртен интервал за дадена студија.[29][30]
- Причината за смртта е исто така важна променлива што треба да биде земен предвид при собирањето примероци од човечки мозок за целите на истражувањето на неврогеномиката. На пример, примероци од мозокот на лица со клиничка депресија често се собирани по самоубиство. Одредени состојби на смрт, како што се предозирање со дрога или самонанесен испукан истрел, ќе го променат изразот на мозокот.
- Друг проблем со проучувањето на генското изразување во мозокот е клеточната хетерогеност на примероците на мозочното ткиво. Масовните примероци на мозокот може да варираат во пропорции на специфични клеточни групи на население од случај до случај. Ова може да влијае на потписите на генското изразување и може значително да ја промени анализата на диференцијалното изразување.
- Еден пристап за решавање на ова прашање е да се користи едноклеточно секвенционирање. Ова би го контролирало одреден вид клетка. Сепак, ова решение е применливо само кога студиите не се специфични за клеточниот вид.[31]
Диференцијалната дијагноза, исто така, останува критична преданалитичка збунетост на студиите на спектарот на невролошки нарушувања на ниво на група. Поточно, било забележано дека ова е проблем за студиите за Алцхајмеровата болест и аутистичниот спектар на нарушувања. Понатаму, како што се подобрува нашето разбирање за различните симптоми и геномските основи на различните неврогеномски нарушувања, самите дијагностички критериуми се подложени на преуредување и преглед.[32]
Животински модели
уредиТековните геномски истражувања во невролошките нарушувања имаат тежнеење да користат животински модели (и соодветни генски хомолози) за да ги разберат мрежните заемодејства кои лежат во основата на одредено нарушување поради етичките прашања околу пронаоѓањето на биолошки примероци од живи човечки мозоци. Ова, исто така, не е без пречки.
Неврогеномското истражување со модел на организам е зависно од достапноста на целосно секвенциониран и означен референтен геном. Дополнително, профилите на РНК (микро РНК, некодирачка РНК, информациска РНК) на моделниот организам треба добро да бидат каталогизирани, а сите заклучоци применети од нив за луѓето мора да имаат основа во функционална/секвенциска хомологија.[33]
Зебрести риби
уредиРазвојот на зебрестата риба се потпира на генските мрежи кои се високо зачувани кај сите 'рбетници.[34] Дополнително, со крајно добро забележан сет од 12.000 гени и 1.000 мутанти во раниот развој, кои се всушност видливи во оптички чистите зародоци и ларви на зебрестите риби. Зебрестите риби нудат софистициран систем за мутагенеза и сликање во вистинско време на патологиите во развој. Овој ран развојен модел е употребен за проучување на нервниот систем при клеточна резолуција.[35][36] Моделниот систем на зебрестата риба веќе е користен за проучување на неврорегенерацијата[37] и тешките полигени човечки болести како рак и срцеви заболувања.[38] Изолирани се неколку мутанти на зебрестите риби со варијации во однесувањето како одговор на дозата на кокаин и алкохол и исто така можат да образуваат основа за проучување на патогенезата на нарушувањата во однесувањето.[39][40]
Глодари
уредиГлодарските модели се истакнати во проучувањето на човечките нарушувања. Овие модели се опширно означени со генски хомолози на неколку моногени нарушувања кај луѓето. Студиите за соборување на овие хомологи довеле до проширување на разбирањето за мрежните заемодејства на гените во човечките ткива. На пример, генот FMR1 е вмешан со аутизам од голем број мрежни студии.[41][42] Користењето соборување врз FMR 1 кај глувците го создава моделот за кревкиот X синдром, едно од нарушувањата во спектарот на аутизмот.[43]
Глувчешките ксенографти се особено корисни за откривање лекови,[44] и биле исклучително важни во откривањето на раните антипсихотични лекови. Развојот на животински модели за сложени душевни болести, исто така, се подобри во последните неколку години. Моделите со глодари покажале промени во фенотипот во однесувањето кои наликуваат на позитивна состојба на шизофренија, или по генетска манипулација или по третман со лекови кои целат кон областите на мозокот за кои постои сомневање дека влијаат на хиперактивноста или невроразвојот.[45] Создаден е интерес за идентификување на прекините на мрежата посредувани од овие лабораториски манипулации, а собирањето на геномски податоци од студиите за глодари значително придонело за подобро разбирање на геномиката на душевните болести.
Првиот транскриптом на глувчешкиот мозок бил направен во 2008 година.[46] Оттогаш, обемна работа е направена со глувчешки модели на кои им е нанесуван општествен стрес за да бидат проучувани знаците на изразување на ниво на патека на различни душевни болести. Неодамнешниот труд ги симулирал особините на послетрауматско стресно нарушување кај глувците и го профилирал целиот транскриптом на овие глувци.[47] Авторите пронашле диференцијална регулација во многу биолошки патишта, од кои некои се вмешани во тревожни нарушувања (хиперактивност, одговор на страв), нарушувања на расположението и нарушено когниција. Овие наоди биле поткрепени со обемни транскриптомски анализи на тревожните нарушувања и се сметани дека промените во нивото на изразување во биолошките патишта кои се вклучени со учењето со страв и меморијата придонесуваат за манифестациите на однесувањето на овие нарушувања.[47] Сметано е дека функционалното збогатување на гените кои се вклучени во долгорочното синаптичко зајакнување, депресијата и пластичноста има важна улога во стекнувањето, консолидацијата и одржувањето на трауматските спомени кои се во основата на тревожните нарушувања.[47][48]
Опитни глувчешки модели за душевни нарушувања
уредиВообичаен пристап за користење на глувчешки модел е да биде применет опитен третман на бремена женка глушец со цел да биде влијаено на целото легло. Сепак, клучно прашање на теренот е третманот на отпадоците во статистичка анализа. Повеќето студии го сметаат вкупниот број на произведени потомци бидејќи тоа може да доведе до зголемување на статистичката моќ. Сепак, правилниот начин е да биде броено по бројот на легла и да биде нормализирано врз основа на големината на леглото. Откриено е дека неколку студии за аутизам погрешно ги извршиле своите статистички анализи врз основа на вкупниот број потомци наместо бројот на легла.[49]
Неколку тревожни нарушувања, како што е послетрауматското стресно растројство вклучуваат хетерогени промени во неколку различни мозочни региони, како што се хипокампусот, амигдалата и акумбенското јадро. Било покажано дека клеточното кодирање на трауматските настани и однесувачките реакции предизвикани од таквите настани лежат првенствено во промените во сигналните молекули поврзани со синаптичкиот пренос.
Профилирањето на општото генско изразување на различните генски региони вмешани во обработката на стравот и тревожноста, користејќи глувчешки модели, довело до идентификација на временски и просторно различни групи на диференцијално изразени гени. Анализата на патеката на овие гени укажала на можни улоги во неврогенезата и реакциите на однесувањето поврзани со тревожноста, заедно со другите функционални и фенотипски набљудувања.[47]
Глувчешките модели за истражување на мозокот значително придонеле за развој на лекови и го зголемиле нашето разбирање за геномската основа на неколку невролошки болести во последната генерација. Хлорпромазин, првиот антипсихотичен лек (откриен во 1951 година), бил идентификуван како одржлива можност за третман откако било покажано дека го потиснува одговорот на аверзивни стимули кај стаорци на прегледот за однесување.
Предизвици
уредиМоделирањето и проценката на латентни симптоми (мисли, вербално учење, општествени заемодејства, когнитивно однесување) останува предизвик кога се користени моделни организми за проучување на душевни нарушувања со сложена генетска патологија. На пример, даден генотип+фенотип во глувчешки модел мора да ги имитира геномските основи на фенотипот забележан кај човекот.
Ова е особено клучна точка на разгледување кај нарушувањата на спектарот, како што е аутизмот. Аутизмот е нарушување чии симптоми можат да бидат поделени во две категории: (i) дефицит на општествени заемодејства и (ii) повторувачки однесувања и ограничени интереси. Бидејќи глувците имаат тежнеење да бидат повеќе општествени суштества меѓу сите членови на редот глодари кои моментално се користени како моделни организми, глувците обично се користени за моделирање на човечки душевни нарушувања колку што е можно поблиску. Посебно за аутизмот, во моментов се воведени следните решенија за да бидат имитирани симптомите на човековото однесување:
- За првата дијагностичка категорија на нарушено општествено однесување, глувците се предмет на општествена анализа наменета да претставува вообичаен аутистички општествен недостаток. Нормално општествено однесување на глувците вклучува мирисање, следење, физички допир и чешкање и пипкање. Може да биде користено и општење на глас.
- Постојат голем број начини на кои може да биде забележана втората дијагностичка категорија кај глувците. Примери за повторувачки однесувања може да вклучуваат прекумерно кружење, самостојно чешкање и пипкање и прекумерно копање. Обично овие однесувања би се изведувале постојано во рамките на долго мерење на времето (т.е. самостојно чешкање и пипкање 10 минути).[50]
- Додека повторливите однесувања се лесно забележливи, тешко е да бидат карактеризирани вистинските ограничени интереси на глувците. Еден аспект на ограничените интереси на аутистичните поединки е „наложувањето на истото“ - концептот дека аутистичните поединки бараат нивната околина да остане доследна. Ако таа средина биде променета, поединецот би доживеал стрес и беспокојство. Пријавен е успех во потврдувањето на аутистичкиот глувчешки модел со промена на околината на глушецот.[51]
Во кој било од овие опити, „аутистичните“ глувци имаат „нормален“ партнер за дружење и научниците што ги набљудуваат глувците не се свесни („слепи“) за генотиповите на глувците.
Генско изразување во мозокот
уредиПрофилот на генското изразување на средишниот нервен систем е единствен. Осумдесет проценти од сите човечки гени се изразени во мозокот; 5.000 од овие гени се само изразени во средишниот нервен систем. Човечкиот мозок има најголемо количество генско изразување од сите проучувани мозоци на цицачи. За споредба, ткивата надвор од мозокот ќе имаат повеќе слични нивоа на изразување во споредба со нивните роднини цицачи. Еден извор на зголемените нивоа на изразување во човечкиот мозок е од небелковинскиот кодиран регион на геномот. Бројни студии покажаа дека човечкиот мозок има повисоко ниво на изразување во регулаторните региони во споредба со другите мозоци на цицачи. Исто така, има забележително збогатување за повеќе алтернативни настани за спојување во човечкиот мозок.[2]
Просторни разлики
уредиПрофилите на генското изразување, исто така, варираат во одредени региони на мозокот. Студија за микронизи покажала дека профилот на транскриптом на кластери во средишниот нервен систем заедно врз основа на регионот. Една поинаква студија ја карактеризирала регулацијата на генското изразување низ 10 различни региони врз основа на нивните сигнали со изразување квантитативни локуси на особина.[52] Причината за различните профили на изразување се однесува на функцијата, преселбата на невронот и клеточната хетерогеност на регионот. Дури и трите слоеви на церебралниот кортекс имаат различни профили на изразување.[53]
Студијата завршена на Медицинскиот факултет Харвард во 2014 година можела да ги идентификува развојните лози кои произлегуваат од единечни базни невронски мутации. Истражувачите секвенционирале 36 неврони од церебралниот кортекс на три нормални поединци и откриле дека високо изразените гени и гените поврзани со нервниот систем се значително збогатени за единечно нуклеотидни полиморфизми со еден неврон. Овие единечно нуклеотидни полиморфизми, пак, биле откриени дека се во корелација со хроматинските маркери на транскрипција од фетусниот мозок.[54]
Модели на развој кај луѓето
уредиГенското изразување на мозокот се менува во различни фази од животот. Најзначајните нивоа на изразување се наоѓаат за време на раниот развој, при што стапката на генско изразување е највисока за време на фетусниот развој. Ова е резултат на брзиот раст на невроните во зародокот. Невроните во оваа фаза се подложени на невронска диференцијација, клеточна пролиферација, преселнички настани и дендритски и синапсен развој.[55] Моделите на генското изразување се поблиску до специјализираните функционални профили за време на зародочниот развој, меѓутоа, одредени развојни чекори сè уште се во тек при породувањето. Следствено, профилите на генското изразување на двете мозочни полутопки изгледаат несиметрични при раѓањето. При раѓањето, профилите на генското изразување изгледаат несиметрични помеѓу мозочните полутопки. Како што продолжува развојот, профилите на генското изразување стануваат слични помеѓу полутопките. Со оглед на здрава возрасна личност, профилите на изразување остануваат релативно доследни од доцните дваесетти до доцните четириесетти. Од педесеттите години наваму, постои значително намалување на изразувањето на гените важни за регуларната функција. И покрај ова, постои зголемување на разновидноста на гените кои се изразувани низ мозокот. Оваа промена во изразот поврзана со возраста може да биде во корелација со гванинско-цитозинската содржина. Во подоцнежните фази од животот, постои зголемување на индукцијата на главни гени со ниска гванинско-цитозинска содржина, како и зголемување на репресијата на главните гени со висока гванинско-цитозинска содржина.[53] Друга причина за промената на генската разновидност е насобирањето на мутации и оштетувањето на ДНК. Студиите за изразување на гените покажуваат дека гените кои ги собираат овие мутации поврзани со возраста се доследни помеѓу поединците во населението што старее. Гените кои се високо изразени во развојот значително се намалуваат во доцните фази од животот, додека гените кои се силно потиснати во развојот значително се зголемуваат во доцните фази.[54]
Еволуција на мозокот на цицачите
уредиЕволуцијата на денешниот човек од дивергенцијата од заедничкиот предок на приматите покажало значително проширување на големината и сложеноста на мозокот, особено во церебралниот кортекс.[56][57][58][59] Во споредба со приматите, човечкиот церебрален кортекс има поголема површина, но се разликува само малку по дебелина. Многу големи студии за разбирање на разликите на човечкиот мозок од другите видови укажале на проширувањето на генските семејства и промените во алтернативното спојување кои се одговорни за последователно зголемување на когнитивните способности и соработничкото однесување кај луѓето.[60][61] Сепак, допрва треба да ги утврдиме точните фенотипски последици од сите овие промени. Една од тешкотиите е што само приматите имаат развиено поделби во нивниот церебрален кортекс, што го прави моделирањето на човечките специфични невролошки проблеми тешко да бидат имитирани кај глодарите.[58][62][63]
Податоците од низата се користени за да бидат разбрани еволутивните генетски промени кои довеле до развој на човечкиот средишен нервен систем. Потоа можеме да биде разбрано како невролошките фенотипови се разликуваат помеѓу видовите. Споредбената геномика повлекува споредба на податоците за секвенците низ филогенијата за прецизно да бидат утврдени генотипските промени што се случуваат во одредени лози и да биде разбрано како овие промени може да се појават. Зголемувањето на висококвалитетните референтни низи од цицачи, воглавно ја прави споредбената анализа подобра бидејќи ја зголемува статистичката моќ. Сепак, зголемувањето на бројот на видови во филогенијата ризикува да додаде непотребна бучава бидејќи порамнувањата на ортолошките низи обично се намалуваат во квалитетот. Понатаму, различните класи видови ќе имаат значителни разлики во нивните фенотипови.[64]
И покрај ова, споредбената геномика овозможила да бидат поврзани генетските промени пронајдени во филогенијата со специфични патишта. Со цел да биде утврдено ова, лозата е тестирана за функционалните промени кои се собираат со текот на времето. Ова често се мери како сооднос на несинонимни замени со синонимни замени или сооднос Ka/Ks (понекогаш, понатаму скратено на ω). Кога односот Ka/Ks е поголем од 1, тоа укажува на позитивен избор. Односот Ka/Ks еднаков на 1 е доказ дека нема избирачки притисоци. Соодносот Ka/Ks помал од 1 означува негативен избор. На пример, зачуваните региони на геномот воглавно ќе имаат сооднос Ka/Ks помал од 1 бидејќи секоја промена на тие положби најверојатно ќе биде штетна.[65] Од гените изразени во човечкиот мозок, проценувано е дека 342 од нив имаат сооднос Ka/Ks поголем од 1 во лозата на човекот во споредба со другите лоза на примати.[64] Ова укажува на позитивно одбирање на човечката лоза за мозочни фенотипови. Разбирањето на значењето на позитивното одбирање е воглавно следниот чекор. На пример, ASPM, CDK5RAP2 и NIN се гени кои се позитивно избрани за човечката лоза и се директно поврзани со големината на мозокот. Ова откритие може да помогне да биде разјаснето зошто човечкиот мозок е поголем од мозоците на другите цицачи.[65]
Разлики на изразување на ниво на мрежа помеѓу видовите
уредиСмета но е дека промените во генското изразување, кои се крајниот одговор за какви било генетски промени, се добри посредници за разбирање на фенотипските разлики во биолошките примероци. Споредбените студии откриле низа разлики во транскрипциските контроли помеѓу приматите и глодарите. На пример, генот CNTNAP2 е специјално збогатен за префронталниот кортекс. Глувчешкиот хомолог CNTNAP2 не е изразен во мозокот на глушецот. CNTNAP2 е вмешан во когнитивните функции на јазикот, како и во невроразвојните нарушувања како што е нарушувањето на аутистичниот спектар. Ова наведува дека контролата на изразувањето игра значајна улога во развојот на уникатната човечка когнитивна функција. Како последица на тоа, голем број студии ги истражувале специфичните засилувачи на мозокот. Утврдено е дека факторите на транскрипција како SOX5 се позитивно избрани за човечката лоза. Студиите за генско изразување кај луѓето, шимпанзата и макаките- резус, идентификуваа човечки специфични мрежи за соизразување и покачување на генското изразување во човечкиот кортекс во споредба со приматите.[66]
Нарушувања
уредиНеврогеномските нарушувања се манифестираат како невролошки нарушувања со сложена генетска архитектура и неменделов модел на наследување.[18] Некои примери на овие нарушувања се биполарно растројство и шизофренија.[15] Неколку гени може да бидат вклучени во манифестацијата на нарушувањето, а мутациите во таквите нарушувања се воглавно ретки и се отпочеток. Оттука, станува крајно неверојатно да биде набљудувана истата (потенцијално предизвикувачка) варијанта кај две неповрзани поединци погодени со исто неврогеномско нарушување.[15] Тековните истражувања вмешани неколку отпочеток егзонични варијации и структурни варијации во нарушување на спектарот на аутизам, на пример.[15] Алелниот спектар на ретките и вообичаени варијанти во неврогеномските нарушувања затоа бара потреба од големи кохортни студии со цел ефикасно да бидат исклучени варијантите со низок ефект и да се идентификуваат сеопфатните патишта често мутирани во различните нарушувања, наместо специфичните гени и специфичните мутации со висока пенетрантност.
Секвенционирање на целиот геном и секвенционирање на цели егзомови се користени во студиите за поврзување на ниво на геном за да бидат карактеризирани генетските варијанти поврзани со неврогеномски нарушувања. Сепак, влијанието на овие варијанти не може секогаш да биде потврдено поради неменделовите наследни модели забележани кај неколку од овие нарушувања.[15] Друга забранувачка особина во мрежната анализа е недостатокот на големи групи на податоци за многу душевни (неврогеномски) болести. Бидејќи неколку болести со неврогеномски основи имаат тежнеење да имаат полигенска основа, неколку неспецифични, ретки и делумно продорни отпочеток мутации кај различни пациенти може да придонесат за истиот набљудуван опсег на фенотипови, како што е случајот со нарушувањето на аутистичниот спектар и шизофренијата.[67] Опсежните истражувања за зависноста од алкохол, исто така, ја истакнале потребата за висококвалитетно геномско профилирање на големи множества примероци[68][69] кога се проучувани полигенските нарушувања на спектарот.
Проектот „1000 геноми“ беил успешна демонстрација за тоа како заедничките напори за стекнување на претставителни геномски податоци од широк спектар на луѓе може да резултира со идентификација на биолошки согледувања за различни болести.[70] Сепак, голема иницијатива како оваа сè уште недостасува на полето на неврогеномските нарушувања конкретно.
Прашања со моделирањето на душевните нарушувања во истражување на неврогеномиката
уредиЕдна голема студија на <a href="./Студија_за_асоцијација_на_ниво_на_геном" rel="mw:WikiLink" data-linkid="407" data-cx="{"adapted":false,"sourceTitle":{"title":"Genome-wide association study","thumbnail":{"source":"https://upload.wikimedia.org/wikipedia/commons/thumb/4/4f/Manhattan_plot_from_a_GWAS_of_kidney_stone_disease.png/80px-Manhattan_plot_from_a_GWAS_of_kidney_stone_disease.png","width":80,"height":35},"description":"Study of genetic variants in different individuals","pageprops":{"wikibase_item":"Q1098876"},"pagelanguage":"en"},"targetFrom":"mt"}" class="cx-link" id="mwAbk" title="Студија за асоцијација на ниво на геном">студиите за поврзување на ниво на геном</a> идентификувала 13 нови ризични локуси за шизофренија.[71] Проучувањето на влијанието на овие кандидати идеално би покажало фенотип на шизофренија кај животинските модели, што обично е тешко да биде набљудувано поради неговата манифестација како латентна личност. Овој пристап може да го одреди молекуларното влијание на кандидатскиот ген. Идеално, кандидатските гени би имале невролошко влијание, што пак би наведувало дека тој игра улога во душевното нарушување. На пример, во гореспоменатата шисофрениска студија за поврзување на ниво на геном, Рипке и колегите[71] утврдиле дека овие кандидатски гени се вклучени во сигнализацијата на калциумот. Алтернативно, може да бидат проучени овие варијанти во моделен организми во контекст на засегнатата невролошка функција. Важно е да биде напоменато дека варијантите со висока пенетрантност на овие нарушувања имаат тежнеење да бидат отпочеток мутации.
Понатамошно усложување за проучување на неврогеномните нарушувања е хетерогената природа на нарушувањето. Во многу од овие нарушувања, мутациите забележани од случај до случај не остануваат доследни. Кај аутизмот, засегнатиот поединец може да доживее голема количина на штетни мутации во генот X. Различен засегнат поединец може да нема значајни мутации на генот X, но има голема количина на мутации во генот Y. Алтернативата е да биде утврдено дали генот X и генот Y влијаат на истиот биохемиски пат - оној што влијае на невролошката функција. Анализата на биоинформатичката мрежа е еден пристап кон овој проблем. Методологиите за мрежни анализи обезбедуваат општ системски преглед на молекуларниот пат.
Едно последно усложување што треба да се земе предвид е соболезливоста на неврогеномните гени. Неколку нарушувања, особено на потешките краеви на спектарот имаат тежнеење да бидат соболежливи едни со други. На пример, потешките случаи на спектарот на аутизам имаат тежнеење да бидат поврзани со интелектуална попреченост. Ова го покренува прашањето дали има или не вистински, уникатни гени во спектарот на аутизам и уникатни гени со интелектуална попреченост или дали има само гени поврзани со невролошката функција кои можат да се мутираат во абнормален фенотип. Еден збунувачки фактор може да биде вистинската дијагностичка категорија и методи на нарушувања на спектарот бидејќи симптомите помеѓу тешките нарушувања може да бидат слични. Една студија ги истражувала соболежливите симптоми помеѓу групите на интелектуална попреченост и во спектарот на аутизам и не нашла значајна разлика помеѓу симптомите на децата со интелектуална попреченост, децата со спектарот на аутизам и децата без интелектуална попреченост. Идните истражувања може да помогнат да биде воспоставена построга генетска основа за дијагностицирање на овие нарушувања.
Мрежна анализа
уредиГлавната цел на мрежната анализа во неврогеномиката е да бидат идентификувани статистички значајни неслучајни поврзаности помеѓу гените кои содржат ризични варијанти.[15] Додека неколку применувања на алгоритми на овој пристап веќе постојат,[72][73] општите чекори за анализа на мрежата остануваат исти.
- Аналитичката постапка започнува со идентификација на биолошка мрежа заснована на опитна валидација. Ова може да биде мрежа за соизразување на гени или мрежа за заемодејство помеѓу белковина и белковина. Јазлите на мрежата ќе бидат групирани.
- Последователно, создаден е специфичен список на гени со познати поврзаности за одреден фенотип од интерес. Овој список може да биде определен со опитни податоци, непознати за генетски студии за душевни нарушувања.[15] Ова е нарекува „ударен список“.
- Како такви се означени гените кои припаѓаат на ударниот список, како и биолошката мрежа избрана во првиот чекор.
- Ова е проследено со чекор на вина по поврзаност. Ова значи дека кластерите во рамките на биолошката мрежа кои имаат значителна количина на гени од ударниот список дополнително се истражувани со користење на алатки за функционално збогатување и барање на базата на податоци за патиштата во кои учествуваат овие гени со кластери со висока оценка.[74]
- Така, биолошките поврзаности на членовите на кластерот со високи резултати, опитно вмешани се истражуваат, проширувајќи ја областа за пребарување надвор од почетниот ударен список за да вклучи членови на гени на дополнителни патишта кои може да имаат значителна поврзаност со почетната биолошка мрежа што е разгледувана. Ова резултира со збир на кандидатски гени.[15]
Основното начело на овој пристап е дека гените што се собирани заедно, исто така, заеднички ќе влијаат на истата молекуларна патека. Повторно, тие идеално би биле дел од невролошка функција. Кандидатските гени потоа може да бидат користени за да биде даден приоритет на варијантите за валидација на влажна лабораторија.
Неврофармакологија
уредиИсториски гледано, поради стимулацијата на однесувањето манифестирана како симптом кај неколку неврогеномски нарушувања, терапите најмногу се потпираат на антипсихотици или антидепресиви. Овие класи лекови ќе ги потиснат вообичаените симптоми на нарушувањата, но со сомнителна ефикасност. Најголемата пречка за неврофармакогеномското истражување била големината на групата. Со оглед на новодостапните податоци за секвенционирање на голема група, неодамна имало притисок за проширување на терапевтските можности. Хетерогената природа на невролошките болести е клучната мотивација за поединечните медицински пристапи кон нивните терапии. Ретко е да бидат најдени единечни предизвикувачки гени со висока пенетрантност кај невролошките заболувања. Геномските профили разбирливо варираат помеѓу случаите, и логично, терапите треба да варираат помеѓу случаите. Понатамошно усложување на прашањето е тоа што многу од овие нарушувања се нарушувања на спектарот. Нивната генетска етиологија ќе варира во овој спектар. На пример, тешкиот спектар на аутизам е поврзан со дено мутации со висока пенетрантност. Поблагите облици на спектарот на аутизам обично се поврзувани со мешавина на вообичаени варијанти.
Клучното прашање тогаш е преведувањето на овие новоидентификувани генетски варијанти (од студиите за варијанти на копии на број, секвенционирање на кандидати за ген и технологии за секвенционирање со висока пропусна моќ) во интервенција за пациенти со неврогеномски нарушувања. Еден аспект ќе биде дали невролошкото пореметување е медицински ефективно (т.е. дали постои едноставен метаболички пат што може да го насочи терапијата). На пример, специфични случаи на спектар на аутизам се поврзани со микробришења на генот TMLHE. Овој ген го кодира ензимот на биосинтезата на карнитин. Било сметано дека додатоците за зголемување на нивото на карнитин ублажуваат одредени симптоми на спектарот на аутизам, но студијата била збунувачка од многу фактори кои влијаат. Како што било споменато претходно, користењето пристап на генска мрежа ќе помогне да бидат идентификувани релевантните патишта од интерес. Многу неврофармакогеномски пристапи биле насочени на целење кон долните производи на овие патишта.[75][76]
Крвномозочна пречка
уредиСтудиите на животински модели за неколку мозочни заболувања покажале дека крвномозочната пречка претрпува изменување на многу нивоа; на пример, составот на површинската гликобелковина може да влијае на видовите соеви на ХИВ-1 пренесувани од крвномозочната пречка. Утврдено е дека крвномозочната пречка е клучна во почетокот на Алцхајмеровата болест.[77] Сепак, исклучително е тешко да се биде во можност да биде проучувано ова кај луѓето поради очигледните ограничувања со пристапот до мозокот и извлекувањето на биолошки примероци за секвенционирање или морфолошка анализа. Глувчешките модели со крвномозочната пречка и модели на состојби на болеста добро послужиле во концептуализирањето на крвномозочната пречка како регулаторен посредник помеѓу болеста и доброто здравје во мозокот.
Поединечна невробиологија
уредиХетерогената природа на душевните болести е клучната мотивација за поединечните медицински пристапи кон нивните терапии.[75][76] Геномските примероци на поединечни пациенти може да бидат користат за да бидат идентификувани предвидливи фактори или за подобро разбирање на специфичната прогноза на неврогеномната болест и да бидат користени овие информации за да бидат водени можностите за третман.[78] Иако постои јасна клиничка корист за овој пристап, приспособувањето на овој пристап сè уште не постои.
Постојат различни прашања кои забрануваат примена на поединечна геномика за проценка, дијагноза и третман на психијатриски нарушувања.
- Прво, предизвикувачката мрежна биологија на неколку нарушувања на спектарот со неврогеномски основи сè уште не е целосно разбрана, и покрај обемните студии спроведени со нарушувања како што се спектарот на аутизам[12][42] и шизофренијата.[10] Така, аналитичката валидност на постојните хипотези во врска со етиологијата на неврогеномските нарушувања сè уште не е целосно воспоставена и е предмет на дебата и контроверзии.
- Клиничката валидност на генетските варијанти кои се покажале дека се во голема корелација со специфични душевни нарушувања често е главна причина за загриженост.[78] Толкувањето на овие резултати од тестот и последователното донесување одлуки се сложен потфат со оглед на полигенската природа на многу од овие нарушувања. Понатамошно усложување на работите, било покажано дека спречувачката интервенција кај големите душевни нарушувања не секогаш го намалува ризикот од нарушувањето.[79] Таквата интервенција можеби нема да биде достапна дури и за ризичните потомци на засегнатите возрасни лица, со што ќе се ограничи „медицинската способност“ на податоците.[78]
- Етичките грижи биле покренати и во врска со заштитата на личните геномски информации и како најдобро да се пристапи кон товарот на случајните наоди и проценката на семејниот ризик.
- Сродните односи и меѓусебното размножување може да доведат до одбрано збогатување на ретки, инаку ниската пенетрантност на генетските мутации кои се припишуваат на различни симптоми на неврогеномски нарушувања. Така, толкувањето на генетските мутации специфични за семејството и/или пореметувања на ниво на мрежа при појава на ретко душевно нарушување бара внимателно разгледување на мотивациите на учесниците вклучени во студијата.[78]
- Сепак, овие прашања може да бидат решени со ефективно образование и советување, а собирањето геномски податоци од пациенти со душевни нарушувања не треба да биде дисквалификувано само врз основа на тоа. Самите податоци служат како динамичен здравствен ресурс и можат значително да го унапредат нашето разбирање на геномската основа на неколку душевни нарушувања.
Поврзано
уредиНаводи
уреди- ↑ Boguski, Mark S.; Jones, Allan R. (2004-05-01). „Neurogenomics: at the intersection of neurobiology and genome sciences“. Nature Neuroscience. 7 (5): 429–433. doi:10.1038/nn1232. ISSN 1097-6256. PMID 15114353.
- ↑ 2,0 2,1 Jain, Kewal K. (2013-01-01). „Neurogenetics and Neurogenomics“. Applications of Biotechnology in Neurology (англиски). Humana Press. стр. 7–16. doi:10.1007/978-1-62703-272-8_2. ISBN 9781627032711.
- ↑ Cirelli, Chiara; Tononi, Giulio (1999). „Differences in gene expression during sleep and wakefulness“. Annals of Medicine. 31 (2): 117–124. doi:10.3109/07853899908998787. PMID 10344584.
- ↑ Matthews, Douglas B.; Bhave, Sanjiv V.; Belknap, John K.; Brittingham, Cynthia; Chesler, Elissa J.; Hitzemann, Robert J.; Hoffmann, Paula L.; Lu, Lu; McWeeney, Shannon (2005-09-01). „Complex genetics of interactions of alcohol and CNS function and behavior“. Alcoholism: Clinical and Experimental Research. 29 (9): 1706–1719. doi:10.1097/01.alc.0000179209.44407.df. ISSN 0145-6008. PMID 16205371.
- ↑ Hoffman, Paula L.; Miles, Michael; Edenberg, Howard J.; Sommer, Wolfgang; Tabakoff, Boris; Wehner, Jeanne M.; Lewohl, Joanne (2003-02-01). „Gene expression in brain: a window on ethanol dependence, neuroadaptation, and preference“. Alcoholism: Clinical and Experimental Research. 27 (2): 155–168. doi:10.1097/01.ALC.0000060101.89334.11. ISSN 0145-6008. PMID 12605065.
- ↑ Farris, Sean P.; Miles, Michael F. (2012-01-01). „Ethanol modulation of gene networks: implications for alcoholism“. Neurobiology of Disease. 45 (1): 115–121. doi:10.1016/j.nbd.2011.04.013. ISSN 1095-953X. PMC 3158275. PMID 21536129.
- ↑ Pozhitkov, Alex E.; Boube, Idrissa; Brouwer, Marius H.; Noble, Peter A. (2010-03-01). „Beyond Affymetrix arrays: expanding the set of known hybridization isotherms and observing pre-wash signal intensities“. Nucleic Acids Research. 38 (5): e28. doi:10.1093/nar/gkp1122. ISSN 0305-1048. PMC 2836560. PMID 19969547.
- ↑ Walter, Nicole A. R.; McWeeney, Shannon K.; Peters, Sandra T.; Belknap, John K.; Hitzemann, Robert; Buck, Kari J. (2007-09-01). „SNPs matter: impact on detection of differential expression“. Nature Methods (англиски). 4 (9): 679–680. doi:10.1038/nmeth0907-679. ISSN 1548-7091. PMC 3410665. PMID 17762873.
- ↑ Walter, Nicole A. R.; Bottomly, Daniel; Laderas, Ted; Mooney, Michael A.; Darakjian, Priscila; Searles, Robert P.; Harrington, Christina A.; McWeeney, Shannon K.; Hitzemann, Robert (2009-01-01). „High throughput sequencing in mice: a platform comparison identifies a preponderance of cryptic SNPs“. BMC Genomics. 10: 379. doi:10.1186/1471-2164-10-379. ISSN 1471-2164. PMC 2743714. PMID 19686600.
- ↑ 10,0 10,1 Sullivan PF; Kendler KS; Neale MC (2003-12-01). „Schizophrenia as a complex trait: Evidence from a meta-analysis of twin studies“. Archives of General Psychiatry. 60 (12): 1187–1192. doi:10.1001/archpsyc.60.12.1187. ISSN 0003-990X. PMID 14662550.
- ↑ Smoller, Jordan W.; Finn, Christine T. (2003-11-15). „Family, twin, and adoption studies of bipolar disorder“. American Journal of Medical Genetics Part C. 123C (1): 48–58. CiteSeerX 10.1.1.456.6790. doi:10.1002/ajmg.c.20013. ISSN 1552-4868. PMID 14601036.
- ↑ 12,0 12,1 Rosenberg, Rebecca E.; Law, J. Kiely; Yenokyan, Gayane; McGready, John; Kaufmann, Walter E.; Law, Paul A. (2009-10-01). „Characteristics and concordance of autism spectrum disorders among 277 twin pairs“. Archives of Pediatrics & Adolescent Medicine. 163 (10): 907–914. doi:10.1001/archpediatrics.2009.98. ISSN 1538-3628. PMID 19805709.
- ↑ Frazier, Thomas W.; Thompson, Lee; Youngstrom, Eric A.; Law, Paul; Hardan, Antonio Y.; Eng, Charis; Morris, Nathan (2014-08-01). „A twin study of heritable and shared environmental contributions to autism“. Journal of Autism and Developmental Disorders. 44 (8): 2013–2025. doi:10.1007/s10803-014-2081-2. ISSN 1573-3432. PMC 4104233. PMID 24604525.
- ↑ Boomsma, Dorret; Busjahn, Andreas; Peltonen, Leena (2002-11-01). „Classical twin studies and beyond“ (PDF). Nature Reviews Genetics (англиски). 3 (11): 872–882. doi:10.1038/nrg932. ISSN 1471-0056. PMID 12415317.
- ↑ 15,0 15,1 15,2 15,3 15,4 15,5 15,6 15,7 Sullivan, Patrick F.; Daly, Mark J.; O'Donovan, Michael (2012-08-01). „Genetic architectures of psychiatric disorders: the emerging picture and its implications“. Nature Reviews Genetics (англиски). 13 (8): 537–551. doi:10.1038/nrg3240. ISSN 1471-0056. PMC 4110909. PMID 22777127.
- ↑ 16,0 16,1 16,2 16,3 16,4 Johnson, Keith A.; Fox, Nick C.; Sperling, Reisa A.; Klunk, William E. (2012-04-01). „Brain Imaging in Alzheimer Disease“. Cold Spring Harbor Perspectives in Medicine. 2 (4): a006213. doi:10.1101/cshperspect.a006213. ISSN 2157-1422. PMC 3312396. PMID 22474610.
- ↑ 17,0 17,1 McCarroll, Steven A.; Feng, Guoping; Hyman, Steven E. (2014-06-01). „Genome-scale neurogenetics: methodology and meaning“. Nature Neuroscience. 17 (6): 756–763. doi:10.1038/nn.3716. ISSN 1546-1726. PMC 4912829. PMID 24866041.
- ↑ 18,0 18,1 „Opinion: The Present and Future of Neurogenomics | The Scientist Magazine®“. The Scientist. Посетено на 23 февруари 2024.
- ↑ Malhotra, Dheeraj; Sebat, Jonathan (2012-03-16). „CNVs: harbingers of a rare variant revolution in psychiatric genetics“. Cell. 148 (6): 1223–1241. doi:10.1016/j.cell.2012.02.039. ISSN 1097-4172. PMC 3351385. PMID 22424231.
- ↑ McClellan, Jon; King, Mary-Claire (2010-06-23). „Genomic analysis of mental illness: a changing landscape“. JAMA. 303 (24): 2523–2524. doi:10.1001/jama.2010.869. ISSN 1538-3598. PMID 20571020.
- ↑ Courchesne, E.; Yeung-Courchesne, R.; Press, G. A.; Hesselink, J. R.; Jernigan, T. L. (1988-05-26). „Hypoplasia of cerebellar vermal lobules VI and VII in autism“. The New England Journal of Medicine. 318 (21): 1349–1354. doi:10.1056/NEJM198805263182102. ISSN 0028-4793. PMID 3367935.
- ↑ Courchesne, E.; Karns, C. M.; Davis, H. R.; Ziccardi, R.; Carper, R. A.; Tigue, Z. D.; Chisum, H. J.; Moses, P.; Pierce, K. (2001-07-24). „Unusual brain growth patterns in early life in patients with autistic disorder: an MRI study“. Neurology. 57 (2): 245–254. doi:10.1212/wnl.57.2.245. ISSN 0028-3878. PMID 11468308.
- ↑ Quiroz, Yakeel T.; Schultz, Aaron P.; Chen, Kewei; Protas, Hillary D.; Brickhouse, Michael; Fleisher, Adam S.; Langbaum, Jessica B.; Thiyyagura, Pradeep; Fagan, Anne M. (2015-08-01). „Brain Imaging and Blood Biomarker Abnormalities in Children With Autosomal Dominant Alzheimer Disease: A Cross-Sectional Study“. JAMA Neurology. 72 (8): 912–919. doi:10.1001/jamaneurol.2015.1099. ISSN 2168-6157. PMC 4625544. PMID 26121081.
- ↑ „UC San Diego Autism Center of Excellence“. autism-center.ucsd.edu. Посетено на 23 февруари 2024.
- ↑ Ray, Mohana; Goldstein, Steve; Zhou, Shiguo; Potamousis, Konstantinos; Sarkar, Deepayan; Newton, Michael A; Esterberg, Elizabeth; Kendziorski, Christina; Bogler, Oliver (2013-07-26). „Discovery of structural alterations in solid tumor oligodendroglioma by single molecule analysis“. BMC Genomics (англиски). 14 (1): 505. doi:10.1186/1471-2164-14-505. PMC 3727977. PMID 23885787.
- ↑ Colen, Rivka R.; Vangel, Mark; Wang, Jixin; Gutman, David A.; Hwang, Scott N.; Wintermark, Max; Jain, Rajan; Jilwan-Nicolas, Manal; Chen, James Y. (2014-01-01). „Imaging genomic mapping of an invasive MRI phenotype predicts patient outcome and metabolic dysfunction: a TCGA glioma phenotype research group project“. BMC Medical Genomics. 7: 30. doi:10.1186/1755-8794-7-30. ISSN 1755-8794. PMC 4057583. PMID 24889866.
- ↑ Lipska, Barbara K.; Deep-Soboslay, Amy; Weickert, Cynthia Shannon; Hyde, Thomas M.; Martin, Catherine E.; Herman, Mary M.; Kleinman, Joel E. (2006-09-15). „Critical Factors in Gene Expression in Postmortem Human Brain: Focus on Studies in Schizophrenia“. Biological Psychiatry. 60 (6): 650–658. doi:10.1016/j.biopsych.2006.06.019. PMID 16997002.
- ↑ Stan, Ana D.; Ghose, Subroto; Gao, Xue-Min; Roberts, Rosalinda C.; Lewis-Amezcua, Kelly; Hatanpaa, Kimmo J.; Tamminga, Carol A. (2006-12-06). „Human postmortem tissue: What quality markers matter?“. Brain Research. 1123 (1): 1–11. doi:10.1016/j.brainres.2006.09.025. PMC 1995236. PMID 17045977.
- ↑ Duric, Vanja; Banasr, Mounira; Stockmeier, Craig A.; Simen, Arthur A.; Newton, Samuel S.; Overholser, James C.; Jurjus, George J.; Dieter, Lesa; Duman, Ronald S. (2013-02-01). „Altered expression of synapse and glutamate related genes in post-mortem hippocampus of depressed subjects“. International Journal of Neuropsychopharmacology (англиски). 16 (1): 69–82. doi:10.1017/S1461145712000016. ISSN 1461-1457. PMC 3414647. PMID 22339950.
- ↑ Nagy, Corina; Maheu, Marissa; Lopez, Juan Pablo; Vaillancourt, Kathryn; Cruceanu, Cristiana; Gross, Jeffrey A.; Arnovitz, Mitchell; Mechawar, Naguib; Turecki, Gustavo (2015-05-01). „Effects of Postmortem Interval on Biomolecule Integrity in the Brain“. Journal of Neuropathology & Experimental Neurology (англиски). 74 (5): 459–469. doi:10.1097/NEN.0000000000000190. ISSN 0022-3069. PMID 25868148.
- ↑ Darmanis, Spyros; Sloan, Steven A.; Zhang, Ye; Enge, Martin; Caneda, Christine; Shuer, Lawrence M.; Gephart, Melanie G. Hayden; Barres, Ben A.; Quake, Stephen R. (2015-06-09). „A survey of human brain transcriptome diversity at the single cell level“. Proceedings of the National Academy of Sciences (англиски). 112 (23): 7285–7290. Bibcode:2015PNAS..112.7285D. doi:10.1073/pnas.1507125112. ISSN 0027-8424. PMC 4466750. PMID 26060301.
- ↑ Cicognola, Claudia; Chiasserini, Davide; Parnetti, Lucilla (2015-06-29). „Preanalytical Confounding Factors in the Analysis of Cerebrospinal Fluid Biomarkers for Alzheimer's Disease: The Issue of Diurnal Variation“. Frontiers in Neurology. 6: 143. doi:10.3389/fneur.2015.00143. ISSN 1664-2295. PMC 4483516. PMID 26175714.
- ↑ Rinkwitz, Silke; Mourrain, Philippe; Becker, Thomas S. (2011-02-01). „Zebrafish: an integrative system for neurogenomics and neurosciences“. Progress in Neurobiology. 93 (2): 231–243. doi:10.1016/j.pneurobio.2010.11.003. ISSN 1873-5118. PMID 21130139.
- ↑ Cañestro, Cristian; Postlethwait, John H. (2007-05-15). „Development of a chordate anterior-posterior axis without classical retinoic acid signaling“. Developmental Biology. 305 (2): 522–538. doi:10.1016/j.ydbio.2007.02.032. ISSN 0012-1606. PMID 17397819.
- ↑ Tallafuss, Alexandra; Trepman, Alissa; Eisen, Judith S. (2009-12-01). „DeltaA mRNA and protein distribution in the zebrafish nervous system“. Developmental Dynamics. 238 (12): 3226–3236. doi:10.1002/dvdy.22136. ISSN 1097-0177. PMC 2882441. PMID 19924821.
- ↑ Russek-Blum, Niva; Gutnick, Amos; Nabel-Rosen, Helit; Blechman, Janna; Staudt, Nicole; Dorsky, Richard I.; Houart, Corinne; Levkowitz, Gil (2008-10-01). „Dopaminergic neuronal cluster size is determined during early forebrain patterning“. Development. 135 (20): 3401–3413. doi:10.1242/dev.024232. ISSN 0950-1991. PMC 2692842. PMID 18799544.
- ↑ Reimer, Michell M.; Sörensen, Inga; Kuscha, Veronika; Frank, Rebecca E.; Liu, Chong; Becker, Catherina G.; Becker, Thomas (2008-08-20). „Motor neuron regeneration in adult zebrafish“. The Journal of Neuroscience. 28 (34): 8510–8516. doi:10.1523/JNEUROSCI.1189-08.2008. ISSN 1529-2401. PMC 6671064. PMID 18716209.
- ↑ White, Richard; Rose, Kristin; Zon, Leonard (2013-09-01). „Zebrafish cancer: the state of the art and the path forward“. Nature Reviews Cancer (англиски). 13 (9): 624–636. doi:10.1038/nrc3589. ISSN 1474-175X. PMC 6040891. PMID 23969693.
- ↑ Darland, T.; Dowling, J. E. (2001). „Behavioral screening for cocaine sensitivity in mutagenized zebrafish“. Proc. Natl. Acad. Sci. USA. 98 (20): 11691–11696. Bibcode:2001PNAS...9811691D. doi:10.1073/pnas.191380698. PMC 58791. PMID 11553778.
- ↑ Lockwood, B., Bjerke, S., Kobayashi, K. & Guo, S. "Acute effects of alcohol on larval zebrafish
- ↑ Bourgeron, Thomas (2015-09-01). „From the genetic architecture to synaptic plasticity in autism spectrum disorder“. Nature Reviews Neuroscience (англиски). 16 (9): 551–563. doi:10.1038/nrn3992. ISSN 1471-003X. PMID 26289574.
- ↑ 42,0 42,1 Just, Marcel Adam; Cherkassky, Vladimir L.; Keller, Timothy A.; Kana, Rajesh K.; Minshew, Nancy J. (2007-04-01). „Functional and Anatomical Cortical Underconnectivity in Autism: Evidence from an fMRI Study of an Executive Function Task and Corpus Callosum Morphometry“. Cerebral Cortex (англиски). 17 (4): 951–961. doi:10.1093/cercor/bhl006. ISSN 1047-3211. PMC 4500121. PMID 16772313.
- ↑ Oddi, D.; Crusio, W. E.; D’Amato, F. R.; Pietropaolo, S. (2013-08-15). „Monogenic mouse models of social dysfunction: Implications for autism“. Behavioural Brain Research. SI:Neurobiology of Autism. 251: 75–84. doi:10.1016/j.bbr.2013.01.002. PMID 23327738.
- ↑ Gould, Stephen E.; Junttila, Melissa R.; de Sauvage, Frederic J. (2015-05-01). „Translational value of mouse models in oncology drug development“. Nature Medicine (англиски). 21 (5): 431–439. doi:10.1038/nm.3853. ISSN 1078-8956. PMID 25951530.
- ↑ Jones, CA; Watson, DJG; Fone, KCF (2011-10-01). „Animal models of schizophrenia“. British Journal of Pharmacology. 164 (4): 1162–1194. doi:10.1111/j.1476-5381.2011.01386.x. ISSN 0007-1188. PMC 3229756. PMID 21449915.
- ↑ Mortazavi, Ali; Williams, Brian A.; McCue, Kenneth; Schaeffer, Lorian; Wold, Barbara (2008-07-01). „Mapping and quantifying mammalian transcriptomes by RNA-Seq“. Nature Methods. 5 (7): 621–628. doi:10.1038/nmeth.1226. ISSN 1548-7105. PMID 18516045.
- ↑ 47,0 47,1 47,2 47,3 Muhie, Seid; Gautam, Aarti; Meyerhoff, James; Chakraborty, Nabarun; Hammamieh, Rasha; Jett, Marti (2015-02-28). „Brain transcriptome profiles in mouse model simulating features of post-traumatic stress disorder“. Molecular Brain (англиски). 8 (1): 14. doi:10.1186/s13041-015-0104-3. PMC 4359441. PMID 25888136.
- ↑ Nutt, David J.; Malizia, Andrea L. (2004-01-01). „Structural and functional brain changes in posttraumatic stress disorder“. The Journal of Clinical Psychiatry. 65 (Suppl 1): 11–17. ISSN 0160-6689. PMID 14728092.
- ↑ Lazic, Stanley E; Essioux, Laurent (2013-03-22). „Improving basic and translational science by accounting for litter-to-litter variation in animal models“. BMC Neuroscience. 14: 37. doi:10.1186/1471-2202-14-37. ISSN 1471-2202. PMC 3661356. PMID 23522086.
- ↑ Crawley, Jacqueline N. (2012-09-01). „Translational animal models of autism and neurodevelopmental disorders“. Dialogues in Clinical Neuroscience. 14 (3): 293–305. doi:10.31887/DCNS.2012.14.3/jcrawley. ISSN 1294-8322. PMC 3513683. PMID 23226954.
- ↑ Gotham, Katherine; Bishop, Somer L.; Hus, Vanessa; Huerta, Marisela; Lund, Sabata; Buja, Andreas; Krieger, Abba; Lord, Catherine (2013-02-01). „Exploring the Relationship Between Anxiety and Insistence on Sameness in Autism Spectrum Disorders“. Autism Research (англиски). 6 (1): 33–41. doi:10.1002/aur.1263. ISSN 1939-3806. PMC 4373663. PMID 23258569.
- ↑ Ramasamy, Adaikalavan; Trabzuni, Daniah; Guelfi, Sebastian; Varghese, Vibin; Smith, Colin; Walker, Robert; De, Tisham; UK Brain Expression Consortium; North American Brain Expression Consortium (2014-10-01). „Genetic variability in the regulation of gene expression in ten regions of the human brain“. Nature Neuroscience (англиски). 17 (10): 1418–1428. doi:10.1038/nn.3801. ISSN 1097-6256. PMC 4208299. PMID 25174004.
- ↑ 53,0 53,1 Naumova, Oksana Yu.; Lee, Maria; Rychkov, Sergei Yu.; Vlasova, Natalia V.; Grigorenko, Elena L. (2013-01-01). „Gene Expression in the Human Brain: The Current State of the Study of Specificity and Spatiotemporal Dynamics“. Child Development (англиски). 84 (1): 76–88. doi:10.1111/cdev.12014. ISSN 1467-8624. PMC 3557706. PMID 23145569.
- ↑ 54,0 54,1 Lodato, Michael A.; Woodworth, Mollie B.; Lee, Semin; Evrony, Gilad D.; Mehta, Bhaven K.; Karger, Amir; Lee, Soohyun; Chittenden, Thomas W.; D'Gama, Alissa M. (2015-10-02). „Somatic mutation in single human neurons tracks developmental and transcriptional history“. Science. 350 (6256): 94–98. Bibcode:2015Sci...350...94L. doi:10.1126/science.aab1785. ISSN 1095-9203. PMC 4664477. PMID 26430121.
- ↑ Miller, Jeremy A.; Ding, Song-Lin; Sunkin, Susan M.; Smith, Kimberly A.; Ng, Lydia; Szafer, Aaron; Ebbert, Amanda; Riley, Zackery L.; Royall, Joshua J. (2014-04-10). „Transcriptional landscape of the prenatal human brain“. Nature (англиски). 508 (7495): 199–206. Bibcode:2014Natur.508..199M. doi:10.1038/nature13185. ISSN 0028-0836. PMC 4105188. PMID 24695229.
- ↑ Carroll, Sean B. (април 2003). „Genetics and the making of Homo sapiens“. Nature. 422 (6934): 849–857. doi:10.1038/nature01495. PMID 12712196.
- ↑ Hill, Robert Sean; Walsh, Christopher A. (2005-09-01). „Molecular insights into human brain evolution“. Nature. 437 (7055): 64–67. Bibcode:2005Natur.437...64H. doi:10.1038/nature04103. ISSN 1476-4687. PMID 16136130.
- ↑ 58,0 58,1 Rakic, Pasko (2009-10-01). „Evolution of the neocortex: a perspective from developmental biology“. Nature Reviews Neuroscience (англиски). 10 (10): 724–735. doi:10.1038/nrn2719. ISSN 1471-003X. PMC 2913577. PMID 19763105.
- ↑ Geschwind, Daniel H.; Rakic, Pasko (2013-10-30). „Cortical evolution: judge the brain by its cover“. Neuron. 80 (3): 633–647. doi:10.1016/j.neuron.2013.10.045. ISSN 1097-4199. PMC 3922239. PMID 24183016.
- ↑ Calarco, John A.; Xing, Yi; Cáceres, Mario; Calarco, Joseph P.; Xiao, Xinshu; Pan, Qun; Lee, Christopher; Preuss, Todd M.; Blencowe, Benjamin J. (2007-11-15). „Global analysis of alternative splicing differences between humans and chimpanzees“. Genes & Development. 21 (22): 2963–2975. doi:10.1101/gad.1606907. ISSN 0890-9369. PMC 2049197. PMID 17978102.
- ↑ Zhang, Xiao-Ou; Yin, Qing-Fei; Wang, Hai-Bin; Zhang, Yang; Chen, Tian; Zheng, Ping; Lu, Xuhua; Chen, Ling-Ling; Yang, Li (2014-01-01). „Species-specific alternative splicing leads to unique expression of sno-lncRNAs“. BMC Genomics. 15: 287. doi:10.1186/1471-2164-15-287. ISSN 1471-2164. PMC 4234469. PMID 24734784.
- ↑ Somel, Mehmet; Liu, Xiling; Khaitovich, Philipp (2013-02-01). „Human brain evolution: transcripts, metabolites and their regulators“. Nature Reviews Neuroscience (англиски). 14 (2): 112–127. doi:10.1038/nrn3372. ISSN 1471-003X. PMID 23324662.
- ↑ Qureshi, Irfan A.; Mehler, Mark F. (2012-08-01). „Emerging roles of non-coding RNAs in brain evolution, development, plasticity and disease“. Nature Reviews Neuroscience (англиски). 13 (8): 528–541. doi:10.1038/nrn3234. ISSN 1471-003X. PMC 3478095. PMID 22814587.
- ↑ 64,0 64,1 Geschwind, Daniel H.; Rakic, Pasko (2013-10-30). „Cortical Evolution: Judge the Brain by Its Cover“. Neuron (англиски). 80 (3): 633–647. doi:10.1016/j.neuron.2013.10.045. ISSN 0896-6273. PMC 3922239. PMID 24183016.
- ↑ 65,0 65,1 Enard, Wolfgang (2014-01-01). „Comparative genomics of brain size evolution“. Frontiers in Human Neuroscience. 8: 345. doi:10.3389/fnhum.2014.00345. PMC 4033227. PMID 24904382.
- ↑ Wang, Guang-Zhong; Konopka, Genevieve (2013-06-01). „Decoding human gene expression signatures in the brain“. Transcription. 4 (3): 102–108. doi:10.4161/trns.24885. ISSN 2154-1272. PMC 4042582. PMID 23665540.
- ↑ Kirov, G.; Pocklington, A. J.; Holmans, P.; Ivanov, D.; Ikeda, M.; Ruderfer, D.; Moran, J.; Chambert, K.; Toncheva, D. (2012-02-01). „De novo CNV analysis implicates specific abnormalities of postsynaptic signalling complexes in the pathogenesis of schizophrenia“. Molecular Psychiatry. 17 (2): 142–153. doi:10.1038/mp.2011.154. ISSN 1476-5578. PMC 3603134. PMID 22083728.
- ↑ Bierut, Laura J.; Agrawal, Arpana; Bucholz, Kathleen K.; Doheny, Kimberly F.; Laurie, Cathy; Pugh, Elizabeth; Fisher, Sherri; Fox, Louis; Howells, William (2010-03-16). „A genome-wide association study of alcohol dependence“. Proceedings of the National Academy of Sciences (англиски). 107 (11): 5082–5087. Bibcode:2010PNAS..107.5082B. doi:10.1073/pnas.0911109107. ISSN 0027-8424. PMC 2841942. PMID 20202923.
- ↑ Juraeva, Dilafruz; Treutlein, Jens; Scholz, Henrike; Frank, Josef; Degenhardt, Franziska; Cichon, Sven; Ridinger, Monika; Mattheisen, Manuel; Witt, Stephanie H. (2015-01-01). „XRCC5 as a risk gene for alcohol dependence: evidence from a genome-wide gene-set-based analysis and follow-up studies in Drosophila and humans“. Neuropsychopharmacology. 40 (2): 361–371. doi:10.1038/npp.2014.178. ISSN 1740-634X. PMC 4443948. PMID 25035082.
- ↑ The 1000 Genomes Project Consortium (2015-10-01). „A global reference for human genetic variation“. Nature (англиски). 526 (7571): 68–74. Bibcode:2015Natur.526...68T. doi:10.1038/nature15393. ISSN 0028-0836. PMC 4750478. PMID 26432245.
- ↑ 71,0 71,1 Ripke, Stephan; O'Dushlaine, Colm; Chambert, Kimberly; Moran, Jennifer L.; Kähler, Anna K.; Akterin, Susanne; Bergen, Sarah E.; Collins, Ann L.; Crowley, James J. (2013-10-01). „Genome-wide association analysis identifies 13 new risk loci for schizophrenia“. Nature Genetics. 45 (10): 1150–1159. doi:10.1038/ng.2742. ISSN 1546-1718. PMC 3827979. PMID 23974872.
- ↑ Lee, Phil H.; O'Dushlaine, Colm; Thomas, Brett; Purcell, Shaun M. (2012-07-01). „INRICH: interval-based enrichment analysis for genome-wide association studies“. Bioinformatics. 28 (13): 1797–1799. doi:10.1093/bioinformatics/bts191. ISSN 1367-4811. PMC 3381960. PMID 22513993.
- ↑ Morris, Andrew P; Voight, Benjamin F; Teslovich, Tanya M; Ferreira, Teresa; Segrè, Ayellet V; Steinthorsdottir, Valgerdur; Strawbridge, Rona J; Khan, Hassan; Grallert, Harald (2012-09-01). „Large-scale association analysis provides insights into the genetic architecture and pathophysiology of type 2 diabetes“. Nature Genetics. 44 (9): 981–990. doi:10.1038/ng.2383. ISSN 1061-4036. PMC 3442244. PMID 22885922.
- ↑ Gillis, Jesse; Pavlidis, Paul (2012). „"Guilt by Association" Is the Exception Rather Than the Rule in Gene Networks“. PLOS Computational Biology. 8 (3): e1002444. Bibcode:2012PLSCB...8E2444G. doi:10.1371/journal.pcbi.1002444. PMC 3315453. PMID 22479173.
- ↑ 75,0 75,1 McMahon, Francis J.; Insel, Thomas R. (2012-06-07). „Pharmacogenomics and Personalized Medicine in Neuropsychiatry“. Neuron. 74 (5): 773–776. doi:10.1016/j.neuron.2012.05.004. PMC 3407812. PMID 22681682.
- ↑ 76,0 76,1 Brandler, William M.; Sebat, Jonathan (2015-01-01). „From De Novo Mutations to Personalized Therapeutic Interventions in Autism“. Annual Review of Medicine. 66 (1): 487–507. doi:10.1146/annurev-med-091113-024550. PMID 25587659.
- ↑ Banks, William A. (2010-10-01). „Mouse models of neurological disorders: a view from the blood-brain barrier“. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1802 (10): 881–888. doi:10.1016/j.bbadis.2009.10.011. ISSN 0006-3002. PMC 2891624. PMID 19879356.
- ↑ 78,0 78,1 78,2 78,3 Biesecker, Barbara Bowles; Peay, Holly Landrum (2013-08-01). „Genomic sequencing for psychiatric disorders: Promise and challenge“. The International Journal of Neuropsychopharmacology. 16 (7): 1667–1672. doi:10.1017/S146114571300014X. ISSN 1461-1457. PMC 3703499. PMID 23575420.
- ↑ Bunnik, Eline M; Schermer, Maartje HN; Janssens, A Cecile JW (2012-01-19). „The role of disease characteristics in the ethical debate on personal genome testing“. BMC Medical Genomics (англиски). 5 (1): 4. doi:10.1186/1755-8794-5-4. PMC 3293088. PMID 22260407.