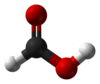
Мравја киселина
Мравја киселина (од латински formica „мравка“), систематски именувана метанска киселина, е наједноставната карбоксилна киселина, и има хемиска формула HCOOH и структура H–C(=O)–O–H. Тој е важен посредник во хемиската синтеза и се јавува во природата, особено кај некои мравки. Естери, соли и анјони добиени од мравја киселина се нарекуваат формати. Индустриски, мравја киселина се произведува од метанол.
| |||

| |||
| Систематско име | Метаноична киселина[1] | ||
Други називи Изојаглеродна киселина | |||
| Назнаки | |||
|---|---|---|---|
| 64-18-6 | |||
| Бајлштајн | 1209246 | ||
| ChEBI | CHEBI:30751 | ||
| ChEMBL | ChEMBL116736 | ||
| ChemSpider | 278 | ||
| DrugBank | DB01942 | ||
| EC-број | 200-579-1 | ||
| 1008 | |||
| |||
| 3Д-модел (Jmol) | Слика | ||
| KEGG | C00058 | ||
| PubChem | 284 | ||
| RTECS-бр. | LQ4900000 | ||
| |||
| Својства | |||
| Хемиска формула | |||
| Моларна маса | 0 g mol−1 | ||
| Изглед | Безбојна запалива течност | ||
| Мирис | Остар, продорен | ||
| Густина | 1,220 g/mL | ||
| Точка на топење | |||
| Точка на вриење | |||
| Мешлива | |||
| Растворливост | Се меша со eтер, ацетон, етил ацетат, глицерол, метанол, етанол Делимно растворлива во бензен, толуен, ксилен | ||
| log P | −0,54 | ||
| Парен притисок | 35 mmHg (20 °C) | ||
| Киселост (pKa) | 3,745[2] | ||
| Конјуг. база | Формат | ||
| −19,90⋅10-6 cm3/mol | |||
| Показател на прекршување (nD) | 1,3714 (20 °C) | ||
| Вискозност | 1,57 cP at 268 °C | ||
| Структура | |||
| Геометрија на молекулата | Планарна | ||
| Диполен момент | 1,41 D (gas) | ||
| Термохемија | |||
| Ст. енталпија на образување ΔfH |
−425,0 kJ/mol | ||
| Ст. енталпија на согорување ΔcH |
−254,6 kJ/mol | ||
| Стандардна моларна ентропија S |
131,8 J/mol K | ||
| Pharmacology | |||
| ATCvet code | QP53AG01 | ||
| Опасност | |||
| Безбедност при работа: | |||
Главни опасности
|
Корозивно; раздразнувач; алергенс | ||
| GHS-ознаки: | |||
Пиктограми
|

| ||
Сигнални зборови
|
Опасност | ||
| NFPA 704 | |||
| Температура на запалување | 69 °C (156 °F; 342 K) | ||
| 601 °C (1,114 °F; 874 K) | |||
| Граници на запалливост | 14–34%[се бара извор] 18–57% (90% раствор) | ||
| Безбедносен лист | MSDS from JT Baker | ||
| Дополнителни податоци | |||
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |||
| Наводи | |||
Природна појава
уредиВо природата, мравјата киселина се наоѓа кај повеќето мравки и кај пчели без осило од родот Oxytrigona.[3][4] Дрвени мравки од родот Formica може да прскаат мравја киселина врз својот плен или да го брани своето гнездо со прскање на киселина. Cerura vinula (молец) може да го испрска својот предатор со мравја киселина. Се наоѓа и во трихомите на убодна коприва (Urtica dioica). Освен тоа, оваа киселина е инкорпорирана во многу овошја како ананас (0,21 mg на 100 g), јаболко (2 mg на 100 g) и киви (1 mg на 100 g), како и во многу зеленчук, имено кромид (45 mg на 100 g), модар патлиџан (1,34 mg на 100 g) и во екстремно ниски концентрации во краставица (0,11 mg на 100 g).[5] Мравјата киселина е природна компонента на атмосфера првенствено поради емисиите од шумите.[6]
Историја
уредиНекои алхемичари и натуралисти биле свесни дека ројот од мравките испуштаат кисела пареа уште во 15 век. Првиот човек што ја опишал изолацијата на оваа супстанца (со дестилација на голем број мравки) бил англискиот натуралист Џон Реј, во 1671 г.[7][8] Мравките лачат мравја киселина и за напад и за одбранбени цели. Мравја киселина првпат била синтетизирана од цијановодородна киселина од францускиот хемичар Жозеф Геј-Лусак. Во 1855 година, друг француски хемичар, Marcellin Berthelot, развил синтеза од јаглерод моноксид слична на процесот што се користи денес.
Мравја киселина долго време се сметала за хемиско соединение од мал интерес во хемиската индустрија. Меѓутоа, во доцните 1960-ти, значителни количини станале достапни како нуспроизвод од производството на оцетна киселина. Сега се повеќе се користи како конзерванс и антибактериско средство во добиточната храна.
Својства
уредиМравјата киселина е безбојна течност со лут, продорен мирис[9] на собна температура, споредливо со оцетната киселина.Мравјата киселина е околу десет пати посилна од оцетната киселина.
Мравјата киселина е мешлива со вода и повеќето поларни органски растворувач, а е малку растворлива во јаглеводороди. Во јаглеводородите и во фазата на пареа, се состои од водородни врски димери наместо од поединечни молекули.[10][11] Поради својата склоност кон водородна врска, мравјата киселина во гасовита фаза не го почитува законот за идеален гас.[11] Solid formic acid, which can exist in either of two polymorphs, consists of an effectively endless network of hydrogen-bonded formic acid molecules. Formic acid forms a high-boiling azeotrope with water (22.4%). Liquid formic acid tends to supercool.
Хемиски реакции
уредиРаспаѓање
уредиМравјата киселина лесно се распаѓа со дехидрација во присуство на концентрирана сулфурна киселина за да формира јаглерод моноксид и вода:
- HCO2H → H2O + CO
Третманот на мравја киселина со сулфурна киселина е пригоден лабораториски извор на CO.[12][13]
Во присуство на платина, таа се распаѓа со ослободување на водород и јаглерод диоксид.
- HCO2H → H2 + CO2
Растворливите катализатори на рутениум се исто така ефикасни.[14][15] Јглероден моноксид без водород е генериран во многу широк опсег на притисок (1-600 бари).[14]
Реактант
уредиМравјата киселина ги дели повеќето хемиски својства на другите карбоксилни киселини. Поради високата киселост, растворите на мравската киселина со алкохоли спонтано формираат естри. Мравјата киселина дели некои од редукционите својства на алдехидите, редуцирајќи ги растворите на метални оксиди на нивниот соодветен метал.[16]
Мравјата киселина е извор за формил група, на пример во формилација на метиланилин до N-метилформанилид во толуен.[17]
Во синтетичката органска хемија, мравјата киселина често се користи како извор на хидриден јон, како во Ешвајлер-Кларковата реакција:
Се користи како извор на водород во трансфер хидрогенизација, како во Леукарт реакција за да се направат амини и (во воден раствор или во неговиот азеотроп со триетиламин) за хидрогенизација на кетони.[18]
Додаток на алкени
уредиМравјата киселина, е единствена меѓу карбоксилните киселини, во нејзината способност да учествува во адитивни реакции со алекни. Мравјата киселини и алкените лесно реагираат за да формираат формат естери. Меѓутоа, во присуство на одредени киселини, вклучувајќи сулфурна и флуороводородна киселина, наместо тоа, се јавува варијанта на Кoch реакција, а мравјата киселина се додава во алкенот за да произведе поголема карбоксилна киселина.[19]
Анхидрид на мравја киселина
уредиНестабилен анхидрид на мравја киселина, H(C=O)-O−(C=O)H, може да се добие со дехидрација на мравјата киселина со N,' 'N′'-дициклохексилкарбодиимид во етер на ниска температура.[20]
Продукција
уредиВо 2009 година, светскиот капацитет за производство на мравја киселина бил 720 000 тони годишно, приближно подеднакво поделен меѓу Европа, (350 000 тони се главно во Германија) и Азија, (370 000 тони се главно во Кина) додека производството во другите земјите на другите контитенти се движело околу 1000 до 2,2 милиони тони годишно.[21] Комерцијално е достапен во раствори со различни концентрации помеѓу 85 и 99 w/w %.[10] Од 2009 година, најголеми производители се BASF, Eastman Chemical Company, LC Industrial и Feicheng Acid Chemicals, со најголеми производствени капацитети во Лудвигсхафен (200 илјади тони годишно, БАСФ, Германија), Оулу (105 илјади тони, Истман, Финска), Након Патом и Фејченг (100 илјади тони или, Фејченг, Кина). Цените во 2010 година се движеле од околу 650 евра/тон (еквивалент на околу 800 долари/тон) во Западна Европа до 1250 долари/тон во Соединетите Држави.[21]
Од метил формат и формамид
уредиКога метанол и јаглерод моноксид се комбинираат во присуство на силна основа, резултатот е метил формат, според хемиската равенка:[10]
- CH3OH + CO → HCO2CH3
Во индустријата, оваа реакција се изведува во течна фаза при покачен притисок. Типични услови за реакција се 80 °C и 40 atm. Најшироко користена база е натриум метоксид. Хидролиза на метил формат произведува мравја киселина:
- HCO2CH3 + H2O → HCOOH + CH3OH
Ефикасната хидролиза на метил формат бара голем вишок на вода. Некои патишта продолжуваат индиректно така што прво го третираат метил форматот со амонијак за да се добие формамид, кој потоа се хидролизира со сулфурна киселина:
- HCO2CH3 + NH3 → HC(O)NH2 + CH3OH
- 2 HC(O)NH2 + 2H2O + H2SO4 → 2HCO2H + (NH4)2SO4
Недостатокот на овој пристап е потребата од отстранување на нуспроизводот амониум сулфат. Овој проблем доведува до тоа некои производители да развијат енергетски ефикасни методи за одвојување на мравја киселина од вишокот вода што се користи при директна хидролиза. Во еден од овие процеси, користени од BASF, мравја киселина се отстранува од водата со течно-течна екстракција со органска база.
Нус-производ на производство на оцетна киселина
уредиЗначителна количина на мравјата киселина се произведува како нуспроизвод во производството на други хемикалии. Едно време, оцетна киселина била произведувана во голем обем со оксидација на алкани, со процес кој когенерира мравја киселина.[10] Овој оксидативен пат до оцетна киселина се намалил во важноста, така што гореспоменатите патишта до мравја киселина станале поважни.
Хидрогенизација на јаглерод диоксид
уредиКаталитичката хидрогенизација на CO2 во мравја киселина е долго време проучувана. Оваа реакција може да се спроведе хомогено.[22][23]
Оксидација на биомаса
уредиМравјата киселина може да се добие и со водена каталитичка парцијална оксидација на влажна биомаса со процесот OxFA .[24][25] Кегин-тип полиоксометалат (H5PV2Mo10O40) се користи како хомоген катализатор за претворање на шеќери, дрво, отпадна хартија или цијанобактерии во мравја киселина и CO2 како единствен нуспроизвод. Може да се постигнат приноси до 53% мравја киселина.
Лабораториски методи
уредиВо лабораторија, мравјата киселина може да се добие со загревање на оксална киселина во глицерол и екстракција со дестилација со пареа.[26] Глиcеролот делува како катализатор, бидејќи реакцијата се одвива преку глицерил оксалат посредник. Ако реакционата смеса се загрее на повисоки температури, се добива алил алкохол. Нето реакцијата е следна:
- C2O4H2 → HCO2H + CO2
Друг метод ја вклучува реакцијата помеѓу олово формат и водород сулфид, поттикната од формирањето на олово сулфид.[27]
- Pb(HCOO)2 + H2S → 2HCOOH + PbS
Електрохемиско производство
уредиПријавено е дека форматот може да се формира со електрохемиска редукција на CO2 (во форма на бикарбонат) на оловна катода при pH 8,6:[28]
- HCO−
3 + H2O + 2e− → HCO−
2 + 2OH−
or
- CO2 + H2O + 2e− → HCO−
2 + OH−
Вештачка фотосинтеза
уредиВо август 2020 година, истражувачите од Универзитетот во Кембриџ објавиле самостојна напредна технологија за „фотолист“ што ги претвора сончевата светлина, јаглеродниот диоксид и водата во кислород и мравја киселина.[29]
Биосинтеза
уредиМравјата киселина е именувана по мравките кои имаат високи концентрации на соединението во нивниот отров. Кај мравките, мравја киселина се добива од серин преку 5,10-метенилтетрахидрофолат како посредник.[30] Коњугираната база на мравја киселина, формат, исто така широко се јавува во природата. Анализата за мравја киселина во телесните течности, дизајнирана за одредување на формат по труење со метанол, се заснова на реакцијата на формат со бактериска формат дехидрогеназа.[31]
Употреба
уредиАгрокултура
уредиГлавната употреба на мравјата киселина е како конзерванс и антибактериски агенс во добиточната храна. Во Европа, се применува на силажа, вклучително и свежо сено, за да се промовира ферментацијата на млечната киселина и да се потисне формирањето на бутиронската киселина; исто така овозможува ферментацијата да се случи брзо, и на пониска температура, со што се намалува губењето на хранливата вредност.[10] Мравјата киселина запира одредени процеси на распаѓање и предизвикува добиточната храна да ја задржи својата хранлива вредност подолго, и затоа е широко користена за зачувување на зимската храна за говеда.[32] Во живинарската индустрија, понекогаш се додава во храната за живината за да се убијат бактерии како E. coli.[33][34] Употребата како конзерванс за силажа и (друга) добиточна храна сочинувала 30% од глобалната потрошувачка во 2009 година.[21]
Пчеларите користи мравја киселина како митицид против Acarapis woodi, Varroa destructor и Varroa jacobsoni грини.[35]
Енергија
уредиМравјата киселина може да се користи во горивни ќелии (директно во горивни ќелии на мравја киселина или индиректно во водородни горивни ќелии) .[36][37]
Електролитичката конверзија на електричната енергија во хемиско гориво е предложена како извор на формат од големи размери од различни групи.[38] The formate could be used as feed to modified E. coli bacteria for producing biomass.[39][40] Постојат природни микроби кои можат да се хранат со мравја киселина или формат (види Methylotroph).
Мравјата киселина се смета за средство за складирање на водород.[41] Ко-производот од ова распаѓање, јаглерод диоксид, може да се рехидрогенизира назад во мравја киселина во вториот чекор. Мравјата киселина содржи 53 g/L водород на собна температура и атмосферски притисок, што е три и пол пати повеќе отколку што компримираниот водороден гас може да достигне при притисок од 350 бари (14,7 g/L). Чистата мравја киселина е течност со точка на палење од +69 °C, многу повисока од онаа на бензинот (&минус;40 °C) или етанолот (+13 °C).
Можно е да се користи мравја киселина како посредник за производство на изобутанол од CO
2 користејќи микроби.[42][43]
Лемење
уредиМравјата киселина има потенцијална примена во лемењето. Поради неговиот капацитет да ги намалува оксидните слоеви, гасот од мравја киселина може да се разнесе на оксидна површина за да се зголеми навлажнувањето при лемење.
Хроматографија
уредиМравја киселина се користи како испарлив модификатор на pH во HPLC и капиларна електрофореза. Мравјата киселина често се користи како компонента на мобилната фаза во обратна фаза течна хроматографија со високи перформанси (RP-HPLC) анализа и техники на сепарација за одвојување на хидрофобни макромолекули, како на пр. пептиди, белковини и посложени структури вклучувајќи непроменети вируси. Особено кога е поврзана со детектор на масена спектрометрија, мравја киселина нуди неколку предности во однос на традиционално користената фосфорна киселина.[44][45]
Друга употреба
уредиМравјата киселина, исто така, значително се користи во производството на кожа, вклучително и потемнување на кожа (23% од глобалната потрошувачка во 2009 г.[21]) и во боење и доработка на текстил (9% од глобалната потрошувачка во 2009 г.[21]) поради нејзината кисела природа. Додека употребата како коагуланс во производството на гума, зафатило 6% од глобалното производство во 2009 година.[10][21]
Мравјата киселина исто така се користи како замена за неорганските киселини за разни производи за чистење,[10] како што се варовник отстранувач и чистач за тоалетни шолја. Некои форматни естри се вештачки ароми и парфеми.
Заштита
уредиМравјата киселина има ниска токсичност (оттука и се користи како додаток на храна), со LD50 од 1,8 g/kg (тестиран орално на глувци). Концентрираната киселина е корозивна за кожата.[10]
Мравјата киселина лесно се метаболизира и се елиминира од телото. Сепак, има специфични токсични ефекти; мравјата киселина и фомралдехидот произведени како метаболити на метанол се одговорни за оштетувањето на оптичкиот нерв, предизвикувајќи слепило, забележано со труење со метанол.[46] Документирани се некои хронични ефекти од изложеноста на мравјата киселина. Некои експерименти на бактериски видови покажале дека е мутаген.[47] Хроничната изложеност кај луѓето може да предизвика оштетување на бубрезите.[47] Друг можен ефект од хроничното изложување е развој на кожна алергија што се манифестира при повторна изложеност на хемикалија.
Концентрираната мравја киселина полека се распаѓа до јаглерод моноксид и вода, што доведува до акумулација на притисок во садот што ја содржи. Поради оваа причина, 98% од мравјата киселина се испорачува во пластични шишиња со капачиња што сами се вентилираат.
Опасноста од растворите на мравја киселина зависи од концентрацијата. Следната табела го наведува Глобалниот хармонизиран систем за класификација и означување на хемикалии за раствори на мравја киселина:
| Концентрација (тежински проценти) | Пиктограм | H-Фрази |
|---|---|---|
| 2–10% | H315 | |
| 10–90% | H313 | |
| >90% | H314 |
Мравјата киселина во концентрација од 85% е запалива, а разредената мравја киселина е на списокот на прехранбени адитиви на Управата за храна и лекови на САД. Главната опасност од мравја киселина е од контакт со кожата или очите со концентрирана течност или пареа. Американската OSHA изнела дека дозволеното ниво на изложеност (PEL) на пареата на мравја киселина во работната средина е 5 милионити дел од воздухот (ppm).
Поврзано
уредиНаводи
уреди- ↑ 1,0 1,1 Favre, Henri A.; Powell, Warren H. (2014). Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. стр. 745. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ↑ Smith, Robert M.; Martell, Arthur E. (1989). Critical Stability Constants Volume 6: Second Supplement. New York: Plenum Press. стр. 299. ISBN 0-306-43104-1.
- ↑ Hoffman, Donald R (2010). „Ant venoms“. Current Opinion in Allergy and Clinical Immunology. 10 (4): 342–6. doi:10.1097/ACI.0b013e328339f325. PMID 20445444. S2CID 4999650.
- ↑ Roubik, DW; Smith, BH; Carlson, RG (1987). „Formic acid in caustic cephalic secretions of stingless bee,Oxytrigona (Hymenoptera: Apidae)“. J Chem Ecol. 13 (5): 1079–86. doi:10.1007/BF01020539. PMID 24302133. S2CID 30511107.
- ↑ Otles, S; Yalcin, B (2012). „Phenolic compounds analysis of root, stalk, and leaves of nettle“. ScientificWorldJournal. 2012: 564367. doi:10.1100/2012/564367. PMC 3349212. PMID 22593694.
- ↑ Sanhueza, Eugenio; Andreae, Meinrat O (1991). „Emission of formic and acetic acids from tropical Savanna soils“. Geophysical Research Letters. 18 (9): 1707–10. Bibcode:1991GeoRL..18.1707S. doi:10.1029/91GL01565.
- ↑ Wray, J (1670). „Extract of a Letter, Written by Mr John Wray to the Publisher January 13. 1670. Concerning Some Un-Common Observations and Experiments Made with an Acid Juyce to be Found in Ants“. Philosophical Transactions of the Royal Society of London. 5 (57–68): 2063–2066. Bibcode:1670RSPT....5.2063W. doi:10.1098/rstl.1670.0052.
- ↑ Johnson, W. B. (1803). History of the process and present state of animal chemistry.
- ↑ „OSHA Occupational Chemical Database – Occupational Safety and Health Administration“. osha.gov. Архивирано од изворникот на 29 April 2021. Посетено на 17 April 2015.
- ↑ 10,0 10,1 10,2 10,3 10,4 10,5 10,6 10,7 Reutemann, Werner; Kieczka, Heinz (2000). „Formic Acid“. Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a12_013. ISBN 978-3-527-30673-2.
- ↑ 11,0 11,1 Roman M. Balabin (2009). „Polar (Acyclic) Isomer of Formic Acid Dimer: Gas-Phase Raman Spectroscopy Study and Thermodynamic Parameters“. The Journal of Physical Chemistry A. 113 (17): 4910–8. Bibcode:2009JPCA..113.4910B. doi:10.1021/jp9002643. PMID 19344174.
- ↑ Koch, H.; Haaf, W. (1973). „1-Adamantanecarboxylic Acid“. Organic Syntheses.; Collective Volume, 5, стр. 20
- ↑ G. H. Coleman, David Craig (1943). „p-Tolualdehyde“. Organic Syntheses.; Collective Volume, 2, стр. 583
- ↑ 14,0 14,1 Fellay, Céline; Dyson, Paul J.; Laurenczy, Gábor (2008). „A Viable Hydrogen-Storage System Based on Selective Formic Acid Decomposition with a Ruthenium Catalyst“. Angewandte Chemie International Edition. 47 (21): 3966–8. doi:10.1002/anie.200800320. PMID 18393267.
- ↑ G. Laurenczy, C. Fellay, P. J. Dyson, Hydrogen production from formic acid. PCT Int. Appl. (2008), 36pp. CODEN: PIXXD2 WO 2008047312 A1 20080424 AN 2008:502691
- ↑ Ozawa, Naoto; Okubo, Tatsuo; Matsuda, Jun; Sakai, Tatsuo (October 2016). „Observation and analysis of metal oxide reduction by formic acid for soldering“. 2016 11th International Microsystems, Packaging, Assembly and Circuits Technology Conference (IMPACT): 148–151. doi:10.1109/IMPACT.2016.7799990. ISBN 978-1-5090-4769-7. S2CID 32545113.
- ↑ L. F. Fieser; J. E. Jones (1955). „N-Methylformanilide“. Organic Syntheses.; Collective Volume, 3, стр. 590
- ↑ Zhou, Xiaowei; и др. (2012). „Varying the ratio of formic acid to triethylamine impacts on asymmetric transfer hydrogenation of ketones“. Journal of Molecular Catalysis A: Chemical. 357: 133–140. doi:10.1016/j.molcata.2012.02.002. ISSN 1381-1169.
- ↑ Haaf, Wolfgang (1966). „Die Synthese sekundärer Carbonsäuren nach der Ameisensäure-Methode“. Chemische Berichte. 99 (4): 1149–52. doi:10.1002/cber.19660990410.
- ↑ Wu, G; Shlykov, S; Van Alseny, F. S; Geise, H. J; Sluyts, E; Van Der Veken, B. J (1995). „Formic Anhydride in the Gas Phase, Studied by Electron Diffraction and Microwave and Infrared Spectroscopy, Supplemented with Ab-Initio Calculations of Geometries and Force Fields“. The Journal of Physical Chemistry. 99 (21): 8589–98. doi:10.1021/j100021a022.
- ↑ 21,0 21,1 21,2 21,3 21,4 21,5 S. N. Bizzari; M. Blagoev (June 2010). „CEH Marketing Research Report: FORMIC ACID“. Chemical Economics Handbook. SRI consulting. Архивирано од изворникот на 14 September 2011.
- ↑ P. G. Jessop (2007). J. G. de Vries, C. J. Elsevier (уред.). Handbook of Homogeneous Hydrogenation. Weinheim, Germany: Wiley-VCH. стр. 489–511.
- ↑ Jessop, Philip G; Joó, Ferenc; Tai, Chih-Cheng (2004). „Recent advances in the homogeneous hydrogenation of carbon dioxide“. Coordination Chemistry Reviews. 248 (21–24): 2425. doi:10.1016/j.ccr.2004.05.019.
- ↑ Wölfel, Rene; Taccardi, Nicola; Bösmann, Andreas; Wasserscheid, Peter (2011). „Selective catalytic conversion of biobased carbohydrates to formic acid using molecular oxygen“. Green Chemistry. 13 (10): 2759. doi:10.1039/C1GC15434F. S2CID 97572039.
- ↑ Albert, Jakob; Wölfel, Rene; Bösmann, Andreas; Wasserscheid, Peter (2012). „Selective oxidation of complex, water-insoluble biomass to formic acid using additives as reaction accelerators“. Energy & Environmental Science. 5 (7): 7956. doi:10.1039/C2EE21428H. S2CID 93224286.
- ↑ Chattaway, Frederick Daniel (1914). „XX.—Interaction of glycerol and oxalic acid“. Journal of the Chemical Society, Transactions. 105: 151–6. doi:10.1039/CT9140500151. hdl:2027/mdp.39015067135775.
- ↑ Arthur Sutcliffe (1930). Practical Chemistry for Advanced Students (1949. изд.). London: John Murray.
- ↑ B. Innocent; и др. (Feb 2009). „Electro-reduction of carbon dioxide to formate on lead electrode in aqueous medium“. Journal of Applied Electrochemistry. 39 (2): 227–232. doi:10.1007/s10800-008-9658-4. S2CID 98437382.
- ↑ Sampson, Joanna (2 August 2020). „Wireless device makes clean fuel from sunlight, CO2 and water“. Gasworld (англиски). Посетено на 2020-08-26.
- ↑ Hefetz, Abraham; Blum, Murray (1 November 1978). „Biosynthesis of formic acid by the poison glands of formicine ants“. Biochimica et Biophysica Acta (BBA) - General Subjects. 543 (4): 484–496. doi:10.1016/0304-4165(78)90303-3. PMID 718985.
- ↑ Makar, A.B; McMartin, K.E; Palese, M; Tephly, T.R (1975). „Formate assay in body fluids: Application in methanol poisoning“. Biochemical Medicine. 13 (2): 117–26. doi:10.1016/0006-2944(75)90147-7. PMID 1.
- ↑ Organic Acids and Food Preservation, Maria M. Theron, J. F. Rykers Lues
- ↑ Griggs, J. P; Jacob, J. P (2005). „Alternatives to Antibiotics for Organic Poultry Production“. The Journal of Applied Poultry Research. 14 (4): 750. doi:10.1093/japr/14.4.750.
- ↑ Garcia, V; Catala-Gregori, P; Hernandez, F; Megias, M. D; Madrid, J (2007). „Effect of Formic Acid and Plant Extracts on Growth, Nutrient Digestibility, Intestine Mucosa Morphology, and Meat Yield of Broilers“. The Journal of Applied Poultry Research. 16 (4): 555. doi:10.3382/japr.2006-00116.
- ↑ Hoppe, H.; Ritter, W.; Stephen, E. W. C. (1989). „The control of parasitic bee mites: Varroa jacobsoni, Acarapis woodi and Tropilaelaps clareae with formic acid“. American Bee Journal.
- ↑ Ha, S; Larsen, R; Masel, R.I (2005). „Performance characterization of Pd/C nanocatalyst for direct formic acid fuel cells“. Journal of Power Sources. 144 (1): 28–34. Bibcode:2005JPS...144...28H. doi:10.1016/j.jpowsour.2004.12.031.
- ↑ Jorn Madslien (27 June 2017). „Ant power: Take a ride on a bus that runs on formic acid“. BBC News. Посетено на 11 July 2017.
- ↑ Yishai, Oren; Lindner, Steffen N; Gonzalez de la Cruz, Jorge; Tenenboim, Hezi; Bar-Even, Arren (December 2016). „The formate bio-economy“. Current Opinion in Chemical Biology (англиски). 35: 1–9. doi:10.1016/j.cbpa.2016.07.005. PMID 27459678.
- ↑ Shmuel Gleizer; и др. (Nov 2019). „Conversion of Escherichia coli to Generate All Biomass Carbon from CO2“. Cell. 179 (6): 1255–1263.e12. doi:10.1016/j.cell.2019.11.009. PMC 6904909. PMID 31778652.
- ↑ Kim, Seohyoung; Lindner, Steffen N.; Aslan, Selçuk; Yishai, Oren; Wenk, Sebastian; Schann, Karin; Bar-Even, Arren (2020-02-10). „Growth of E. coli on formate and methanol via the reductive glycine pathway“. Nature Chemical Biology (англиски). 16 (5): 538–545. doi:10.1038/s41589-020-0473-5. ISSN 1552-4469. PMID 32042198. S2CID 211074951.
- ↑ Joó, Ferenc (2008). „Breakthroughs in Hydrogen Storage-Formic Acid as a Sustainable Storage Material for Hydrogen“. ChemSusChem. 1 (10): 805–8. doi:10.1002/cssc.200800133. PMID 18781551.
- ↑ „UCLA Researchers Use Electricity and CO2 to Make Butanol“. 30 March 2012.
- ↑ Liao, James C.; Cho, Kwang Myung; Huo, Yi-Xin; Malati, Peter; Higashide, Wendy; Wu, Tung-Yun; Rogers, Steve; Wernick, David G.; Opgenorth, Paul H.; Li, Han (30 March 2012). „Integrated Electromicrobial Conversion of CO2 to Higher Alcohols“. Science. 335 (6076): 1596. Bibcode:2012Sci...335.1596L. doi:10.1126/science.1217643. PMID 22461604. S2CID 24328552.
- ↑ „Архивиран примерок“. Архивирано од изворникот на 7 November 2017. Посетено на 7 November 2017.
- ↑ Heukeshoven, Jochen; Dernick, Rudolf (1982). „Reversed-phase high-performance liquid chromatography of virus proteins and other large hydrophobic proteins in formic acid containing solvents“. Journal of Chromatography A. 252: 241–54. doi:10.1016/S0021-9673(01)88415-6. PMID 6304128.
- ↑ Sadun, A. A (2002). „Mitochondrial optic neuropathies“. Journal of Neurology, Neurosurgery, and Psychiatry. 72 (4): 423–5. doi:10.1136/jnnp.72.4.423. PMC 1737836. PMID 11909893.
- ↑ 47,0 47,1 „Occupational Safety and Health Guideline for Formic Acid“. OSHA. Архивирано од изворникот на 20 September 2011. Посетено на 28 May 2011.
Надворешни врски
уреди| „Мравја киселина“ на Ризницата ? |