Натриум нитрит
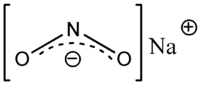
Натриум нитрит е неорганско соединение со хемиска формула NaNO2. Тоа е бел до малку жолтеникав кристален прав кој е многу растворлив во вода и е хигроскопен. Од индустриска перспектива, таа е најважната нитритна сол. Тој е прекурсор на различни органски соединенија, како што се фармацевтски производи, бои и пестициди, но веројатно е најдобро познат како додаток на храна што се користи во преработеното месо и (во некои земји) во производите од риба.[3]

| |||
| |||
| |||
 Единечна ќелија на натриум нитрит под стандардни услови.
| |||
| Назнаки | |||
|---|---|---|---|
| 7632-00-0 | |||
| ChEBI | CHEBI:78870 | ||
| ChEMBL | ChEMBL93268 | ||
| ChemSpider | 22689 | ||
| EC-број | 231-555-9 | ||
| |||
| 3Д-модел (Jmol) | Слика | ||
| KEGG | D05865 | ||
| PubChem | 23668193 | ||
| RTECS-бр. | RA1225000 | ||
| |||
| UNII | M0KG633D4F | ||
| ОН-бр. | 1500 3287 | ||
| Својства | |||
| Хемиска формула | |||
| Моларна маса | 0 g mol−1 | ||
| Изглед | бела или малку жолтеникава цврста супстанца | ||
| Густина | 2.168 g/cm3 | ||
| Точка на топење | |||
| 71.4 g/100 mL (0 °C) 84.8 g/100 mL (25 °C) 160 g/100 mL (100 °C) | |||
| Растворливост | растворлив во метанол (4.4 g/100 mL) етанол малку растворлив во диетил етер (0.3 g/100 mL) многу растворлив во амонијак | ||
| Киселост (pKa) | ~9 | ||
| −14.5·10−6 cm3/mol | |||
| Показател на прекршување (nD) | 1.65 | ||
| Структура | |||
| Кристална структура | орторомбичен | ||
| Im2m | |||
| Термохемија | |||
| Ст. енталпија на формирање ΔfH |
−359 kJ/mol[1] | ||
| Стандардна моларна ентропија S |
106 J/mol K | ||
| Pharmacology | |||
| ATC код | V03AB08 | ||
| Опасност | |||
| GHS-ознаки:[2] | |||
Пиктограми
|
  
| ||
Сигнални зборови
|
Опасност | ||
Изјави за опасност
|
H272, H301, H319, H400 | ||
Изјави за претпазливост
|
P220, P273, P301+P310, P305+P351+P338 | ||
| NFPA 704 | |||
| 489 °C (912 °F; 762 K) | |||
| Смртоносна доза или концентрација: | |||
LD50 (средна доза)
|
180 mg/kg (стаорец, орално) | ||
| Безбедносен лист | External MSDS | ||
| Слични супстанци | |||
| Други анјони | Натриум нитрат | ||
| Други катјони | Калиум нитрат Амониум нитрат Литиум нитрат | ||
| Дополнителни податоци | |||
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |||
| Наводи | |||
Употреба уреди
Индустриска хемија уреди
Главната употреба на натриум нитрит е за индустриско производство на органонитрогени соединенија. Тоа е реагенс за конверзија на амини во диазо соединенија, кои се клучни претходници на многу бои, како што се диазо боите. Нитросо соединенијата се произведуваат од нитрити. Тие се користат во индустријата за гума.[3]
Се користи во различни металуршки примени, за фосфатирање и детинирање.[3]
Натриум нитритот е ефикасен инхибитор на корозија и се користи како додаток во индустриските масти,[4] како воден раствор во системи за ладење со затворена јамка и во стопена состојба како медиум за пренос на топлина.[5]
Додаток за храна и конзерванс уреди
Натриум нитрит се користи за забрзување на стврднувањето на месото и исто така дава привлечна розова боја.[6][7] Нитритот реагира со миоглобинот од месото и предизвикува промени во бојата, прво се претвора во нитрозомиоглобин (светло црвен), а потоа, при загревање, во нитрозохемохром (розов пигмент).[8]
Историски гледано, солта се користела за зачувување на месото. Месниот производ зачуван со сол обично имал кафеаво-сива боја. Кога ќе се додаде натриум нитрит со солта, месото добива црвена, а потоа розова боја, која е поврзана со сувомеснато како шунка, сланина, виршли и болоња.[9]
Во раните 1900-ти, нередовното лекување беше вообичаено. Ова доведе до понатамошни истражувања околу употребата на натриум нитрит како додаток во храната, стандардизирајќи ја количината присутна во храната за да се минимизира потребната количина додека ја максимизираше неговата улога како додаток на храната.[10] Преку ова истражување, откриено е дека натриум нитритот му дава вкус и боја на месото и ја инхибира оксидацијата на липидите што доведува до труење, со различни степени на ефикасност за контролирање на растот на микроорганизмите што предизвикуваат болести.[10] Способноста на натриум нитритот да ги реши горенаведените прашања доведе до производство на месо со продолжен рок на складирање и ја подобри посакуваната боја и вкус. Според научниците кои работат за месната индустрија,[11] нитритот ја подобрил безбедноста на храната.[10] Овој став е оспорен во светлината на неговата неефикасност против ботулизмот и можните канцерогени ефекти предизвикани од додавање нитрити во месото.[6]
Нитритот има Е број E250. На ист начин се користи и калиум нитрит (Е249). Тој е одобрен за употреба во ЕУ,[12][13] САД[14] и Австралија и Нов Зеланд.[15]
Во преработката на месо, натриум нитрит никогаш не се користи во чиста состојба, туку секогаш се меша со обична сол. Оваа мешавина е позната како нитритирана сол, сол за лекување или нитритирана сол за лекување. Во Европа, нитритираната сол за лекување содржи помеѓу 99,1% и 99,5% обична сол и помеѓу 0,5% и 0,9% нитрити. Во САД, нитритираната сол за лекување се дозира со 6% и мора повторно да се измеша со сол пред употреба.[16]
Боја и вкус уреди
Изгледот и вкусот на месото е важна компонента на прифаќањето на потрошувачите.[10] Натриум нитрит е одговорен за посакуваната црвена боја (или засенчена розова) на месото.[10] Многу малку нитрити се потребни за да се предизвика оваа промена.[10] Пријавено е дека се потребни само 2 до 14 делови на милион (ppm) за да се предизвика оваа посакувана промена на бојата.[17] Меѓутоа, за да се продолжи животниот век на оваа промена на бојата, потребни се значително повисоки нивоа.[17] Механизмот одговорен за оваа промена на бојата е формирањето на нитрозилирачки агенси од нитрит, кој има способност да пренесува азотен оксид кој последователно реагира со миоглобинот за да ја произведе бојата на суво месо.[17] На уникатниот вкус поврзан со суво месо влијае и додавањето на натриум нитрит.[10] Сепак, механизмот на оваа промена во вкусот сè уште не е целосно разбран.[17]
Инхибиција на растот на микробите уреди
Студија од 2018 година на Британската асоцијација на производители на месо утврди дека законски дозволените нивоа на нитрити немаат ефект врз растот на бактеријата Clostridium botulinum која предизвикува ботулизам, во согласност со мислењето на Советодавниот комитет за микробиолошка безбедност на храната на ОК дека нитритите не се потребни за да се спречи растот на C. botulinum и да се продолжи рокот на траење.[18] Во некои земји, сувомесните производи се произведуваат без нитрити. На пример, шунката од Парма, која се произведува без нитрити од 1993 година, беше пријавена во 2018 година дека не предизвикала случаи на ботулизам.[6]
Натриум нитрит покажа различни степени на ефикасност за контролирање на растот на други микроорганизми кои предизвикуваат расипување или болести.[10] Иако инхибиторните механизми не се добро познати, неговата ефикасност зависи од неколку фактори, вклучувајќи го резидуалното ниво на нитрити, pH, концентрацијата на сол, присутните редуктиви и содржината на железо.[17] Типот на бактерии, исто така, влијае на ефикасноста на натриум нитритот.[17] Општо е прифатено дека натриум нитритот не е ефикасен за контрола на Грам-негативните цревни патогени како што се Salmonella и Escherichia coli.[17]
Други прехранбени адитиви (како што се лактат и сорбат) обезбедуваат слична заштита од бактерии, но не ја даваат саканата розова боја.[19][20]
Инхибиција на липидна пероксидација уреди
Натриум нитрит е исто така способен ефективно да го одложи развојот на оксидативната ранцидност.[17] Липидната пероксидација се смета за главна причина за влошување на квалитетот на месните производи (ранцидност и неапетитни вкусови).[17] Натриум нитрит делува како антиоксиданс во механизам сличен на оној одговорен за ефектот на боење.[17] Нитритот реагира со хем белковините и металните јони, неутрализирајќи ги слободните радикали со азотен оксид (еден од неговите нуспроизводи).[17] Неутрализацијата на овие слободни радикали го прекинува циклусот на липидна оксидација што доведува до ранцидност.[17]
Лекови уреди
Натриум нитрит се користи како лек заедно со натриум тиосулфат за лекување на труење со цијанид.[21] Се препорачува само во тешки случаи на труење со цијанид.[22] Кај оние кои имаат и труење со цијанид и труење со јаглерод моноксид обично се препорачува само натриум тиосулфат.[23] Се дава со бавно инјектирање во вена.[21]
Несаканите ефекти може да вклучуваат низок крвен притисок, главоболка, отежнато дишење, губење на свеста и повраќање.[21] Треба да се посвети поголемо внимание кај луѓето со основна срцева болест.[21] Нивоата на метхемоглобин кај пациентот треба редовно да се проверуваат за време на третманот.[21] Иако не е добро проучен за време на бременоста, постојат некои докази за потенцијална штета на бебето.[24] Се верува дека натриум нитритот делува така што создава метхемоглобин кој потоа се врзува со цијанидот и на тој начин го отстранува од митохондриите.[24]
Натриум нитрит влезе во медицинска употреба во 1920-тите и 1930-тите.[25][26] Се наоѓа на списокот на есенцијални лекови на Светската здравствена организација.[27]
Самоубиство уреди
Неколку академски публикации во 2020 и 2021 година дискутираа за токсичноста на натриум нитрит и очигледно неодамнешно зголемување на самоубиствата од користење на натриум нитрит кои биле нарачани преку Интернет.[28] Многу е дискутирано на форуми за самоубиства, првенствено Санкционирано самоубиство.[29] Натриум нитрит исто така беше виновник за McCarthy et al. v Тужба на Амазон во која се тврди дека Амазон свесно помогнал во смртта на здрави деца продавајќи им „комплети за самоубиство“ бидејќи функцијата „често купени заедно“ на Амазон препорачува заедно да се купат натриум нитрит, антиеметици и книга со упатства за самоубиство.[30] Интернет-пазарот eBay глобално ја забрани продажбата на натриум нитрит од 2019 година.[31]
Токсичност уреди
Натриум нитрит е токсичен.[32] The LD50 кај стаорци е 180 mg/kg и кај човечки LDLo е 71 mg/kg.[33] Сепак, смртта со ингестија на натриум нитрит може да се случи при помали дози.[34][35] Натриум нитрит се користел за убиства.[36][37] За да се спречи случајна интоксикација, натриум нитрит (помешан со сол) што се продава како додаток на храна во САД е обоен во светло розова боја за да се избегне погрешно мешање со обична сол или шеќер. Во други земји, нитритираната сол за лекување не се бои, туку е строго регулирана.[38]
Појава кај зеленчукот уреди
Нитритите природно не се наоѓаат во зеленчукот во значителни количини.[39] Варењето зеленчук не влијае на нивото на нитрити.[40]
Присуството на нитрити во животинското ткиво е последица на метаболизмот на азотен оксид, важен невротрансмитер.[41] Азотниот оксид може да се создаде de novo од азотен оксид синтаза користејќи аргинин или од проголтан нитрит.[42]
Свињи уреди
Поради високото ниво на токсичност на натриум нитрит за свињите (Sus scrofa), тој сега се развива во Австралија за контрола на дивите свињи.[43][44] Натриум нитритот предизвикува метхемоглобинемија кај свињите, т.е. ја намалува количината на кислород што се ослободува од хемоглобинот, па животното ќе се онесвести, а потоа ќе умре на хуман начин откако прво ќе биде онесвестено.[45] Одделот за паркови и диви животни во Тексас управува со истражувачки капацитет во областа за управување со дивиот свет Кер, каде што ги испитува преференциите за хранење на диви свињи и тактиките на мамки за администрирање на натриум нитрит.[46]
Рак уреди
Канцерогеноста е способност или тенденција на хемикалија да индуцира тумори, да ја зголеми нивната инциденца или малигнитет или да го скрати времето на појава на туморот.[47]
Се покажа дека додавањето нитрити во месото создава познати канцерогени материи како што се нитрозамините; Светската здравствена организација (СЗО) советува дека секои 50 g (1,8 oz) „преработено месо“ што се јаде на ден ќе го зголеми ризикот од добивање рак на дебелото црево за 18% во текот на животот. Прегледот на Светската здравствена организација на повеќе од 400 студии заклучи, во 2015 година, дека има доволно докази дека „преработеното месо“ предизвикува рак, особено рак на дебелото црево; како канцерогени за луѓето (група 1); „преработено месо“ што значи месо кое е трансформирано преку солење, лекување, ферментација, пушење или други процеси за да се подобри вкусот или да се подобри зачувувањето.).[6][48]
Нитрозамините може да се формираат за време на процесот на стврднување што се користи за зачувување на месото, кога месото обработено со натриум нитрит се готви, а исто така и од реакцијата на нитритот со секундарните амини под кисели услови (како што се случува во човечкиот желудник). Диететски извори на нитрозамини вклучуваат американско суво месо сочувано со натриум нитрит, како и сушена солена риба што се јаде во Јапонија. Во 1920-тите, значителна промена во американските практики за лекување месо резултираше со намалување од 69% во просечната содржина на нитрити. Овој настан му претходеше на почетокот на драматичното намалување на смртноста од рак на желудник.[49] Околу 1970 година, беше откриено дека аскорбинската киселина (витамин Ц), антиоксиданс, го инхибира формирањето на нитрозамин.[50] Следствено, потребно е додавање на најмалку 550 ppm аскорбинска киселина во месото произведено во САД. Производителите понекогаш наместо тоа користат ериторбинска киселина, поевтин, но подеднакво ефикасен изомер на аскорбинска киселина. Дополнително, производителите може да вклучат α-токоферол (витамин Е) за дополнително да го инхибираат производството на нитрозамин. α-токоферол, аскорбинска киселина и ериторбинска киселина го инхибираат производството на нитрозамин со нивните оксидационо-редуцирачки својства. Аскорбинската киселина, на пример, формира дехидроаскорбинска киселина кога се оксидира, која кога е во присуство на нитросониум, моќен нитрозационен агенс формиран од натриум нитрит, го редуцира нитросониумот во азотен оксид[51] Азотен анхидрид, нестабилен азотен оксид кој не може да постои in vitro, е вообичаено[52][53] погрешно означен азотен анхидрид.[54]
Внесувањето нитрити во услови кои резултираат со ендогена нитрозација е класифицирано како „веројатно канцерогено за луѓето“ од страна на Меѓународната агенција за истражување на ракот (IARC).[55][56]
Потрошувачката на натриум нитрит исто така е поврзана со предизвикување мигрена кај поединци кои веќе ги доживуваат.[57]
Една студија откри корелација помеѓу многу честaтa ингестија на месо излечено со розова сол и ХОББ формата на белодробно заболување. сепак, тимот не ја докажа теоријата на нитрити. Дополнително, студијата не докажува дека нитритите или сувото месо предизвикуваат повисоки стапки на ХОББ. Истражувачите навистина се прилагодиле на многу фактори на ризик за ХОББ, но тие коментираат дека не можат да ги исклучат сите можни немерливи причини или ризици за ХОББ.[58][59]
Производство уреди
Индустриското производство на натриум нитрит следи еден од двата процеса, редукција на нитратните соли или оксидацијата на пониските азотни оксиди.
Еден метод користи стопен натриум нитрат како сол и олово кое се оксидира, додека посовремен метод користи филови од старо железо за да го редуцира нитратот.[3][60]
Почесто користен метод вклучува општа реакција на азотни оксиди во алкален воден раствор, со додавање на катализатор. Точните услови зависат од тоа кои азотни оксиди се користат и каков е оксидантот, бидејќи условите треба внимателно да се контролираат за да се избегне прекумерна оксидација на азотниот атом.[3]
Натриум нитрит исто така е произведен со редукција на нитратните соли со изложување на топлина, светлина, јонизирачко зрачење, метали, водород и електролитичка редукција.[61]
Хемиски реакции уреди
Во лабораторија, натриум нитрит може да се користи за уништување на вишокот натриум азид.[62][63]
Над 330 °C натриум нитрит се распаѓа (во воздух) до натриум оксид, азотен моноксид и азот диоксид.[64]
Натриум нитрит може да се користи и за производство на азотна киселина:
Азотната киселина потоа, во нормални услови, се распаѓа:
Добиениот азот диоксид се хидролизира до мешавина од азотни и азотести киселини:
Означување на изотоп 15N уреди
Во органската синтеза, може да се користи збогатен со изотоп натриум нитрит-15N наместо нормален натриум нитрит бидејќи нивната реактивност е речиси идентична во повеќето реакции.
Добиените производи носат изотоп 15N и оттука азот NMR може ефикасно да се спроведе.[65]
Наводи уреди
- ↑ Zumdahl SS (2009). Chemical Principles (6. изд.). Houghton Mifflin Company. стр. A23. ISBN 978-0-618-94690-7.
- ↑ „GESTIS-Stoffdatenbank sodium nitrite“. gestis.dguv.de. Посетено на 10 December 2021.
- ↑ 3,0 3,1 3,2 3,3 3,4 Laue W, Thiemann M, Scheibler E, Wiegand KW (2006). „Nitrates and Nitrites“. Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a17_265. ISBN 978-3-527-30673-2.
- ↑ Krakhmalev SI, Vorotnikova VA, Ten NV, Taranova NV (1984). „Determination of sodium nitrite in complex sodium oils“. Chemistry and Technology of Fuels and Oils. 20 (12): 612–613. doi:10.1007/BF00726438. S2CID 94383988.
- ↑ „Sodium Nitrite“. General Chemical. Архивирано од изворникот на 2013-05-22. Посетено на 28 September 2012.
- ↑ 6,0 6,1 6,2 6,3 Wilson B (2018-03-01). „Yes, bacon really is killing us“. The Guardian (англиски). London. ISSN 0261-3077. Архивирано од изворникот 2021-02-10. Посетено на 2021-02-14.
In trade journals of the 1960s, the firms who sold nitrite powders to ham-makers spoke quite openly about how the main advantage was to increase profit margins by speeding up production.
- ↑ Lerfall J, Østerlie M (February 2011). „Use of sodium nitrite in salt-curing of Atlantic salmon (Salmo salar L.) – Impact on product quality“. Food Chemistry. 124 (3): 759–766. doi:10.1016/j.foodchem.2010.06.092.
- ↑ Bailey ME, Frame RW, Naumann HD (January 1964). „Cured Meat Pigments, Studies of the Photooxidation of Nitrosomyoglobin“. Journal of Agricultural and Food Chemistry. 12 (1): 89–93. doi:10.1021/jf60131a026.
- ↑ „"Meat Pigment Chemistry", taken from IFT Mini-Experiments in Food Science Series“ (PDF). Архивирано од изворникот (PDF) на 2019-12-03. Посетено на 2023-03-09.
- ↑ 10,0 10,1 10,2 10,3 10,4 10,5 10,6 10,7 Sindelar JJ, Milkowski AL (May 2012). „Human safety controversies surrounding nitrate and nitrite in the diet“. Nitric Oxide. 26 (4): 259–266. doi:10.1016/j.niox.2012.03.011. PMID 22487433.
- ↑ „Science Says: Are hot dogs healthier without added nitrites? | Lifestyle from CTV News“. www.ctvnews.ca. 30 June 2017.
- ↑ „Approved additives and E numbers“. Food Standards Agency (англиски). Посетено на 2023-01-09.
- ↑ „Health and Food Safety“ (PDF). European Commission – European Commission. Посетено на 1 April 2018.
- ↑ US Food and Drug Administration: „Listing of Food Additives Status Part II“. Food and Drug Administration. Посетено на 27 October 2011.
- ↑ Health. „Australia New Zealand Food Standards Code - Standard 1.2.4 - Labelling of Ingredients“. www.legislation.gov.au (англиски). Посетено на 2023-01-09.
- ↑ Coudray G (February 2021). Who poisoned your bacon?. Icon Books. стр. xv. ISBN 978-1785786112.
- ↑ 17,00 17,01 17,02 17,03 17,04 17,05 17,06 17,07 17,08 17,09 17,10 17,11 Sindelar J, Milkowski A (November 2011). „Sodium Nitrite in Processed Meat and Poultry Meats: A Review of Curing and Examining the Risk/Benefit of Its Use“ (PDF). American Meat Science Association. 3: 1–14.
- ↑ Doward J (2019-03-23). „Revealed: no need to add cancer-risk nitrites to ham“. The Observer. London. Архивирано од изворникот 2021-01-26. Посетено на 2021-02-14.
The results show that there is no change in levels of inoculated C botulinum over the curing process, which implies that the action of nitrite during curing is not toxic to C botulinum spores at levels of 150 ppm [parts per million] ingoing nitrite and below.
- ↑ Seward RA, Deibel RH, Lindsay RC (November 1982). „Effects of potassium sorbate and other antibotulinal agents on germination and outgrowth of Clostridium botulinum type E spores in microcultures“. Applied and Environmental Microbiology. 44 (5): 1212–1221. Bibcode:1982ApEnM..44.1212S. doi:10.1128/AEM.44.5.1212-1221.1982. PMC 242170. PMID 6758699.
- ↑ Sofos JN, Busta FF, Bhothipaksa K, Allen CE, Robach MC, Paquette MW (September 1980). „Effects of various concentrations of sodium nitrite and potassium sorbate on Clostridium botulinum toxin production in commercially prepared bacon“. Journal of Food Science. 45 (5): 1285–1292. doi:10.1111/j.1365-2621.1980.tb06539.x.
- ↑ 21,0 21,1 21,2 21,3 21,4 World Health Organization (2009). Stuart MC, Kouimtzi M, Hill SR (уред.). WHO Model Formulary 2008. World Health Organization. стр. 65. hdl:10665/44053. ISBN 9789241547659.
- ↑ „Sodium Nitrite Solution for Injection - Summary of Product Characteristics (SPC) - (eMC)“. www.medicines.org.uk. Архивирано од изворникот 18 September 2017. Посетено на 15 January 2017.
- ↑ Baren JM (2008). Pediatric Emergency Medicine (англиски). Elsevier Health Sciences. стр. 1018. ISBN 978-1416000877. Архивирано од изворникот 2017-01-16 – преку Google Books.
- ↑ 24,0 24,1 „Sodium Nitrite Injection - FDA prescribing information, side effects and uses“. www.drugs.com. Архивирано од изворникот 2017-01-18.
- ↑ Dart RC (2004). Medical Toxicology (англиски). Lippincott Williams & Wilkins. стр. 172. ISBN 9780781728454. Архивирано од изворникот 2017-01-16 – преку Google Books.
- ↑ Bryan NS, Loscalzo J (2011). Nitrite and Nitrate in Human Health and Disease (англиски). Springer Science & Business Media. стр. 226. ISBN 9781607616160. Архивирано од изворникот 2017-01-16 – преку Google Books.
- ↑ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ↑ Durão C, et al., 2020.; Durão C, et al., 2021.; Tomsia M, et al., 2021.; McCann SD, Kennedy JM, et al., 2021.; Dean DE, et al., 2021.; Hickey TB, et al., 2021.; Harvey M, et al., 2010.; McCann SD, Tweet MS, Wahl MS, 2021.; Sedhai YR, et al., 2022.; Mudan A, et al., 2020.
- ↑ Twohey M (9 December 2021). „Where the Despairing Log On, and Learn Ways to Die“. The New York Times. Посетено на 24 July 2022.
- ↑ „"Amazon "suicide kits" have led to teen deaths, according to new lawsuit"“. Ars technica. 7 October 2022.
- ↑ Director eBay (UK) Limited (8 January 2021). „Re Jason Thompson (deceased) – Sodium Nitrite“ (PDF).
- ↑ Crellin J. „How toxic is it?“ (PDF). The Association for Science Educators. Посетено на 6 February 2022. Занемарен непознатиот параметар
|orig-date=(help) - ↑ „Safety data for sodium nitrite“. The Physical and Theoretical Chemistry Laboratory. Oxford University. Архивирано од изворникот на 10 April 2008.
- ↑ Gowans WJ (November 1990). „Fatal methaemoglobinaemia in a dental nurse. A case of sodium nitrite poisoning“. The British Journal of General Practice. 40 (340): 470–471. PMC 1371420. PMID 2271282.
- ↑ Standefer JC, Jones AM, Street E, Inserra R (October 1979). „Death associated with nitrite ingestion: report of a case“. Journal of Forensic Sciences. 24 (4): 768–771. doi:10.1520/JFS10905J. PMID 541641.
- ↑ „Chinese teacher sentenced to death for poisoning nursery children“. BBC News. 29 September 2020.
- ↑ „Teacher in China sentenced to death for poisoning children's porridge“. The Guardian. Agence France-Presse in Beijing. 29 September 2020.
- ↑ „The Use and Removal of Nitrite in Meat Products | FAQs | the Food Safety Authority of Ireland“. Архивирано од изворникот на 2022-06-27. Посетено на 2023-03-09.
- ↑ Dennis MJ, Wilson LA (2003). „Nitrates and Nitrites“. Encyclopedia of Food Sciences and Nutrition. стр. 4136–4141. doi:10.1016/B0-12-227055-X/00830-0. ISBN 978-0-12-227055-0.
- ↑ Leszczyńska T, Filipiak-Florkiewicz A, Cieślik E, Sikora E, Pisulewski PM (June 2009). „Effects of some processing methods on nitrate and nitrite changes in cruciferous vegetables“. Journal of Food Composition and Analysis. 22 (4): 315–321. doi:10.1016/j.jfca.2008.10.025.
- ↑ Meulemans A, Delsenne F (October 1994). „Measurement of nitrite and nitrate levels in biological samples by capillary electrophoresis“. Journal of Chromatography B, Biomedical Applications. 660 (2): 401–404. doi:10.1016/0378-4347(94)00310-6. PMID 7866533.
- ↑ Southan GJ, Srinivasan A (August 1998). „Nitrogen oxides and hydroxyguanidines: formation of donors of nitric and nitrous oxides and possible relevance to nitrous oxide formation by nitric oxide synthase“. Nitric Oxide. 2 (4): 270–286. doi:10.1006/niox.1998.0187. PMID 9851368.
- ↑ Lapidge S, Wishart J, Smith M, Staples L (4 May 2009). Is America Ready for a Humane Feral Pig Toxicant?. Wildlife Damage Management Conference. Saratoga Springs, NY.
- ↑ WO 2008/104028, Cowled BD, Lapidge SJ, Humphrys S, Staples L, "Nitrite Salts as Poisons in Baits for Omnivores", published 2008
- ↑ Porter S, Kuchel T (2010). Assessing the humaness and efficacy of a new feral pig bait in domestic pigs. Study PC0409 (PDF). Canberra, South Australia: Veterinary Services Division, Institute of Medical and Veterinary Science. стр. 11.
- ↑ Texas Parks and Wildlife (21 February 2013). „Hogs Wild – Fighting the Feral Pig Problem – Texas Parks and Wildlife [Official]“. Архивирано од изворникот 2021-12-12. Посетено на 1 April 2018 – преку YouTube.
- ↑ „Known and Probable Human Carcinogens“. www.cancer.org (англиски). Посетено на 28 January 2019.
- ↑ „IARC Monographs evaluate consumption of red meat and processed meat“ (PDF). International Agency for Research on Cancer. 2015-10-26. Архивирано од изворникот (PDF) на 2021-01-18. Посетено на 2021-02-14.
Processed meat was classified as carcinogenic to humans (Group 1), based on sufficient evidence in humans that the consumption of processed meat causes colorectal cancer.
- ↑ Paik DC, Saborio DV, Oropeza R, Freeman HP (February 2001). „The epidemiological enigma of gastric cancer rates in the US: was grandmother's sausage the cause?“. International Journal of Epidemiology. 30 (1): 181–182. doi:10.1093/ije/30.1.181. PMID 11171883.
- ↑ Mackerness CW, Leach SA, Thompson MH, Hill MJ (February 1989). „The inhibition of bacterially mediated N-nitrosation by vitamin C: relevance to the inhibition of endogenous N-nitrosation in the achlorhydric stomach“. Carcinogenesis. 10 (2): 397–399. doi:10.1093/carcin/10.2.397. PMID 2492212.
- ↑ „Research Newsletter“. Linus Pauling Institute. 1 July 2014. Посетено на 1 April 2018.
- ↑ Scanlan RA (May 1983). „Formation and occurrence of nitrosamines in food“. Cancer Research. 43 (5 Suppl): 2435s–2440s. PMID 6831466. Предлошка:NAID.
- ↑ Nollet LM, Toldrá F (2015). Handbook of Food Analysis (Third. изд.). стр. 290. ISBN 978-1-4822-9784-3.[се бара страница]
- ↑ Williams DL (2004). „Reagents effecting nitrosation“. Nitrosation Reactions and the Chemistry of Nitric Oxide. стр. 1–34. doi:10.1016/B978-044451721-0/50002-5. ISBN 978-0-444-51721-0.
- ↑ „List of classifications, Volumes 1–116 – IARC Monographs on the Evaluation of Carcinogenic Risks to Humans“. International Agency for Research on Cancer (IARC) – World Health Organization (WHO). 2010. Посетено на 25 September 2016.
- ↑ Ingested Nitrate and Nitrite, and Cyanobacterial Peptide Toxins. International Agency for Research on Cancer (IARC) – World Health Organization (WHO). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. 94. 2010. ISBN 978-92-832-1294-2. Посетено на 25 September 2016.
- ↑ „Heading Off Migraine Pain“. FDA Consumer magazine. U.S. Food and Drug Administration. 1998.
- ↑ Hitti M (17 April 2007). „Study: Cured Meats, COPD May Be Linked“. WebMD Medical News.
- ↑ Jiang R, Paik DC, Hankinson JL, Barr RG (April 2007). „Cured meat consumption, lung function, and chronic obstructive pulmonary disease among United States adults“. American Journal of Respiratory and Critical Care Medicine. 175 (8): 798–804. doi:10.1164/rccm.200607-969OC. PMC 1899290. PMID 17255565.
- ↑ Hao ZW, Xu XH, Wang DH (March 2005). „Reductive denitrification of nitrate by scrap iron filings“. Journal of Zhejiang University. Science. B. 6 (3): 182–186. doi:10.1631/jzus.2005.B0182. PMC 1389719. PMID 15682502.
- ↑ Pokorny L, Maturana I, Bortle WH (2006). „Sodium Nitrate and Nitrite“. Kirk-Othmer Encyclopedia of Chemical Technology. doi:10.1002/0471238961.1915040916151115.a01.pub2. ISBN 978-0-471-23896-6.
- ↑ „Sodium Azide“. Hazardous Waste Management. Northeastern University. март 2003. Архивирано од изворникот на 4 ноември 2007.
- ↑ National Research Council (1995). Prudent practices in the laboratory: handling and disposal of chemicals. Washington, D.C.: National Academy Press. doi:10.17226/4911. ISBN 978-0-309-05229-0.CS1-одржување: повеќе имиња: список на автори (link)
- ↑ Stern KH (July 1972). „High Temperature Properties and Decomposition of Inorganic Salts Part 3, Nitrates and Nitrites“. Journal of Physical and Chemical Reference Data. 1 (3): 747–772. Bibcode:1972JPCRD...1..747S. doi:10.1063/1.3253104. S2CID 95532988.
- ↑ Kazem-Rostami M, Akhmedov NG, Faramarzi S (February 2019). „Molecular lambda shape light-driven dual switches: Spectroscopic and computational studies of the photoisomerization of bisazo Tröger base analogs“. Journal of Molecular Structure. 1178: 538–543. Bibcode:2019JMoSt1178..538K. doi:10.1016/j.molstruc.2018.10.071. S2CID 105312344.
Извори уреди
- Durão C, Pedrosa F, Dinis-Oliveira RJ (July 2020). „A fatal case by a suicide kit containing sodium nitrite ordered on the internet“. Journal of Forensic and Legal Medicine. 73: 101989. doi:10.1016/j.jflm.2020.101989. hdl:10400.26/34138. PMID 32658747. S2CID 219909654.
- Durão C, Pedrosa F, Dinis-Oliveira RJ (June 2021). „Another suicide by sodium nitrite and multiple drugs: an alarming trend for "exit"?“. Forensic Science, Medicine, and Pathology. 17 (2): 362–366. doi:10.1007/s12024-020-00340-2. PMID 33247411 Проверете ја вредноста
|pmid=(help). S2CID 227180461. - Tomsia M, Głaz M, Nowicka J, Szczepański M (July 2021). „Sodium nitrite detection in costal cartilage and vitreous humor - Case report of fatal poisoning with sodium nitrite“. Journal of Forensic and Legal Medicine. 81: 102186. doi:10.1016/j.jflm.2021.102186. PMID 34058704 Проверете ја вредноста
|pmid=(help). S2CID 235268052 Проверете ја вредноста|s2cid=(help). - McCann SD, Kennedy JM, Tweet MS, Bryant SM (March 2021). „Sodium Nitrite Ingestion: an Emerging Trend in Suicide Attempts Shared via Online Communities“. The Journal of Emergency Medicine. 60 (3): 409–412. doi:10.1016/j.jemermed.2020.10.021. PMID 33712114 Проверете ја вредноста
|pmid=(help). S2CID 232218908 Проверете ја вредноста|s2cid=(help). - Dean DE, Looman KB, Topmiller RG (July 2021). „Fatal methemoglobinemia in three suicidal sodium nitrite poisonings“. Journal of Forensic Sciences. 66 (4): 1570–1576. doi:10.1111/1556-4029.14689. PMID 33598944 Проверете ја вредноста
|pmid=(help). S2CID 231952466 Проверете ја вредноста|s2cid=(help). - Hickey TB, MacNeil JA, Hansmeyer C, Pickup MJ (September 2021). „Fatal methemoglobinemia: A case series highlighting a new trend in intentional sodium nitrite or sodium nitrate ingestion as a method of suicide“. Forensic Science International. 326: 110907. doi:10.1016/j.forsciint.2021.110907. PMID 34298207 Проверете ја вредноста
|pmid=(help). - Harvey M, Cave G, Chanwai G (October 2010). „Fatal methaemoglobinaemia induced by self-poisoning with sodium nitrite“. Emergency Medicine Australasia. 22 (5): 463–465. doi:10.1111/j.1742-6723.2010.01335.x. PMID 21040485. S2CID 38780081.
- McCann SD, Tweet MS, Wahl MS (December 2021). „Rising incidence and high mortality in intentional sodium nitrite exposures reported to US poison centers“. Clinical Toxicology. 59 (12): 1264–1269. doi:10.1080/15563650.2021.1905162. PMID 33787434 Проверете ја вредноста
|pmid=(help). S2CID 232431594 Проверете ја вредноста|s2cid=(help). - Sedhai YR, Atreya A, Basnyat S, Phuyal P, Pokhrel S (June 2022). „The use of sodium nitrite for deliberate self-harm, and the online suicide market: Should we care?“. The Medico-Legal Journal. 90 (2): 79–80. doi:10.1177/0025817221998119. PMID 33906496 Проверете ја вредноста
|pmid=(help). S2CID 233429578 Проверете ја вредноста|s2cid=(help). - Mudan A, Repplinger D, Lebin J, Lewis J, Vohra R, Smollin C (September 2020). „Severe Methemoglobinemia and Death From Intentional Sodium Nitrite Ingestions“. The Journal of Emergency Medicine. 59 (3): e85–e88. doi:10.1016/j.jemermed.2020.06.031. PMID 32713620. S2CID 220797852.
Понатамошно читање уреди
- National Toxicology Program (May 2001). „Toxicology and carcinogenesis studies of sodium nitrite (CAS NO. 7632-00-0) in F344/N rats and B6C3F1 mice (drinking water studies)“. National Toxicology Program Technical Report Series. 495: 7–273. PMID 12563346.
Надворешни врски уреди
- Drug information portal at the U.S. National Library of Medicine
- International Chemical Safety Card 1120.
- Nitrite in Meat
| Нитрити | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HNO2 | He | ||||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO3)3 | C(NO2)4, CH(NO2)3, CH2(NO2)2, CH3(NO2) |
N(NO2)3 xNO3NO2 |
N2O3 | NO2F | Ne | ||||||||||||
| NaNO2 | Mg(NO2)2 | Al(NO2)3 | Si | P | S | NO2Cl | Ar | ||||||||||||
| KNO2 | Ca(NO2)2 | Sc(NO2)3 | Ti | VO(NO2)3 | Cr(NO2)3 | Mn(NO2)2 | Fe(NO2)3 | Co(NO2)2, Co(NO2)3 |
Ni(NO2)2 | Cu(NO2)2 | Zn(NO2)2 | Ga(NO2)3 | Ge | As | Se | NO2Br | Kr | ||
| RbNO2 | Sr(NO2)2 | Y(NO2)3 | Zr | Nb | Mo | Tc | Ru | Rh | Pd(NO2)2 | AgNO2 | Cd(NO2)2 | In | Sn | Sb | Te | NO2I | Xe | ||
| CsNO2 | Ba(NO2)2 | Hf | Ta | W | Re | Os | Ir | Pt(NO2)2, [Pt(NO2)4]2− |
Au | Hg2(NO2)2, Hg(NO2)2 |
TlNO2 | Pb(NO2)2 | Bi(NO2)3 BiO(NO2) |
Po | At | Rn | |||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| La(NO2)3 | Ce(NO2)3 | Pr(NO2)3 | Nd(NO2)3 | Pm | Sm(NO2)3 | Eu(NO2)2 | Gd(NO2)3 | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||||
| Ac | Th | Pa | UO2(NO2)2 | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||||


