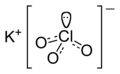
Калиум хлорат
Калиум хлорат ― соединение кое содржи калиум, хлор и кислород, со молекуларна формула KClO3. Во својот чист облик, тој е бела кристална супстанција. По натриум хлоратот, тој е вториот најчест хлорат во индустриска употреба. Тој е силен оксидирачки агенс и неговата најважна примена е во чкорчињата.[6] Во други намени, тој е главно застарен и е заменет со побезбедни алтернативи во последните децении. Бил користен во:
- во огномети, пропеланти и експлозиви,
- да биде подготвен кислород, и во лабораторија и во хемиски создавачи на кислород,
- како средство за дезинфекција, на пример во медицински плакнења за уста,
- во земјоделството како хербицид.
| |||

| |||
Други називи Калиум хлорат(V), Бертолетова сол | |||
| Назнаки | |||
|---|---|---|---|
| 3811-04-9 | |||
| ChemSpider | 18512 | ||
| EC-број | 223-289-7 | ||
| |||
| 3Д-модел (Jmol) | Слика | ||
| PubChem | 6426889 | ||
| RTECS-бр. | FO0350000 | ||
| |||
| UNII | H35KS68EE7 | ||
| ОН-бр. | 1485 | ||
| Својства | |||
| Хемиска формула | |||
| Моларна маса | 0 g mol−1 | ||
| Изглед | бели кристали или прав | ||
| Густина | 2.32 г/цм3 | ||
| Точка на топење | |||
| Точка на вриење | |||
| 3.13 г/100 mL (0 °C) 4.46 г/100 mL (10 °C) 8.15 г/100 mL (25 °C) 13.21 г/100 mL (40 °C) 53.51 г/100 mL (100 °C) 183 г/100 г (190 °C) 2930 г/100 г (330 °C)[2] | |||
| Растворливост | растворлив во глицерол незначителен во ацетон и течен амонијак[1] | ||
| Растворливост во glycerol | 1 г/100 г (20 °C)[1] | ||
| −42.8·10−6 cm3/mol | |||
| Показател на прекршување (nD) | 1.40835 | ||
| Структура | |||
| Кристална структура | моноклинички | ||
| Термохемија | |||
| Ст. енталпија на образување ΔfH |
−391.2 kJ/mol[1][3] | ||
| Стандардна моларна ентропија S |
142.97 J/mol·K[1][3] | ||
| Специфичен топлински капацитет, C | 100.25 J/mol·K[1] | ||
| Опасност | |||
| GHS-ознаки: | |||
Пиктограми
|
   [4] [4]
| ||
Сигнални зборови
|
Опасност | ||
Изјави за опасност
|
H271, H302, H332, H411[4] | ||
Изјави за претпазливост
|
P220, P273[4] | ||
| NFPA 704 | |||
| Смртоносна доза или концентрација: | |||
LD50 (средна доза)
|
1870 мг/кг[5] | ||
| Безбедносен лист | ICSC 0548 | ||
| Слични супстанци | |||
| Други анјони | Калиум бромат Калиум јодат Калиум нитрат | ||
| Други катјони | Амониум хлорат Натриум хлорат Бариум хлорат | ||
| Дополнителни податоци | |||
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |||
| Наводи | |||
Производство
уредиНа индустриско ниво, калиум хлорат се произведува со реакција на метатеза на сол на натриум хлорат и калиум хлорид:
- NaClO 3 + KCl → NaCl + KClO 3
Реакцијата е поттикната од ниската растворливост на калиум хлорат во вода. Рамнотежата на реакцијата се поместува на десната страна со постојано таложење на производот (Начело на Ле Шателје). Претходникот на натриум хлорат е произведуван индустриски во многу големи количини со електролиза на натриум хлорид, обична кујнска сол.[6]
Понекогаш се користи и директна електролиза на калиум хлорид во воден раствор, при што елементарниот хлор образуван на анодата реагира со калиум хидроксидот на место. Ниската растворливост на KClO3 во вода предизвикува солта лесно да се изолира од реакционата смеса со едноставно таложење од растворот.
Калиум хлорат може да се произведе во мали количини со диспропорција во раствор на натриум хипохлорит проследена со реакција на метатеза со калиум хлорид:[7]
- 3 NaOCl(aq) → 2 NaCl(s) + NaClO3(aq)
- KCl(aq) + NaClO3(aq) → NaCl(aq) + KClO3(s)
Може да се произведе и со пропуштање на гасот хлор во врел раствор на калиум хидроксид:[8]
- 3 Cl2(g) + 6 KOH(aq) → KClO3(aq) + 5 KCl(aq) + 3 H2O(l)
Употреба
уредиКалиум хлоратот бил една клучна состојка во раните капислени табани за огнено оружје. Продолжува во таа примена, каде што не е заменет со калиум перхлорат.
Пропелантите засновани на хлор се поефикасни од традиционалниот барут и се помалку подложни на оштетување од вода. Сепак, тие можат да бидат крајно нестабилни во присуство на сулфур или фосфор и се многу поскапи. Хлоратните погони мора да се користат само во опрема наменета за нив; непридржувањето кон оваа мерка на претпазливост е чест извор на несреќи. Калиум хлорат, често во комбинација со сребрен фулминат, се користи во распалките, популарен вид на застарен огномет.
Друга примена на калиум хлорат е како оксидатор во составот на чад како оној што се користи во димните гранати. Од 2005 година, патронот со калиум хлорат измешан со лактоза и колофон се користи за создавање на бел чад што го сигнализира изборот на нов папа од страна на папската конклава.[9]
Калиум хлорат често е користен во средношколските и факултетските лаборатории за правење на кислороден гас. Тоа е далеку поевтин извор од резервоарот за кислород под притисок или криоген. Калиум хлорат лесно се распаѓа ако се загрева додека е во допир со катализатор, вообичаено манган (IV) диоксид (MnO2). Така, може едноставно да биде ставен во епрувета и да се загрее над пламеник. Ако епрувета е опремена со затворач со една дупка и црево, може да се извади топол кислород. Реакцијата е следна:
Загревањето во отсуство на катализатор го претвора во калиум перхлорат:[8]
Со дополнително загревање, калиум перхлорат се распаѓа до калиум хлорид и кислород:
За безбедно извршување на оваа реакција потребни се многу чисти реагенси и внимателна контрола на температурата. Растопениот калиум хлорат е исклучително моќен оксидатор и спонтано реагира со многу вообичаени материјали како што е шеќерот. Експлозиите настанаа како резултат на прскање на течни хлорати во латекс или ПВЦ цевките на создавачите на кислород, како и од допир помеѓу хлорати и јаглеводородни маснотии за запечатување. Нечистотиите во самиот калиум хлорат исто така може да предизвикаат проблеми. Кога работите со нова серија на калиум хлорат, препорачливо е да се земе мал примерок (~ 1 грам) и силно загрејте го на отворена стаклена чинија. Контаминацијата може да предизвика оваа мала количина да експлодира, што покажува дека хлоратот треба да се фрли.
Калиум хлорат се користи во хемиски создавачи на кислород (исто така наречени хлоратни свеќи или кислородни свеќи), кои се користат како системи за снабдување со кислород на пр. авиони, вселенски станици и подморници, и е одговорен за најмалку една авионска несреќа. Пожарот на вселенската станица Мир бил настанат преку свеќи кои произведуваат кислород кои користат сличен литиум перхлорат. Распаѓањето на калиум хлорат исто така било искористено за да се обезбеди снабдување со кислород за калциумски светла.
Калиум хлорат е користен и како пестицид. Во Финска бил продаван под трговското име Фегабит.
Калиум хлорат може да реагира со сулфурна киселина за да образува високо реактивен раствор на хлорна киселина и калиум сулфат:
- 2 KClO3 + H2SO4 → 2 HClO3 + K2 SO4
Така произведениот раствор е доволно реактивен што спонтано се запали доколку има запалив материјал (шеќер, хартија, итн.).
Во училиштата, стопениот калиум хлорат е користен во драматичните демонстрации на „желе кое вреска“, гуменото мече, Харибо и Троли, каде бонбоните се фрлаат во стопената сол.
Во хемиските лаборатории се користи за оксидација на HCl и ослободување на мали количини гасовит хлор.
Бунтовниците во Авганистан, исто така, интензивно користат калиум хлорат како клучна компонента во производството на импровизирани експлозивни направи. Кога биле направени значителни напори за намалување на достапноста на ѓубриво со амониум нитрат во Авганистан, производителите на ваквите направо почнале да користат калиум хлорат како евтина и ефикасна алтернатива. Во 2013 година, 60% од екслозивните направи во Авганистан користеле калиум хлорат, што го прави најчеста состојка што се користи во направите.[10] Калиум хлорат исто така била главната состојка во автомобилот-бомба користен во бомбашките напади на Бали во 2002 година, во кои загинале 202 луѓе.
Калиум хлорат се користи за присилување на фазата на расцут на дрвото лонган, предизвикувајќи тоа да дава плод во потоплите клими.[11]
Безбедност
уредиТреба внимателно да се постапува со калиум хлорат. Реагира енергично, а во некои случаи спонтано се запали или експлодира, кога се меша со многу запаливи материјали. Согорува енергично во комбинација со речиси секој запалив материјал, дури и со оние кои вообичаено се само малку запаливи (вклучувајќи обична прашина и влакненца). Мешавините на калиум хлорат и гориво може да се запалат при контакт со сулфурна киселина, па затоа треба да се чува подалеку од овој реагенс. Сулфурот треба да се избегнува во пиротехничките состави кои содржат калиум хлорат, бидејќи овие мешавини се склони кон спонтано дефлагрирање. Повеќето сулфур содржи траги од киселини кои содржат сулфур, а тие можат да предизвикаат спонтано палење - „Цвеќе од сулфур“ или „сублимиран сулфур“, и покрај вкупната висока чистота, содржи значителни количини на сулфурни киселини. Исто така, мешавините на калиум хлорат со кое било соединение со својства за поттикнување на палењето (на пр. антимон(III) сулфид) се многу опасни за подготовка, бидејќи се исклучително чувствителни на удари.
Поврзано
уредиНаводи
уреди- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 „potassium chlorate“. Посетено на 25 јуни 2022.
- ↑ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand. Посетено на 25 јуни 2022.
- ↑ 3,0 3,1 Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. стр. A22. ISBN 978-0-618-94690-7.
- ↑ 4,0 4,1 4,2 „Potassium chlorate“. Посетено на 25 јуни 2022.
- ↑ Michael Chambers. „ChemIDplus - 3811-04-9 - VKJKEPKFPUWCAS-UHFFFAOYSA-M - Potassium chlorate - Similar structures search, synonyms, formulas, resource links, and other chemical information“. Посетено на 25 јуни 2022.
- ↑ 6,0 6,1 Vogt, Helmut; Balej, Jan; Bennett, John E.; Wintzer, Peter; Sheikh, Saeed Akbar; Gallone, Patrizio (15 јуни 2000). „Chlorine Oxides and Chlorine Oxygen Acids“. Во Ullmann (уред.). Ullmann's Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag. doi:10.1002/14356007.a06_483. ISBN 9783527303854.
- ↑ Anne Marie Helmenstine, Ph.D. „Potassium Chlorate Synthesis (Substitute) Formula“. About.com Education. Посетено на 25 јуни 2022.
- ↑ 8,0 8,1 Pradyot Patnaik.
- ↑ Daniel J. Wakin and Alan Cowell (13 март 2013). „New Round of Voting Fails to Name a Pope“. The New York Times. Посетено на 25 јуни 2022.
- ↑ „Afghan bomb makers shifting to new explosives for IEDs“. USAToday.com. 25 јуни 2013. Посетено на 2013-06-25.
- ↑ Manochai, P.; Sruamsiri, P.; Wiriya-alongkorn, W.; Naphrom, D.; Hegele, M.; Bangerth, F. (February 12, 2005). „Year around off season flower induction in longan (Dimocarpus longan, Lour.) trees by KClO3 applications: potentials and problems“. Scientia Horticulturae. Department of Horticulture, Maejo University, Chiang Mai, Thailand; Department of Horticulture, Chiang Mai University, Chiang Mai, Thailand; Institute of Special Crops and Crop Physiology, University of Hohenheim, 70593 Stuttgart, Germany. 104 (4): 379–390. doi:10.1016/j.scienta.2005.01.004. Посетено на 25 јуни 2022.CS1-одржување: место (link)
- „Chlorate de potassium. Chlorate de sodium“, Fiche toxicol. бр. 217, Париз: Национален институт за истражување и безбедност, 2000 година. 4 стр.
- Постојана постапка за производство на калиум хлорат со спојување со фабрика за производство на натриум хлорат