Олово(II) оксид
Олово(II) оксид, исто така наречено олово моноксид, ― неорганско соединение со молекуларна формула Pb O. PbO се јавува во два полиморфи: литаргит со четириагонална кристална структура и масикот со орторопмска кристална структура. Современите примени за PbO се претежно во индустриско стакло на база на олово и индустриска керамика, вклучително и сметачки компоненти. Тоа е амфотерен оксид.[3]

| |
| |
Назив според МСЧПХ Олово(II) оксид | |
| Назнаки | |
|---|---|
| 1317-36-8 | |
| ChEBI | CHEBI:81045 |
| ChemSpider | 140169 |
| EC-број | 215-267-0 |
| |
| 3Д-модел (Jmol) | Слика |
| KEGG | C17379 |
| PubChem | 14827 |
| RTECS-бр. | OG1750000 |
| |
| UNII | 4IN6FN8492 |
| ОН-бр. | 3288 2291 3077 |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | црвен или жолт прав |
| Густина | 9.53 г/цм3 |
| Точка на топење | |
| Точка на вриење | |
| 0.017 г/Л[1] | |
| Растворливост | нерастворлив во разредени алкали, алкохол растворлив во концентрирани алкали растворлив во солна киселина, амониум хлорид |
| 4,20⋅10-5 cm3/mol | |
| Структура | |
| Кристална структура | Четириаголна, tP4 |
| P4/nmm, бр. 129 | |
| Опасност | |
| GHS-ознаки: | |
Пиктограми
|
  
|
Сигнални зборови
|
Опасност |
Изјави за опасност
|
H302, H332, H351, H360Df, H362, H373, H410 |
Изјави за претпазливост
|
P201, P202, P260, P261, P263, P264, P270, P271, P273, P281, P301+P312, P304+P312, P304+P340, P308+P313, P312, P314, P330, P391, P405, P501 |
| NFPA 704 | |
| Температура на запалување | Незапалив |
| Смртоносна доза или концентрација: | |
LDLo (најниска објавена)
|
1400 mg/kg (dog, oral)[2] |
| Безбедносен лист | ICSC 0288 |
| Слични супстанци | |
| Други анјони | Олово сулфид Олово селенид Олово телурид |
| Други катјони | Јаглерод моноксид Силициум моноксид Германиум моноксид Тин(II) оксид |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Подготовка
уредиPbO може да се подготви со загревање на оловниот метал во воздух на приближно 600 °C. На оваа температура тој е и краен производ на оксидација на други оксиди на олово во воздухот:[4]
Топлинското распаѓање на олово(II) нитратот или олово(II) карбонатот, исто така, резултира со создавање на PbO:
PbO се произведува во голем обем како среден производ при рафинирање на суровини оловни руди во метално олово. Вообичаената оловна руда е галена (олово(II) сулфид). На температура од околу 1,000 °C, сулфидот се претвора во оксид:[5]
- 2 PbS + 3 O2 → 2 PbO + 2 SO
2
Структура
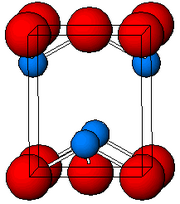
уредиКако што е утврдено со рендгенска кристалографија, и полиморфните, четириагонални и орторомпски имаат пирамидно средиште со четири координати. Во четириагоналниот облик четирите олово-кислородни врски имаат иста должина, но во орторомпските две се пократки и две подолги. Пирамидната природа укажува на присуство на стереохемиски активен слободен електронски пар.[6] Кога PbO се јавува во четириагонална решеткаста структура тој е наречен литаргит; а кога PbO има орторомбна решеткаста структура се нарекува масикот. PbO може да се менува од масикот во литаргит или обратно со контролирано греење и ладење.[7] Четириагоналниот облик е обично црвена или портокалова боја, додека орторомпскиот обично е жолт или портокалов, но бојата не е многу сигурен показател за структурата.[8] Четириагоналните и орторомбните облици на PbO се јавуваат природно како ретки минерали.
| Единица ќелија | Пакување | Пакување | Пакување | Оловна координација | Кислородна координација |
|---|---|---|---|---|---|
| 3×3×3 единечни ќелии | гледано по оската a | гледано по оската c | квадратна пирамидна | искривен тетраедар |
Реакции
уредиМетално олово се добива со намалување на PbO со јаглерод моноксид на околу 1,200 °C:[11]
- PbO + CO → Pb + CO
Црвените и жолтите облици на овој материјал се поврзани со мала промена во енталпијата:
- PbO (црвен) → PbO (жолт) Δ H = 1,6 kJ/mol
PbO е амфотерен, што значи дека реагира и со киселини и со бази. Со киселини, образува соли на Pb2+ преку посредство на оксо кластери како што се [Pb6O(OH)6]4+. Со силни основи, PbO се раствора за да образува плумбитни (исто така наречени плумбитни(II)) соли:[12]
- PbO + H2O + OH− → [Pb(OH)3]−
Примени
уредиВидот на олово во оловното стакло обично е PbO, а PbO се користи интензивно во правењето стакло. Во зависност од стаклото, користа од употребата на PbO во стаклото може да биде една или повеќе од зголемување на показателот на прекршување на стаклото, намалување на вискозноста на стаклото, зголемување на електричната отпорност на стаклото и зголемување на способноста на стаклото да впива рендгенски зраци. Додавањето PbO на индустриската керамика (како и стаклото) ги прави материјалите магнетни и електрично поинертни (со зголемување на нивната Кириева температура) и често се користи за оваа намена.[13] Историски PbO исто така бил користен интензивно во керамичките глазури за керамика за домаќинство, и сè уште се користи, но не повеќе. Други помалку доминантни апликации вклучуваат вулканизација на гума и производство на одредени пигменти и бои. PbO се користи во стаклото од катодните цевки за блокирање на емисијата на рендгенските зраци, но главно во вратот и инката бидејќи може да предизвика промена на бојата кога се користи во предната плоча. За предната плоча се претпочитаат стронциум оксид и бариум оксид.[14]
Потрошувачката на олово, а со тоа и обработката на PbO, е во корелација со бројот на автомобили, бидејќи тоа останува клучната компонента на автомобилските оловно-киселински батерии.[15]
Помали или опаѓачки употреби
уредиМешавина од PbO со глицерин се зацврстува на тврд, водоотпорен цемент кој бил користен за спојување на рамните стаклени страни и дното на аквариумите, а некогаш се користел и за запечатување на стаклени панели во прозорските рамки. Тоа е составен дел на оловните бои.
PbO бил една од суровините за вековните јајца, еден вид кинески конзервирани јајца, но постепено бил заменуван поради здравствени проблеми. Тоа била бескрупулозна практика во некои мали фабрики, но станало неконтролирано во НР Кина и принудило многу чесни производители да ги означуваат своите кутии „без олово“ откако скандалот стана широко спространет во 2013 година.
Во облик на четириагонален литаргит во прав, може да се меша со ленено масло, а потоа да се вари за да се создаде големина отпорна на временски услови, што се користи при позлата. Литаргитот ќе и даде на големината темноцрвена боја што го направи златниот лист да изгледа топол и сјаен, додека лененото масло ќе даде адхезија и рамна издржлива површина за врзување.
PbO се користи во одредени реакции на кондензација во органската синтеза.[16]
PbO е влезниот фотопроводник во цевката за видеокамера наречена Plumbicon.
Здравствени проблеми
уредиОловниот оксид може да биде фатален ако се проголта или вдишува. Предизвикува иритација на кожата, очите и дишниот пат. Тоа влијае на ткивото на непцата, на централниот нервен систем, на бубрезите, на крвта и на репродуктивниот систем. Може да се биоакумулира кај растенијата и кај цицачите.[17]
Наводи
уреди- ↑ Blei(II)-oxid[мртва врска]. Merck
- ↑ „Lead compounds (as Pb)“. Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ Carr, Dodd S. (2005), „Lead Compounds“, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a15_249
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. изд.). Butterworth-Heinemann. ISBN 0080379419.
- ↑ Abdel-Rehim, A. M. (2006). „Thermal and XRD analysis of Egyptian galena“. Journal of Thermal Analysis and Calorimetry. 86 (2): 393–401. doi:10.1007/s10973-005-6785-6.
- ↑ Предлошка:Wells5th
- ↑ A simple example is given in Anil Kumar De (2007). „§9.2.6 Lead (Pb): Lead Monoxide PbO“. A Textbook Of Inorganic Chemistry. New Age International. стр. 383. ISBN 978-81-224-1384-7.
- ↑ Rowe, David John (1983). Lead Manufacturing in Britain: A History. Croom Helm. стр. 16. ISBN 978-0-7099-2250-6.
- ↑ Pirovano, Caroline; Islam, M. Saiful; Vannier, Rose-Noëlle; Nowogrocki, Guy; Mairesse, Gaëtan (2001). „Modelling the crystal structures of Aurivillius phases“. Solid State Ion. 140 (1–2): 115–123. doi:10.1016/S0167-2738(01)00699-3.
- ↑ „ICSD Entry: 94333“. Cambridge Structural Database: Access Structures. Кембрички кристалографски податочен центар. Посетено на 27 јуни 2022.
- ↑ Lead Processing @ Universalium.academic.ru.
- ↑ Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (уред.), Inorganic Chemistry, Преведено од Eagleson, Mary; Brewer, William, San Diego/Berlin: Academic Press/De Gruyter, ISBN 0-12-352651-5
- ↑ Chapter 9, "Lead Compounds", in the book Ceramic and Glass Materials: Structure, Properties and Processing, published by Springer, year 2008.
- ↑ Compton, Kenneth (5 December 2003). Image Performance in CRT Displays. SPIE Press. ISBN 9780819441447 – преку Google Books.
- ↑ Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH
- ↑ Corson, B. B. (1936). „1,4-Diphenylbutadiene“. Organic Syntheses. 16: 28.; Collective Volume, 2, стр. 229
- ↑ „Lead(II) oxide“. International Occupational Safety and Health Information Centre. Архивирано од изворникот на 15 декември 2011. Посетено на 27 јуни 2022.
