Диметилцинк
Диметилцинк, исто така познат како цинк метил, DMZ или DMZn, е органозин соединение со хемиска формулаZn(CH
3)
2 . Припаѓа на големата серија на слични соединенија како диетилцинк .
 | |
Назив според МСЧПХ Диметилцинк | |
Други називи
| |
| Назнаки | |
|---|---|
| 544-97-8 | |
| ChEBI | CHEBI:51497 |
| ChemSpider | 10254473 |
| |
| 3Д-модел (Jmol) | Слика |
| PubChem | 11010 |
| |
| UNII | 8H6R0N8W2F |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | Безбојна течност |
| Мирис | Garlic[1] |
| Густина | 1.386 g/cm3 at 10.5 °C[1] |
| Точка на топење | |
| Точка на вриење | |
| Растворливост | Растворлив во ксилен, диетил етер, јаглеводороди; се распаѓа во вода, етанол и киселини[1] |
| Парен притисок | 50.13 kPa[1] |
| Топлинска спроводливост | 0.1627 W/(m∙K) at 70 °C (158 °F)[1] |
| Вискозност | 0.807 mPa·s at 70 °F (21 °C)[1] |
| Термохемија | |
| Специфичен топлински капацитет, C | 129.20 J/(mol∙K) (течност кај 25 °C (77 °F))[2] |
| Опасност | |
| Безбедност при работа: | |
Главни опасности
|
Спонтано се запалува во воздухот и насилно реагира со вода, развивајќи надразнувачки и токсични испарувања.[1] |
| GHS-ознаки: | |
Пиктограми
|
  
|
Сигнални зборови
|
Опасност |
Изјави за опасност
|
H225, H250, H260, H314, H410 |
Изјави за претпазливост
|
P210, P222, P223, P231+P232, P233, P235, P240, P241, P242, P243, P260, P264, P273, P280, P301+P330+P331, P302, P303+P361+P353, P304+P340, P305, P316, P317, P321, P334, P335, P338, P361, P363, P370+P378, P391, P402+P404, P403, P405, P501 |
| NFPA 704 | |
| 0 °F (−18 °C)[1] | |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Подготовка
уредиСе формира со дејство на метил јодид на цинк на покачена температура или на легура на цинк- натриум .
- 2 Zn + 2 CH
3I → Zn(CH
3)
2 + ZnI
2
Натриумот ја помага реакцијата на цинкот со метил јодид. Цинк јодидот се формира како нуспроизвод.
Својства
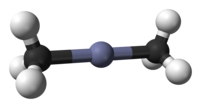
уредиДиметилцинк е безбојна подвижна испарлива течност, која има карактеристичен непријатен мирис налик на лук. Тоа е многу реактивен и силен редукционен агенс . Растворлив е во алкани и често се продава како раствор во хексани . Тројната точка на диметилцинк е 230.13 К (-43.02 °C) ± 0,02 K. Мономерната молекула на диметилцинк е линеарна во центарот на Zn и тетрагонална во центрите C.
Токсичност и опасности
уредиВдишување на диметилцинкова магла или пареа предизвикува непосредна иритација на горниот респираторен тракт и може да предизвика пневмонија и смрт. Очите веднаш и силно се иритираат и изгоруваат од течност, пареа или разредени раствори. Ако не се отстрани со темелно испирање со вода, оваа хемикалија може трајно да ја оштети рожницата и на крајот да предизвика слепило. Доколку диметилцинкот дојде во контакт со кожата, таа добива термички и киселински изгореници, бидејќи оваа хемикалија реагира со влага во кожата. Доколку не се измие брзо, кожата може да има лузни. Голтањето, иако е малку веројатно, предизвикува непосредни изгореници на местото на контакт. Може да следат гадење, повраќање, грчеви и дијареа. Ткивата може да улцерираат ако не се третираат. При загревање се распаѓа до иритирачки и токсични производи.
Контактот на диметилцинк со оксиданти може да доведе до формирање на пероксиди, кои се експлозивни. Диметилцинкот оксидира во воздухот многу бавно, произведувајќи метилцинк метоксидCH
3ZnOCH
3 . Диметилцинкот е многу пирофорен . Може спонтано да се запали во воздухот. Гори во воздух со син пламен, давајќи необичен мирис налик на лук. Производите од распаѓање или огнениот чад содржат цинк оксид, кој сам по себе не е токсичен, но неговите испарувања можат да ги иритираат белите дробови и да предизвикаат треска од метални испарувања, тешки повреди или смрт. Обидот да се изгасне огнот од диметилцинк со вода дури и го засилува огнот, бидејќи диметилцинкот реагира насилно или дури и експлозивно со вода, развивајќи многу запалив гас метан кој може да експлодира во воздухот кога ќе се запали, и чад од цинк оксид што ги иритира белите дробови. Огнот од диметилцинк мора да се изгаси со сув песок. Насилно или експлозивно реагира со метанол, етанол и 2,2-дихлоропропан . Експлодира во кислород и озон . Контејнерите со диметилцинк со неправилно ракување може да експлодираат, предизвикувајќи сериозни повреди или смрт.
Структура
уредиВо цврста состојба соединението постои во две модификации. Тетрагоналната високотемпературна фаза покажува дводимензионално нарушување, додека нискотемпературната фаза која е моноклинична е наредена. Молекулите се линеарни со должина на врската Zn-C со големина од 192,7(6) pm.[3] Структурата на гасната фаза покажува многу слично растојание Zn-C од 193,0(2) pm.[4]
Историја
уредиДиметилцинкот првпат бил подготвен од Едвард Френкланд за време на неговата работа со Роберт Бунсен во 1849 година на Универзитетот во Марбург . Откако ќе се загрее мешавина од цинк и метил јодид во херметички сад, пламенот избувна кога се скрши заптивката.[5] Во лабораторија, овој метод на синтеза денес останува непроменет, освен што бакар или бакарни соединенија се користат за активирање на цинкот.
Користи
уредиДиметилцинкот е од големо значење во синтезата на органски соединенија . Долго време се користеше за внесување на метил групи во органски молекули или за синтеза на органометални соединенија што содржат метил групи. Grignard реагенси (органо-магнезиумски соединенија), кои се полесни за ракување и помалку запаливи, ги заменија органо-цинковите соединенија во повеќето лабораториски синтези. Поради разликите во реактивноста (како и во нуспроизводите на реакцијата) помеѓу органо-цинковите соединенија и Grignard реагенсите, органо-цинковите соединенија може да се претпочитаат во некои синтези.[6]
Неговиот висок притисок на пареа доведе до широка употреба во производството на полупроводници, на пр. металорганско хемиско таложење на пареа ( MOCVD ) за подготовка на полупроводнички филмови со широк опсег II–VI и како p- допантни прекурсори за III-V полупроводници, кои имаат многу електронски и фотонски апликации.[7]
Се користи како забрзувач при вулканизација на гума, фунгицид и средство за метилирање во метилтитаниум трихлорид .
Поврзано
уреди- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 https://pubchem.ncbi.nlm.nih.gov/compound/Dimethylzinc
- ↑ https://www.chemeo.com/cid/15-221-9/dimethylzinc
- ↑ John Bacsa; Felix Hanke; Sarah Hindley; Rajesh Odedra; George R. Darling; Anthony C. Jones; Alexander Steiner (2011). „The Solid State Structures of Dimethylzinc and Diethylzinc“. Angewandte Chemie International Edition. 50 (49): 11685–11687. doi:10.1002/anie.201105099. PMC 3326375. PMID 21919175.
- ↑ A. Haaland; J. C. Green; G. S. McGrady; A. J. Downs; E. Gullo; M. J. Lyall; J. Timberlake; A. V. Tutukin; H. V. Volden (2003). „The length, strength and polarity of metal–carbon bonds: dialkylzinc compounds studied by density functional theory calculations, gas electron diffraction and photoelectron spectroscopy“. Dalton Transactions (22): 4356–4366. doi:10.1039/B306840B.
- ↑ E. Frankland (1849). „Notiz über eine neue Reihe organischer Körper, welche Metalle, Phosphor u. s. w. enthalten“. Liebigs Annalen der Chemie und Pharmacie. 71 (2): 213–216. doi:10.1002/jlac.18490710206.
- ↑ Erdik, Ender (1996). Organozinc reagents in organic synthesis. Boca Raton: CRC Press. ISBN 978-0-8493-9151-4.
- ↑ Mohammad Afzaal; Mohammad A. Malik; Paul O’Brien (2007). „Preparation of zinc containing materials“. New Journal of Chemistry. 31 (12): 2029–2040. doi:10.1039/b712235g.
