Алуминиум хидрид
Алуминиум хидрид (исто така познат како алан и алуман) е неорганско соединение со формула AlH3. Аланот и неговите деривати се вообичаени редукциони (адиција на хидрид) реагенси во органската синтеза кои се користат во раствор и во лабораториски и во индустриски размери.[1] Во растворот - обично во етерични растворувачи како тетрахидрофуран или диетил етер - алуминиум хидридот формира комплекси со Луисовите базите и реагира селективно со одредени органски функционални групи (на пр., со карбоксилни киселини и естри на органски халиди и нитро групи) и иако не е реагенс по избор, може да реагира со повеќекратни врски јаглерод-јаглерод (т.е. преку хидроалуминација). Со оглед на неговата густина и со содржина на водород од редот од 10% по маса,[2] некои форми на алан се, од 2016 година,[3] активни кандидати за складирање на водород и така за производство на енергија во апликациите на горивни ќелии, вклучително и електрични возила. Од 2006 година беше забележано дека е потребно понатамошно истражување за да се идентификува ефикасен, економичен начин за враќање на процесот, регенерирање на алан од потрошен алуминиумски производ.
| |
Претпочитано име по МСЧПХ: Алуминиум хидрид | |
| Систематско име | Алуман |
Други називи Алан Алуминик хидрид | |
| Назнаки | |
|---|---|
| 7784-21-6 | |
| ChEBI | CHEBI:30136 |
| ChemSpider | 13833 17625618 (3H3) |
| 245 | |
| |
| 3Д-модел (Jmol) | Слика |
| PubChem | 14488 14399066 (2H3) 16721258 (3H3) |
| |
| UNII | KZJ3T010RQ |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | бели кристални цврсти, неиспарливи, високо полимеризирани кристали слични на игли |
| Густина | 1.477 g/cm3, solid |
| Точка на топење | |
| реагира | |
| Растворливост | растворлив во диетил етер реагира во етанол |
| Термохемија | |
| Ст. енталпија на образување ΔfH |
-11.4 kJ/mol |
| Стандардна моларна ентропија S |
30 J/mol K |
| Специфичен топлински капацитет, C | 40.2 J/mol K |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Цврстиот алуминиум хидрид, или алан, е безбоен и неиспарлив, а во најчестата форма на реагенс тој е високо полимеризиран вид (т.е. има повеќе единици AlH3 кои се самоповрзани); се топи при распаѓање на 110 °C.[4] Иако не се спонтано запаливи, аланските цврсти материи и раствори бараат мерки на претпазливост при употреба слично на другите високо запаливи метални хидриди и мора да се ракуваат и складираат со активно исклучување на влага од околината. Аланот се распаѓа при изложување на воздух (главно поради поволната влага), иако пасивацијата - овде, овозможувајќи развој на инертна површинска обвивка - во голема мера ја намалува стапката на распаѓање на препаратите од алан.
Форма и структура
уредиАлуминиум хидрид, или алан, е безбојна и неиспарлива цврста супстанца.[4] Се топи при распаѓање на 110 °C.[4] Цврстата форма, сепак, често се претставува како бела цврста материја која може да биде затемната сива (со намалување на големината на честичките на реагенсот или зголемување на нивото на нечистотија). Поточно, во зависност од условите на синтезата, површината на аланот може да биде пасивирана (направена нешто помалку реактивна) со тенок слој од алуминиум оксид или хидроксид.
Како што се користи во вообичаени лабораториски услови, аланот е „високо полимерен“, структурно,[4] а неговата формула понекогаш е претставена како (AlH3)n, каде што вредноста или опсегот на „n“ не се дефинирани. Таквите препарати на алан се раствораат во тетрахидрофуран (THF) или диетил етер (етер).[4] Цврстиот алан може да се таложи од етер, а брзината на неговото правење варира во зависност од начинот на подготовка на растворот од алан.[4][5]
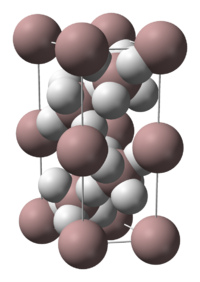
Структурно, аланот може да прими бројни полиморфни форми - од 2006 година, познати се „најмалку 7 несолвирани фази AlH3" : α-, α’-, β-, γ-, ε-, and ζ-алани.[2]; од овој датум, додадени се уште два, δ- and θ-алани. Секој има различна структура, а α-аланот е термички најстабилен полиморф. На пример, кристалографски, α-аланот усвојува кубна или ромбоедрална морфологија, додека α’-аланот формира иглични кристали, а γ-аланот формира снопови од споени игли. Кристалната структура на α-аланот е одредена и содржи алуминиумски атоми опкружени со шест октаедрално ориентирани атоми на водород кои се премостуваат со шест други атоми на алуминиум (види табела), каде што растојанијата Al-H се сите еквивалентни (172 pm) и аголот Al-H-Al е 141°.[6]
| Кристалографска структура на α-AlH3[6] | |||||
|---|---|---|---|---|---|
| Единечна ќелија на α-AlH3 | Координација на Al | Координација на H | |||
Кога β- и γ-аланите се произведуваат заедно, тие се претвораат во α-алан при загревање, додека δ-, ε- и θ-аланите се произведуваат во други услови на кристализација; иако тие се помалку термички стабилни, полиморфите δ-, ε- и θ-алан не се претвораат во α-алан при загревање.[5]
Под посебни услови, неполимерните алани (т.е. молекуларни форми на нив) може да се подготват и проучуваат. Мономерниот AlH3 е изолиран на ниска температура во цврста матрица на благороден гас каде што се покажа дека е планарна.[7] Димерната форма, Al2H6, е изолирана во цврст водород и е изоструктурна со диборан (B2H6) и дигалан (Ga2H6).[8][9]
Ракување
уредиАлан не е спонтано запалив.[4][10] Сепак, се препорачува „слично ракување и мерки на претпазливост како што се применуваат за LiAlH4" (хемискиот реагенс, литиум алуминиум хидрид), бидејќи неговата „реактивност е споредлива“ со овој поврзан редуцирачки реагенс.[4] За овие реагенси, и препаратите во раствори и изолираните цврсти материи се „многу запаливи и мора да се складираат во отсуство на влага“.[11] Кога се користи во стандардни лабораториски количини и препарати, аланот се користи во дигестор.[4] Цврстите супстанци од овој тип на реагенс носат препораки за ракување „главбокс или сува кутија“.[11]. По употребата, контејнерите со растворот обично се затвораат цврсто со истовремено испирање со безводен („сув“) инертен гас, на пр., азот или аргон, за да се исклучи воздухот (и кислородот и влагата што ги содржи).[11][12] Она што во голема мера ја намалува стапката на распаѓање поврзана со аланските препарати, пасивираниот алан сепак ја задржува класификацијата на опасност од 4.3 (хемикалии кои во контакт со вода испуштаат запаливи гасови).[13]
Подготовка
уредиАлуминиумските хидриди и различните нивни комплекси се одамна познати.[14] Неговата прва синтеза беше објавена во 1947 година, а патентот за синтезата беше доделен во 1999 година.[15][16] Алуминиум хидрид се подготвува со третирање на литиум алуминиум хидрид со алуминиум трихлорид.[17] Постапката е сложена: мора да се посвети внимание на отстранувањето на литиум хлоридот.
- 3 LiAlH4 + AlCl3 → 4 AlH3 + 3 LiCl
Етерскиот раствор на алан бара итна употреба, бидејќи полимерниот материјал брзо се таложи како цврста материја. Познато е дека растворите на алуминиум хидрид се разградуваат по 3 дена. Алуминиум хидрид е пореактивен од LiAlH4.[5]
Постојат неколку други методи за подготовка на алуминиум хидрид:
- 2 LiAlH4 + BeCl2 → 2 AlH3 + Li2BeH2Cl2
- 2 LiAlH4 + H2SO4 → 2 AlH3 + Li2SO4 + 2 H2
- 2 LiAlH4 + ZnCl2 → 2 AlH3 + 2 LiCl + ZnH2
- 2 LiAlH4 + I2 → 2 AlH3 + 2 LiI + H2
Електрохемиска синтеза
уредиНеколку групи покажаа дека аланот може да се произведе електрохемиски.[18][19][20][21][22] Патентирани се различни методи за производство на електрохемиски алан.[23][24] Електрохемиски генерирачкиот алан ги избегнува нечистотиите од хлорид. Се дискутираат два можни механизми за формирање на алан во електрохемиската ќелија на Класен што содржи THF како растворувач, натриум алуминиум хидрид како електролит, алуминиумска анода и железна (Fe) жица потопена во жива (Hg) како катода. Натриумот формира амалгам со катодата Hg што ги спречува несаканите реакции и водородот произведен во првата реакција може да се зароби и да реагира назад со натриум жива амалгам за да произведе натриум хидрид. Системот на Класен не резултира со губење на почетниот материјал. За нерастворливите аноди се јавува реакција 1, додека за растворливите аноди се очекува анодно растворање според реакцијата 2:
- AlH4− - e− → AlH3 · nTHF + 1⁄2H2
- 3AlH4− + Al - 3e− → 4AlH3 · nTHF
Во реакцијата 2, алуминиумската анода се троши, ограничувајќи го производството на алуминиум хидрид за дадена електрохемиска ќелија.
Докажано е кристализација и обновување на алуминиум хидрид од електрохемиски генериран алан.[21][22]
Хидрогенирање на алуминиум метал со висок притисок
уредиα-AlH3 може да се произведе со хидрогенизација на алуминиумски метал на 10 GPa и 600 °C (1,112 °F). Реакцијата помеѓу течниот водород произведува α-AlH3 кој може да се поврати во амбиентални услови.[25]
Реакции
уредиФормирање на адукти со Луисови бази
уредиAlH3 лесно формира адукти со силни Луисова бази. На пример, двата комплекси 1:1 и 1:2 се формираат со триметиламин. Комплексот 1:1 е тетраедрален во гасната фаза,[26] но во цврстата фаза е димерен со премостувачките водородни центри, (NMe3Al(μ-H))2.[27] Комплексот 1:2 прифаќа тригонална бипирамидална структура.[26] Некои адукти (на пр. диметилетиламин алан, NMe2Et · AlH3) термички се распаѓаат за да дадат алуминиум метал и може да се користат во MOCVD апликации.[28]
Неговиот комплекс со диетил етер се формира според следната стехиометрија:
- AlH3 + (C2H5)2O → H3Al · O(C2H5)2
Реакцијата со литиум хидрид во етер произведува литиум алуминиум хидрид:
- AlH3 + LiH → LiAlH4
Редукција на функционалните групи
уредиВо органската хемија, алуминиум хидрид главно се користи за редукција на функционални групи.[29] На многу начини, реактивноста на алуминиум хидрид е слична на онаа на литиум алуминиум хидрид. Алуминиум хидрид ќе ги редуцира алдехидите, кетоните, карбоксилните киселини, анхидридите, киселинските хлориди, естрите и лактоните до нивните соодветни алкохоли. Амидите, нитрилите и оксимите се редуцираат до нивните соодветни амини.
Во однос на селективноста на функционалната група, аланот се разликува од другите хидридни реагенси. На пример, во следната редукција на циклохексанон, литиум алуминиум хидрид дава транс : цис сооднос од 1,9 : 1, додека алуминиум хидрид дава транс : цис сооднос од 7,3 : 1.[30]
Аланот овозможува хидроксиметилација на одредени кетони (тоа е замена на C-H со C-CH2OH на алфа позицијата).[31] Самиот кетон не се редуцира бидејќи е „заштитен“ како негов енолат.
Органохалидите се редуцираат бавно или воопшто не се редуцираат со алуминиум хидрид. Затоа, реактивните функционални групи како што се карбоксилните киселини може да се редуцираат во присуство на халиди.[32]
Нитро групите не се редуцираат со алуминиум хидрид. Исто така, алуминиум хидрид може да постигне редукција на естер во присуство на нитро групи.[33]
Алуминиум хидрид може да се користи за редукција на ацеталите на половина заштитени диоли.[34]
Алуминиум хидрид може да се користи и во реакцијата за отворање на епоксиден прстен како што е прикажано подолу.[35]
Реакцијата на алилично преуредување спроведена со употреба на алуминиум хидрид е SN2 реакција и не е стерично.[36]
Алуминиум хидрид го редуцира јаглерод диоксидот во метан со загревање:
- 4 AlH3 + 3 CO2 → 3 CH4 + 2 Al2O3
Хидроалуминација
уредиСе покажа дека алуминиум хидрид се додава во пропаргилните алкохоли.[37] Слично на хидроборацијата, алуминиум хидридот може, во присуство на титаниум тетрахлорид, да додаде вода на двојни врски.[38]
Гориво
уредиВо својата пасивирана форма, аланот е активен кандидат за складирање на водород и може да се користи за ефикасно производство на енергија преку апликации со горивни ќелии, вклучително и горивни ќелии и електрични возила и други апликации со мала тежина. AlH3 содржи до 10,1 % водород по тежина (со густина од 1,48 грама на милилитар),[2] или двапати поголема од густината на водородот од течноста H2. Почнувајќи од 2006 година, AlH3 беше опишан како кандидат за кој „ќе бидат потребни дополнителни истражувања за да се развие ефикасен и економичен процес за негово регенерирање од потрошениот прав на Al“.[2]
Алан е исто така потенцијален додаток на ракетното гориво и во експлозивни и пиротехнички состави. Во својата непасивни форма, аланот е исто така ветувачки додаток за ракетно гориво, способен да испорача зголемување на импулсната ефикасност до 10%.[39]
Пријавени несреќи
уредиРедукцијата на трифлуорометил соединението со алан беше пријавено дека предизвика „сериозна експлозија“.[40]
Дополнителна литература
уреди- Science Direct Staff (2022). „Alane“. ScienceDirect.com. Amsterdam, The Netherlands: Elsevier B.V.
- Science Direct Staff (2022). „Aluminum Hydride“. ScienceDirect.com. Amsterdam, The Netherlands: Elsevier B.V.
Наводи
уреди- ↑ Brown, H. C.; Krishnamurthy, S. (1979). „Forty Years of Hydride Reductions“. Tetrahedron. 35 (5): 567–607. doi:10.1016/0040-4020(79)87003-9.[да се провери]
- ↑ 2,0 2,1 2,2 2,3 Graetz, J.; Reilly, J.; Sandrock, G.; Johnson, J.; Zhou, W.-M. & Wegrzyn, J. (2006). Aluminum Hydride, A1H3, As a Hydrogen Storage Compound (Report). Washington, D.C.: Office of Science and Technical Information [OSTI]. doi:10.2172/899889. OSTI 899889. Посетено на 28 July 2022.CS1-одржување: користи параметар authors (link)
- ↑ Lin-Lin Wang; Aditi Herwadkar; Jason M. Reich; Duane D. Johnson; Stephen D. House; Pamela Peña-Martin; Angus A. Rockett; Ian M. Robertson; Shalabh Gupta; Vitalij K. Pecharsky (2016). „Towards Direct Synthesis of Alane: A Predicted Defect-Mediated Pathway Confirmed Experimentally“. ChemSusChem. 9 (17): 2358–2364. doi:10.1002/cssc.201600338. PMID 27535100.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 4,7 4,8 Galatsis, P; Sintim, Herman O. & Wang J. (15 September 2008). „Aluminum Hydride“. Encyclopedia of Reagents for Organic Synthesis [online edition]. New York, N.Y.: John Wiley & Sons. doi:10.1002/047084289X.ra082.pub2. ISBN 978-0471936237. Посетено на 28 July 2022.CS1-одржување: повеќе имиња: список на автори (link)
- ↑ 5,0 5,1 5,2 US application 2007066839, Lund, G. K.; Hanks, J. M.; Johnston, H. E., "Method for the Production of α-Alane."Предлошка:Primary source inline
- ↑ 6,0 6,1 Turley, J. W.; Rinn, H. W. (1969). „The Crystal Structure of Aluminum Hydride“. Inorganic Chemistry. 8 (1): 18–22. doi:10.1021/ic50071a005.Предлошка:Primary source inline
- ↑ Kurth, F. A.; Eberlein, R. A.; Schnöckel, H.-G.; Downs, A. J.; Pulham, C. R. (1993). „Molecular Aluminium Trihydride, AlH3: Generation in a Solid Noble Gas Matrix and Characterisation by its Infrared Spectrum and ab initio Calculations“. Journal of the Chemical Society, Chemical Communications. 1993 (16): 1302–1304. doi:10.1039/C39930001302.Предлошка:Primary source inline
- ↑ Andrews, L.; Wang, X. (2003). „The Infrared Spectrum of Al2H6 in Solid Hydrogen“. Science. 299 (5615): 2049–2052. Bibcode:2003Sci...299.2049A. doi:10.1126/science.1082456. PMID 12663923. S2CID 45856199.Предлошка:Primary source inline
- ↑ Pulham, C. R.; Downs, A. J.; Goode, M. J.; Rankin D. W. H.; Robertson, H. E. (1991). „Gallane: Synthesis, Physical and Chemical Properties, and Structure of the Gaseous Molecule Ga2H6 as Determined by Electron Diffraction“. Journal of the American Chemical Society. 113 (14): 5149–5162. doi:10.1021/ja00014a003.Предлошка:Primary source inline
- ↑ Note, this source states this fact using the related traditional Anglo-chemical term, "inflammable".
- ↑ 11,0 11,1 11,2 Paquette, L.A.; Ollevier, t. & Desyroy, V. (15 October 2004). „Lithium Aluminum Hydride“. Encyclopedia of Reagents for Organic Synthesis [online edition]. New York, N.Y.: John Wiley & Sons. doi:10.1002/047084289X.rl036.pub2. ISBN 0471936235. Посетено на 28 July 2022.CS1-одржување: повеќе имиња: список на автори (link)
- ↑ Alane will decompose in air, in large part due to advantitious moisture in air, and it rapidly decomposes when exposed to water (directly, or in solution).[се бара извор]
- ↑ 2013 CFR Title 29 Volume 6 Section 1900.1200 Appendix B.12
- ↑ Brower, F. M.; Matzek, N. E.; Reigler, P. F.; Rinn, H. W.; Schmidt, D. L.; Snover, J. A.; Terada, K. (1976). „Preparation and Properties of Aluminum Hydride“. Journal of the American Chemical Society. 98 (9): 2450–2454. doi:10.1021/ja00425a011.
- ↑ Finholt, A. E.; Bond, A. C. Jr.; Schlesinger, H. I. (1947). „Lithium Aluminum Hydride, Aluminum Hydride and Lithium Gallium Hydride, and Some of their Applications in Organic and Inorganic Chemistry“. Journal of the American Chemical Society. 69 (5): 1199–1203. doi:10.1021/ja01197a061.
- ↑ US patent 6228338, Petrie, M. A.; Bottaro, J. C.; Schmitt, R. J.; Penwell, P. E.; Bomberger, D. C., "Preparation of Aluminum Hydride Polymorphs, Particularly Stabilized α-AlH3", issued 2001-05-08
- ↑ Schmidt, D. L.; Roberts, C. B.; Reigler, P. F.; Lemanski, M. F. Jr.; Schram, E. P. (1973). „Aluminum Trihydride-diethyl etherate ( Etherated Alane )“. Inorganic Syntheses. 14. стр. 47–52. doi:10.1002/9780470132456.ch10. ISBN 9780470132456.
- ↑ Alpatova, N. M.; Dymova, T. N.; Kessler, Yu. M.; Osipov, O. R. (1968). „Physicochemical Properties and Structure of Complex Compounds of Aluminium Hydride“. Russian Chemical Reviews. 37 (2): 99–114. Bibcode:1968RuCRv..37...99A. doi:10.1070/RC1968v037n02ABEH001617. S2CID 250839118 Проверете ја вредноста
|s2cid=(help). - ↑ Semenenko, K. N.; Bulychev, B. M.; Shevlyagina, E. A. (1966). „Aluminium Hydride“. Russian Chemical Reviews. 35 (9): 649–658. Bibcode:1966RuCRv..35..649S. doi:10.1070/RC1966v035n09ABEH001513. S2CID 250889877 Проверете ја вредноста
|s2cid=(help). - ↑ Osipov, O. R.; Alpatova, N. M.; Kessler, Yu. M. (1966). Elektrokhimiya. 2: 984.CS1-одржување: списание без наслов (link)
- ↑ 21,0 21,1 Zidan, R.; Garcia-Diaz, B. L.; Fewox, C. S.; Stowe, A. C.; Gray, J. R.; Harter, A. G. (2009). „Aluminium hydride: a reversible material for hydrogen storage“. Chemical Communications (25): 3717–3719. doi:10.1039/B901878F. PMID 19557259. S2CID 21479330.
- ↑ 22,0 22,1 Martinez-Rodriguez, M. J.; Garcia-Diaz, B. L.; Teprovich, J. A.; Knight, D. A.; Zidan, R. (2012). „Advances in the electrochemical regeneration of aluminum hydride“. Applied Physics A: Materials Science & Processing. 106 (25): 545–550. Bibcode:2012ApPhA.106..545M. doi:10.1007/s00339-011-6647-y. S2CID 93879202.
- ↑ DE patent 1141623, Clasen, H., "Verfahren zur Herstellung von Aluminiumhydrid bzw. aluminiumwasserstoffreicher komplexer Hydride", issued 1962-12-27, assigned to Metallgesellschaft
- ↑ US patent 8470156, Zidan, R., "Electrochemical process and production of novel complex hydrides", issued 2013-06-25, assigned to Savannah River Nuclear Solutions, LLC
- ↑ Saitoh, H; Sakurai, Y; Machida, A; Katayama, Y; Aoki, K (2010). „In situX-ray diffraction measurement of the hydrogenation and dehydrogenation of aluminum and characterization of the recovered AlH3“. Journal of Physics: Conference Series. 215 (1): 012127. Bibcode:2010JPhCS.215a2127S. doi:10.1088/1742-6596/215/1/012127. ISSN 1742-6596.
- ↑ 26,0 26,1 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. изд.). Butterworth-Heinemann. ISBN 0080379419.
- ↑ Atwood, J. L.; Bennett, F. R.; Elms, F. M.; Jones, C.; Raston, C. L.; Robinson, K. D. (1991). „Tertiary Amine Stabilized Dialane“. Journal of the American Chemical Society. 113 (21): 8183–8185. doi:10.1021/ja00021a063.
- ↑ Yun, J.-H.; Kim, B.-Y.; Rhee, S.-W. (1998). „Metal-Organic Chemical Vapor Deposition of Aluminum from Dimethylethylamine Alane“. Thin Solid Films. 312 (1–2): 259–263. Bibcode:1998TSF...312..259Y. doi:10.1016/S0040-6090(97)00333-7.
- ↑ Galatsis, P. (2001). „Diisobutylaluminum Hydride“. Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rd245. ISBN 978-0-470-84289-8.
- ↑ Ayres, D. C.; Sawdaye, R. (1967). „The Stereoselective Reduction of Ketones by Aluminium Hydride“. Journal of the Chemical Society B. 1967: 581–583. doi:10.1039/J29670000581.
- ↑ Corey, E. J.; Cane, D. E. (1971). „Controlled Hydroxymethylation of Ketones“. Journal of Organic Chemistry. 36 (20): 3070. doi:10.1021/jo00819a047.
- ↑ Jorgenson, Margaret J. (July 1962). „Selective reductions with aluminum hydride“. Tetrahedron Letters. 3 (13): 559–562. doi:10.1016/S0040-4039(00)76929-2.
- ↑ Takano, S.; Akiyama, M.; Sato, S.; Ogasawara, K. (1983). „A Facile Cleavage of Benzylidene Acetals with Diisobutylaluminum Hydride“ (pdf). Chemistry Letters. 12 (10): 1593–1596. doi:10.1246/cl.1983.1593.[мртва врска]
- ↑ Richter, W. J. (1981). „Asymmetric Synthesis at Prochiral Centers: Substituted 1,3-Dioxolanes“. Journal of Organic Chemistry. 46 (25): 5119–5124. doi:10.1021/jo00338a011.
- ↑ Maruoka, K.; Saito, S.; Ooi, T.; Yamamoto, H. (1991). „Selective Reduction of Methylenecycloalkane Oxides with 4-Substituted Diisobutylaluminum 2,6-Di-tert-butylphenoxides“. Synlett. 1991 (4): 255–256. doi:10.1055/s-1991-20698.
- ↑ Claesson, A.; Olsson, L.-I. (1979). „Allenes and Acetylenes. 22. Mechanistic Aspects of the Allene-Forming Reductions (SN2' Reaction) of Chiral Propargylic Derivatives with Hydride Reagents“. Journal of the American Chemical Society. 101 (24): 7302–7311. doi:10.1021/ja00518a028.
- ↑ Corey, E. J.; Katzenellenbogen, J. A.; Posner, G. H. (1967). „New Stereospecific Synthesis of Trisubstituted Olefins. Stereospecific Synthesis of Farnesol“. Journal of the American Chemical Society. 89 (16): 4245–4247. doi:10.1021/ja00992a065.
- ↑ Sato, F.; Sato, S.; Kodama, H.; Sato, M. (1977). „Reactions of Lithium Aluminum Hydride or Alane with Olefins Catalyzed by Titanium Tetrachloride or Zirconium Tetrachloride. A Convenient Route to Alkanes, 1-Haloalkanes and Terminal Alcohols from Alkenes“. Journal of Organometallic Chemistry. 142 (1): 71–79. doi:10.1016/S0022-328X(00)91817-5.
- ↑ Calabro, M. (2011). „Overview of Hybrid Propulsion“. Progress in Propulsion Physics. 2: 353–374. Bibcode:2011EUCAS...2..353C. doi:10.1051/eucass/201102353. ISBN 978-2-7598-0673-7.
- ↑ Taydakov, Ilya V. (2020-07-08). „Serious Explosion during Large-Scale Preparation of an Amine by Alane (AlH3) Reduction of a Nitrile Bearing a CF3 Group“. ACS Chemical Health & Safety. American Chemical Society (ACS). 27 (4): 235–239. doi:10.1021/acs.chas.0c00045. ISSN 1871-5532. S2CID 225542103.
Надворешни врски
уреди- Aluminium Hydride on EnvironmentalChemistry.com Chemical Database
- Hydrogen Storage from Brookhaven National Laboratory
- Aluminum Trihydride on WebElements