Бариум хлорид
Бариум хлорид — неорганско соединение сохемиска формула BaCl
2. Таа е една од најчестите соли на бариум растворливи во вода. Како и повеќето други соли на бариум растворливи во вода, тој е бел прав, многу токсичен и дава жолто-зелена боја на пламен. Исто така е хигроскопен, претворајќи се во дихидрат BaCl
2 · 2H2O, кои се безбојни кристали со горчлив солен вкус. Има ограничена употреба во лабораторијата и индустријата.[3][7]
| |

| |
Други називи
| |
| Назнаки | |
|---|---|
| 10361-37-2 10326-27-9 (дихидрат) | |
| ChemSpider | 23540 |
| EC-број | 233-788-1 |
| |
| 3Д-модел (Jmol) | Слика |
| PubChem | 25204 |
| RTECS-бр. | CQ8750000 (анхидрид) CQ8751000 (дихидрат) |
| |
| UNII | 0VK51DA1T2 EL5GJ3U77E (дихидрат) |
| ОН-бр. | 1564 |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | Бела пудра, безбојни или бели кристали (анхидридна) безбојни ромбоидни кристсали (дихидрат)[2][3] |
| Мирис | Без мирис |
| Густина | 3.856 g/cm3 (анхидриден) 3.0979 g/cm3 (дихидрат) |
| Точка на топење | |
| Точка на вриење | |
| |
| Растворливост | Растворлив во метанол, нерастворлив во етил ацетат, слабо растворлив во хлороводородна киселина е азотна киселина, многу малку растворлив во етанол.[3][4] Дихидратот е рассворлив во метанол, скоро нерастворлив во етанол, ацетон е етил ацетат.[3] |
| −72.6·10−6 cm3/mol | |
| Структура | |
| Кристална структура | ортогонален (анхидриден) mмоноклиничен (дихидрат) |
| Термохемија | |
| Ст. енталпија на образување ΔfH |
−858.56 kJ/mol |
| Стандардна моларна ентропија S |
123.9 J/(mol·K) |
| Опасност | |
| Безбедност при работа: | |
Главни опасности
|
Високо токсичен, корозивен |
| GHS-ознаки: | |
Пиктограми
|

|
Сигнални зборови
|
Опасност |
Изјави за опасност
|
H301, H302, H332 |
Изјави за претпазливост
|
P261, P264, P270, P271, P301+P310, P304+P312, P304+P340, P312, P321, P330, P405, P501 |
| NFPA 704 | |
| Температура на запалување | Non-flammable |
| Смртоносна доза или концентрација: | |
LD50 (средна доза)
|
78 mg/kg (стаорец, орално) 50 mg/kg (прање, орално)[6] |
LDLo (најниска објавена)
|
112 mg/kg (како Ba) (зајак, орално) 59 mg/kg (како Ba) (куче, орално) 46 mg/kg (како Ba) (глушец, орално)[6] |
| NIOSH (здравствени граници во САД): | |
PEL (дозволива)
|
TWA 0.5 mg/m3[5] |
REL (препорачана)
|
TWA 0.5 mg/m3[5] |
IDLH (непосредна опасност)
|
50 mg/m3[5] |
| Безбедносен лист | NIH BaCl |
| Слични супстанци | |
| Други анјони | |
| Други катјони | |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Подготовка
уредиOНа индустриско ниво, бариум хлоридот се подготвува преку двостепен процес од барит (бариум сулфат).[8] Првиот чекор бара високи температури.
Вториот чекор бара реакција помеѓу бариум сулфид и хлороводород:
- BaS + 2 HCl → BaCl
2 + H
2S
ли помеѓу бариум сулфид и калциум хлорид:
- BaS + CaCl
2 → CaS + BaCl
2[2]
На местото на HCl, може да се користи хлор.[7] Од смесата со вода се извлекува бариум хлорид. Од водни раствори на бариум хлорид, неговиот дихидрат(BaCl
2 · 2H2O) може да се кристализира како безбојни кристали.[2]
Бариум хлоридот во принцип може да се подготви со реакција помеѓу бариум хидроксид или бариум карбонат со хидроген хлорид. Овие основни соли реагираат со хлороводородна киселина и даваат хидриран бариум хлорид.
- Ba(OH)
2 + 2 HCl → BaCl
2 + 2 H
2O - BaCO
3 + 2 HCl → BaCl
2 + H
2O + CO
2
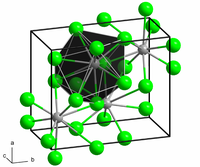
Структура и својства
уредиBaCl
2 кристализира во две форми (полиморфи). Едната форма има структура на кубен флуорит (CaF
2) а другата структура на ортохомбична котунит (PbCl
2). И двата полиморфи ја прифаќаат предноста на големиот Ba2+ он за координативни броеви поголеми од шест.[9] Координацијата на Ba2+ е 8 во флуоритната структура[10] и 9 во структурата на котунит.[11] Кога BaCl
2 од конунитската структура е подложен на притисоци од 7–10 GPa, тој се трансформира во трета структура, моноклинична пост-котунитна фаза. Координативниот број на Ba2+ се зголемува од 9 на 10.[12]
Во воден раствор BaCl
2 behaves as a simple salt; се однесува како едноставна сол и растворот покажува неутрална pH вредност. Неговите раствори реагираат со сулфат јон за да се добие густ бел талог од бариум сулфат.
Оксалат има слична реакција:
Кога се меша со натриум хидроксид, се добива бариум хидроксид, кој е умерено растворлив во вода.
- BaCl
2 + 2 NaOH → 2 NaCl + Ba(OH)
2
BaCl
2 · 2H2O е стабилен во воздухот на собна температура, но губи една вода на кристализација над 55 °C (131 °F), стануваBaCl
2 · H2O, и станува безводен над 121 °C (250 °F).[2] BaCl
2 · H2O may be formed by shaking the dihydrate with methanol.[3]
BaCl
2 може да се формира со протресување на дихидратот со метанол.[3]
Употреба
уредиИако е евтин, бариум хлоридот наоѓа ограничена примена во лабораторијата и индустријата.[7] Се користи и за правење црвени пигменти како што се Lithol red и Red Lake C. Неговата токсичност ја ограничува неговата применливост.
Токсичност
уредиБариум хлоридот, заедно со другите соли на бариум растворливи во вода, е многу токсичен.[13] и иритира очите и кожата, предизвикувајќи црвенило и болка. Ги оштетува бубрезите. Фаталната доза на бариум хлорид за човек е пријавена дека е околу 0,8-0,9 g. Системските ефекти на акутната токсичност на бариум хлорид вклучуваат абдоминална болка, дијареа, гадење, повраќање, срцева аритмија, мускулна парализа и смрт. Ba2+ јоните се натпреваруваат со јоните на K+
предизвикувајќи мускулните влакна да бидат електрично невозбудливи, а со тоа предизвикува слабост и парализа на телото.[3] Натриум сулфат и магнезиум сулфат се потенцијални противотрови бидејќи формираат бариум сулфат BaSO4, кој е релативно нетоксичен поради неговата нерастворливост во вода.
Бариум хлоридот не е класифициран како човечки канцероген.[3]
Наводи
уреди- ↑ Chemical Recreations: A Series of Amusing and Instructive Experiments, which May be Performed with Ease, Safety, Success, and Economy ; to which is Added, the Romance of Chemistry : An Inquiry into the Fallacies of the Prevailing Theory of Chemistry : With a New Theory and a New Nomenclature. R. Griffin & Company. 1834.
- ↑ 2,0 2,1 2,2 2,3 https://www.sciencedirect.com/topics/chemistry/barium-chloride
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 https://pubchem.ncbi.nlm.nih.gov/compound/Barium-chloride
- ↑ Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- ↑ 5,0 5,1 5,2 „Џебен водич за опасните хемиски материи #0045“. Национален институт за безбедност и здравје при работа (NIOSH). (англиски)
- ↑ 6,0 6,1 „Barium (soluble compounds, as Ba)“. Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ 7,0 7,1 7,2 Kresse, Robert; Baudis, Ulrich; Jäger, Paul; Riechers, H. Hermann; Wagner, Heinz; Winkler, Jocher; Wolf, Hans Uwe (2007). „Barium and Barium Compounds“. Во Ullman, Franz (уред.). Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a03_325.pub2. ISBN 978-3527306732.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. изд.). Butterworth-Heinemann. ISBN 0080379419.
- ↑ Wells, A. F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- ↑ Haase, A.; Brauer, G. (1978). „Hydratstufen und Kristallstrukturen von Bariumchlorid“. Z. anorg. allg. Chem. 441: 181–195. doi:10.1002/zaac.19784410120.
- ↑ Brackett, E. B.; Brackett, T. E.; Sass, R. L. (1963). „The Crystal Structures of Barium Chloride, Barium Bromide, and Barium Iodide“. J. Phys. Chem. 67 (10): 2132. doi:10.1021/j100804a038.
- ↑ Léger, J. M.; Haines, J.; Atouf, A. (1995). „The Post-Cotunnite Phase in BaCl2, BaBr2 and BaI2 under High Pressure“. J. Appl. Crystallogr. 28 (4): 416. doi:10.1107/S0021889895001580.
- ↑ The Merck Index, 7th edition, Merck & Co., Rahway, New Jersey, 1960.
