Октан
Октан — јаглеводород и алкан so хемиската формула C
8H
18 и згусната структурна формула CH
3(CH
2)
6CH
3. Има многу структурни изомери кои се разликуваат по мерата и местото на разгранување на јаглеродната верига. Еден од овие изомери, 2,2,4-триметилпентан (наречен изооктан) се користи како една од стандардните вредности во октанскиот број.
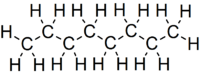
| |

| |
| |
| Систематско име | октан[1] |
Други називи n-октан | |
| Назнаки | |
|---|---|
| 111-65-9 | |
| 3DMet | B00281 |
| Бајлштајн | 1696875 |
| ChEBI | CHEBI:17590 |
| ChEMBL | ChEMBL134886 |
| ChemSpider | 349 |
| DrugBank | DB02440 |
| EC-број | 203-892-1 |
| 82412 | |
| 3Д-модел (Jmol) | Слика |
| KEGG | C01387 |
| MeSH | octane |
| PubChem | 356 |
| RTECS-бр. | RG8400000 |
| |
| UNII | X1RV0B2FJV |
| ОН-бр. | 1262 |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | безбојна течност |
| Мирис | бензински |
| Густина | 0,703 г/см3 |
| Точка на топење | |
| Точка на вриење | |
| 0,007 мг/дм3 (при 20 °C) | |
| log P | 4,783 |
| Парен притисок | 1,47 kPa (при 20,0 °C) |
Хенриева константа (kH)
|
29 nmol/(Pa·кг) |
| Конјуг. киселина | октониум |
| −96,63·10−6 см3/mol | |
| Показател на прекршување (nD) | 1,398 |
| Вискозност |
|
| Термохемија | |
| Ст. енталпија на образување ΔfH |
−252,1 - −248,5 kJ/mol |
| Ст. енталпија на согорување ΔcH |
−5,53 - −5,33 MJ/mol |
| Стандардна моларна ентропија S |
361,20 J/(K·mol) |
| Специфичен топлински капацитет, C | 255,68 J/(K·mol) |
| Опасност | |
| GHS-ознаки: | |
Пиктограми
|
   
|
Сигнални зборови
|
ОПАСНОСТ |
Изјави за опасност
|
H225, H304, H315, H336, H410 |
Изјави за претпазливост
|
P210, P261, P273, P301+P310, P331 |
| NFPA 704 | |
| Температура на запалување | 130 °C (266 °F; 403 K) |
| 2,200 °C (3,990 °F; 2,470 K) | |
| Граници на запалливост | 0,96 – 6,5 % |
| Смртоносна доза или концентрација: | |
LDLo (најниска објавена)
|
428 мг/кг (глушец, венски)[3] |
| NIOSH (здравствени граници во САД): | |
PEL (дозволива)
|
TWA 500 мд (2350 мг/м3) |
REL (препорачана)
|
TWA 75 мд (350 мг/м3) C 385 мд (1800 мг/м3) [15-мин.] |
IDLH (непосредна опасност)
|
1000 мд |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Ова соединение е состојка на бензинот.[4] Како и сите јаглеводороди со мала молекулска маса, октанот е испарлив и многу запалив.
Во бензинот
уредиЗборот „октан“ се користи за октански број, кој е показател за способноста на горивото да го сузбие тропањето кај моторите со разни соодноси на набивање, што е својствено за разгранетите ланчени изомери на октанот, особено за изооктанот. Октанскиот број на бензинот не е непосредно поврзан со моќноста на моторот. Употребата на повисокооктанско гориво отколку предвиденото за моторот не ја зголемува неговата моќ.
Октанскиот број првично е утврден со мешање на горива само од нормален хептан и изооктан (2,2,4-триметилпентан, високоразгранет октан) и давање на противтропачки оцени од нула за нормален хетптан до 100 за чист изооктан. Противтропачката способност е зависна од уделот на изооктан во смесата. Различните изомери на октанот даваат помал или поголем октански број. На пример, n-октан (правиот ланец со 8 јаглеродни атоми без разгранетост) има негативна оценка од -20, а чистиот изооктан се оценува со 100. Некои горива имаат октански број поголем од 100, особено тие што содржат метанол или етанол.
Изомери
уредиОктанот има 18 структурни изомери (24 броејќи ги стереоизомерите):
- октан (n-октан)
- 2-метилхептан
- 3-метилхептан (2 енантиомера)
- 4-метилхептан
- 3-етилхексан
- 2,2-диметилхексан
- 2,3-диметилхексан (2 енантиомера)
- 2,4-диметилхексан (2 енантиомера)
- 2,5-диметилхексан
- 3,3-диметилхексан
- 3,4-диметилхексан (2 енантиомера + 1 мезосоединение)
- 3-етил-2-метиплентан
- 3-етил-3-метиплентан
- 2,2,3-триметилпентан (2 енантиомер)
- 2,2,4-триметилпентан (изооктан)
- 2,3,3-триметилпентан
- 2,3,4-триметилпентан
- 2,2,3,3-тетраметилбутан
Наводи
уреди- ↑ „octane - Compound Summary“. PubChem Compound. USA: National Center for Biotechnology Information. 16 септември 2004. Identification and Related Records. Посетено на 6 јануари 2012.
- ↑ Dymond, J. H.; Oye, H. A. (1994). „Viscosity of Selected Liquid n‐Alkanes“. Journal of Physical and Chemical Reference Data. 23 (1): 41–53. Bibcode:1994JPCRD..23...41D. doi:10.1063/1.555943. ISSN 0047-2689.
- ↑ „Octane“. Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ „октан“ — Дигитален речник на македонскиот јазик
Надворешни врски
уреди- Меѓународна картичка за хемиска безбедност 0933 (англиски)
- „Џебен водич за опасните хемиски материи #0470“. Национален институт за безбедност и здравје при работа (NIOSH). (англиски)
