Глобин
Глобините се натсемејство на глобуларни белковини кои содржат хем и се вклучени во врзувањето и/или транспортот на кислород. Овие белковини во својот состав го содржат глобинскиот склоп, кој претставува групација на осум алфа-завојни сегменти. Два најпознати членови на ова натсемејство се миоглобинот и хемоглобинот. И двете белковини реверзибилно врзуваат кислородот преку хемот, кој игра улога на простетична група. Глобините се широко распространети во живиот свет.[2]
| Глобинска фамилија | |||||||||
|---|---|---|---|---|---|---|---|---|---|
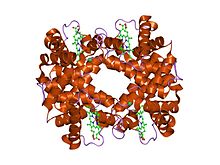 Структура на деоксихемоглобин Ротшилд 37 бета Trp----Arg: мутација која предизвикува појава на место за врзување на хлориден јон помеѓу подединиците.[1] | |||||||||
| Назнаки | |||||||||
| Симбол | Глобин | ||||||||
| Pfam | PF00042 | ||||||||
| Pfam-клан | CL0090 | ||||||||
| InterPro | IPR000971 | ||||||||
| PROSITE | PS01033 | ||||||||
| SCOP | 1hba | ||||||||
| SUPERFAMILY | 1hba | ||||||||
| CDD | cd01067 | ||||||||
| |||||||||
| Бактериски-сличен глобин | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Кристална структура на „скратен“ хемоглобин n (hbn) од Mycobacterium tuberculosis, со Xe атоми | |||||||||
| Назнаки | |||||||||
| Симбол | Bac_globin | ||||||||
| Pfam | PF01152 | ||||||||
| Pfam-клан | CL0090 | ||||||||
| InterPro | IPR001486 | ||||||||
| PROSITE | PDOC00933 | ||||||||
| SCOP | 1dlw | ||||||||
| SUPERFAMILY | 1dlw | ||||||||
| |||||||||
Структура
уредиЧленовите на глобинското натсемејство споделуваат ист тридимензионален склоп.[3] Овој т.н. „глобински склоп“ обично се состои од осум алфа-завојницаи, иако некои белковини имаат дополнителни завојни продолжетоци на нивните терминали.[4] Бидејќи глобинскиот склоп содржи само завојници, тој е класифициран во групата на исклучиво-алфа склопови.
Глобинскиот склоп се наоѓа во глобинските фамилии, како и во фикоцијанините. Тој бил првиот откриен белковински склоп (миоглобинот бил првата белковина чија структура била одредена).
Пакување на завојниците
уредиОсумте завојници на јадрото на глобинскиот склоп споделуваат значителна нелокална структура, за разлика од другите структурни мотиви во кои аминокиселините кои се блиску една до друга во низата се, исто така, блиску и во просторот. Завојниците се спакувани заедно под агол од околу 50 степени, што е значително „пострмно“ пакување од другите завојни пакувања, како она кај завојниот сноп. Точниот агол на пакувањето на завојниците зависи од аминокиселинската низа на белковината, бидејќи пакувањето е посредувано од стеричните ефекти и хидрофобните интеракции меѓу аминокиселинските странични ланци во близина на интерфејсите на завојниците.
Еволуција
уредиГлобините еволуирале од заеднички предок и можат да бидат поделени во три групи: едно-доменски глобини, и два типа на химерни глобини, флавохемоглобини и глобин-поврзани сензори. Бактериите ги имаат сите три типа на глобини, кај археите недостасуваат флавохемоглобините, а кај еукариотите недостасуваат глобин-поврзаните сензори.[5] Неколку функционално различни хемоглобини можат да коегзистираат во истиот вид на организам.
Кај ’рбетниците се јавуваат осум глобини: андроглобин, цитоглобин, глобин Е, глобин X, глобин Y, хемоглобин, миоглобин и невроглобин.
Сочуваност на низата
уредиИако склопот на глобинското натсемејство е еволутивно исклучително сочуван, низите кои го формираат склопот можат да имаат дури само 16% идентичност во низата. Додека специфичноста на низата на склопот не е строга, хидрофобното јадро на белковината мора да биде сочувано и да се избегнуваат хидрофобни делови на површината која е изложена на хидрофилниот растворувач, за да може структурата да остане стабилна и растворлива. Најпознатата мутација во глобинскиот склоп е промената од глутаминска киселина во валин во еден ланец од хемоглобинската молекула. Оваа мутација создава „хидрофобен дел“ на површината на белковината, кој поттикнува меѓумолекулска агрегација, а оваа појава се јавува кај болеста српеста анемија.
Потсемејства
уредиПримери
уредиЧовечки гени кои кодираат глобински белковини се:
- CYGB
- HBA1, HBA2, HBB, HBD, HBE1, HBG1, HBG2, HBM, HBQ1, HBZ, MB
Во глобини спаѓаат:
- Хемоглобин (Hb)
- Миоглобин (Mb)
- Невроглобин: белковина слична на миоглобинот, со експресија во мозокот и мрежницата на ’рбетниците, каде учествува во невропротекција од штета поради хипоксија или исхемија.[6] Тој спаѓа на гранка од глобинската фамилија која дивергирала рано во еволуцијата.
- Цитоглобин: кислороден сензор со експресија во повеќе ткива. Сроден е со невроглобинот.[7]
- Еритрокруорин: високо кооперативни вонклеточни респираторни белковини кои се среќаваат кај прстенестите црви и членконогите. Тие се агрегати на околку 180 подединици во шестаголен двослој.[8]
- Легхемоглобин (legHb или симбиотски Hb): присутен во кореновите нодули на легуминозните растенија, каде ја олеснува дифузијата на кислородот до симбиотските бактерии за да се промовира азотната фиксација.
- Несимбиотски хемоглобин (NsHb): се јавува кај нелегуминозни растенија и може да биде премногу експресиран во услови на стрес.
- Флавохемоглобини (FHb): химерни, со N-терминален глобински домен и C-терминален фередоксин редуктаза-сличен NAD/FAD-врзувачки домен. FHb обезбедува заштита од азотен моноксид преку C-терминалниот домен, кој трансферира електрони до глобинскиот хем.[9]
- Глобин E: глобин кој е одговорен за складирање и транспорт на кислород во мрежницата на птиците.[10]
- Глобин-поврзани сензори: химерни, со N-терминален домен сличен на миоглобинот и C-терминален домен, кој наликува на цитоплазматскиот сигнален домен на бактериските хеморецептори. Тие врзуваат кислородот и предизвикуваат аеротактичен одговор или учествуваат во регулација на генската експресија.[11][12]
- Протоглобин: еднодоменски глобин кој се среќава кај археите и е сроден со N-терминалниот домен на глобин-поврзаните сензори.[13]
- Скратен 2/2 глобин: кај него недостасува првиот алфа-завојница. Можат да бидат поделени на три главни групи (I, II и II) врз основа на структурни одлики.
- HbN (или GlbN): скратена белковина слична на хемоглобинот, која кооперативно врзува кислородот со многу висок афинитет и бавна дисоцијација, поради што не учествува во транспорт на кислород. Има функција на неутрализација на азот моноксид кај бактериите.[14]
- Цијаноглобин (или GlbN): скратена хемобелковина, кој се среќава кај цијанобактериите. Има висок афинитет за кислород и служи како дел од терминална оксидаза, а не како респираторен пигмент.[15]
- HbO (или GlbO): скратена белковина слична на хемоглобинот, со понизок афинитет за кислород од HbN. HbO се врзува за бактериската клеточна мембрана, каде значително го зголемува внесот на кислород. Се чини дека HbO стапува во интеракција со терминална оксидаза и може да учествува во процес на трансфер на кислород/електрони кој го олеснува трансферот на кислородот за време на аеробниот метаболизам.[16]
- Glb3: јадрено-кодиран скратен хемоглобин кај растенијата, кој е повеќе сроден со HbO отколку со HbN. Glb3 од Arabidopsis thaliana покажува невообичаено концентрациски-независно врзување на кислород и јаглерод диоксид.[17]
Поврзано
уредиНаводи
уреди- ↑ Kavanaugh JS, Rogers PH, Case DA, Arnone A (April 1992). „High-resolution X-ray study of deoxyhemoglobin Rothschild 37 beta Trp----Arg: a mutation that creates an intersubunit chloride-binding site“. Biochemistry. 31 (16): 4111–21. doi:10.1021/bi00131a030. PMID 1567857.
- ↑ „A model of globin evolution“. Gene. 398 (1–2): 132–42. August 2007. doi:10.1016/j.gene.2007.02.041. PMID 17540514.
- ↑ Branden, Carl; Tooze, John (1999). Introduction to protein structure (2. изд.). New York: Garland Pub. ISBN 978-0815323051.
- ↑ Bolognesi, M; Onesti, S; Gatti, G; Coda, A; Ascenzi, P; Brunori, M (1989). „Aplysia limacina myoglobin. Crystallographic analysis at 1.6 a resolution“. Journal of Molecular Biology. 205 (3): 529–44. doi:10.1016/0022-2836(89)90224-6. PMID 2926816.
- ↑ „A phylogenomic profile of globins“. BMC Evol. Biol. 6: 31. 2006. doi:10.1186/1471-2148-6-31. PMC 1457004. PMID 16600051.
- ↑ „Human brain neuroglobin structure reveals a distinct mode of controlling oxygen affinity“. Structure. 11 (9): 1087–95. September 2003. doi:10.1016/S0969-2126(03)00166-7. PMID 12962627.
- ↑ „Functional properties of neuroglobin and cytoglobin. Insights into the ancestral physiological roles of globins“. IUBMB Life. 56 (11–12): 689–96. 2004. doi:10.1080/15216540500037299. PMID 15804833.
- ↑ „Low resolution crystal structure of Arenicola erythrocruorin: influence of coiled coils on the architecture of a megadalton respiratory protein“. J. Mol. Biol. 365 (1): 226–36. January 2007. doi:10.1016/j.jmb.2006.10.016. PMC 1847385. PMID 17084861.
- ↑ „Flavohemoglobin, a globin with a peroxidase-like catalytic site“. J. Biol. Chem. 276 (10): 7272–7. March 2001. doi:10.1074/jbc.M009280200. PMID 11092893.
- ↑ „Oxygen supply from the bird's eye perspective: Globin E is a respiratory protein in the chicken retina“. J. Biol. Chem. 286 (30): 26507–15. 2011. doi:10.1074/jbc.M111.224634. PMC 3143615. PMID 21622558.
- ↑ „Globin-coupled sensors: a class of heme-containing sensors in Archaea and Bacteria“. Proc. Natl. Acad. Sci. U.S.A. 98 (16): 9353–8. July 2001. doi:10.1073/pnas.161185598. PMC 55424. PMID 11481493.
- ↑ „Globin-coupled sensors, protoglobins, and the last universal common ancestor“. J. Inorg. Biochem. 99 (1): 23–33. January 2005. doi:10.1016/j.jinorgbio.2004.10.024. PMID 15598488.
- ↑ „Ancestral hemoglobins in Archaea“. Proc. Natl. Acad. Sci. U.S.A. 101 (17): 6675–80. April 2004. doi:10.1073/pnas.0308657101. PMC 404104. PMID 15096613.
- ↑ „Oxygen binding and NO scavenging properties of truncated hemoglobin, HbN, of Mycobacterium smegmatis“. FEBS Lett. 580 (17): 4031–41. July 2006. doi:10.1016/j.febslet.2006.06.037. PMID 16814781.
- ↑ „Solution 1H NMR study of the heme cavity and folding topology of the abbreviated chain 118-residue globin from the cyanobacterium Nostoc commune“. Biochemistry. 39 (6): 1389–99. February 2000. doi:10.1021/bi992081l. PMID 10684619.
- ↑ „Mycobacterium tuberculosis hemoglobin HbO associates with membranes and stimulates cellular respiration of recombinant Escherichia coli“. J. Biol. Chem. 277 (18): 15293–302. May 2002. doi:10.1074/jbc.M111478200. PMID 11796724.
- ↑ „A hemoglobin from plants homologous to truncated hemoglobins of microorganisms“. Proc. Natl. Acad. Sci. U.S.A. 98 (18): 10119–24. August 2001. doi:10.1073/pnas.191349198. PMC 56925. PMID 11526234.