Миниген
Миниген ― минимален генски фрагмент кој вклучува егзон и контролни региони неопходни за генот да биде изразен на ист начин како генски фрагмент од див тип. Ова е миниген во неговата најосновна смисла. Може да бидат конструирани посложени минигени кои содржат повеќе егзони и интрони. Минигените обезбедуваат вредна алатка за истражувачите кои ги проценуваат моделите на спојување правени „ин виво“ (во организмот) и „ин витро“ (вон организмот) биохемиски оценети опити.[1][2] Поточно, минигените се користени како известувачки вектори за спојување (исто така наречени вектори за заробување на егзон) и дејствуваат како сонда за да биде одредено кои фактори се важни во исходите на спојувањето. Тие можат да бидат конструирани за да го тестираат начинот на кој и цис-регулаторните елементи (ефекти на РНК) и транс-регулаторните елементи (поврзани белковини/фактори за спојување) влијаат на генското изразување.[3]
Историја
уредиМинигените најпрво биле опишани како соматско склопување на сегменти на ДНК и се состоеле од региони на ДНК за кои е познато дека ја кодираат белковината и страничните региони потребни за изразување на белковината. Поимот првпат бил употребен во труд во 1977 година за да биде опишано клонирањето на два минигени кои биле дизајнирани да изразат пептид.[4]
Спојувањето на РНК било откриено во доцните 1970-ти преку проучување на аденовируси кои ги напаѓаат цицачите и се реплицираат во нив. Истражувачите идентификувале молекули на РНК кои содржеле секвенци од неповрзани делови од геномот на вирусот. Ова откритие довело до заклучок дека постоеле регулаторни механизми кои влијаеле на зрелата РНК и гените што таа ги изразува.[5] Користењето минигени како вектор за известување за спојување за истражување на ефектите од регулацијата на спојување на РНК природно следело и останува главната употреба на минигените до денес.
Видови
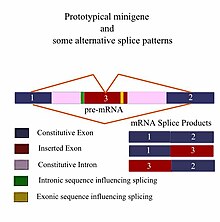
уредиСо цел да биде обезбеден добар минигенски модел, генскиот фрагмент треба да ги има сите потребни елементи за да биде осигурано дека ги покажува истите обрасци на алтернативно спојување како генот од див тип, т.е. должината на фрагментот мора да ги вклучува сите спротиводно и низводно секвенци кои можат да влијаат на неговото спојување.[1][2] Затоа, повеќето дизајни на минигени започнуваат со темелна дигитална анализа на барањата на опитот пред да биде изврши каква било „влажна“ лабораториска работа.[6] Со доаѓањето на биоинформатиката и широко распространетата употреба на сметачите, сега постојат неколку добри програми за идентификација на контролните региони кои делуваат како цис кои влијаат на резултатите од спојувањето на генот[7][8] и напредните програми дури можат да ги разгледаат резултатите од спојувањето во различни врсти ткива.[9] Разликите во минигените обично се одразуваат во конечната големина на фрагментот, што пак е одраз на сложеноста на самиот миниген. Бројот на туѓи ДНК елементи (егзони и интрони) вметнати во конститутивните егзони и интрони на даден фрагмент варира во зависност од видот на опитот и информациите што се барани. Вообичаен опит може да вклучува минигени од див тип за кои е очекувано нормално да изразуваат гени во споредба со генетски конструирани алелни варијации кои го заменуваат генот од див тип и се клонирани во истите странични секвенци како и првобитниот фрагмент. Овие видови опити помагаат да биде одреден ефектот на различни мутации врз спојувањето на пред информациската РНК.[3]
Градба
уредиОткако ќе биде избран соодветен геномски фрагмент (чекор 1), егзоните и интроните на фрагментот може да бидат вметнати и да бидат засилени, заедно со страничните конститутивни егзони и интрони на првичниот ген, со полимеразна верижна реакција. Прајмерите за полимеразната верижна реакција можат да бидат избрани така што оставаат „лепливи краеви“ со 3' смислени и противсмислени нишки (чекор 2). Овие „лепливи краеви“ може лесно да бидат вградени во топоисомеразен вектор со врзување во комерцијално достапен извор кој има лигаза веќе прикачена на него кога ќе биде вградена[10] (чекор 3). Последователните топоисомеразни вектори може да бидат трансфектирани во клетките на Escherichia coli (чекор 4). По инкубацијата, вкупната РНК може да биде екстрахирана од бактериските колонии и да биде анализирана со користење на обратна транскрипција-полимеразна верижна реакција за да биде измерен соодносот на вклучување/исклучување на егзонот (чекор 5). Минигенот може да биде трансфициран во различни видови клетки со различни фактори на спојување за да бидат тестирани прекудејствувачките елементи (чекор 6). Изразените гени или белковините што тие ги кодираат може да бидат анализирани за да бидат проценети компонентите на спојување и нивните ефекти преку различни методи, вклучувајќи хибридизација или хроматографија со исклучување на големината.[1][2]
Употреби
уредиСе проценува дека грешките во спојувањето на РНК се јавуваат кај третина од генетските болести. За да биде разбрана патогенезата и да бидат идентификувани потенцијалните цели на терапевтска интервенција кај овие болести, од суштинско значење е објаснувањето на вклучените елементи на спојување.[11] Утврдувањето на целосниот сет на компоненти вклучени во спојувањето претставува многу предизвици поради изобилството на алтернативно спојување, кое се јавува во повеќето човечки гени, и специфичноста во која спојувањето е вршено внатре во организмот.[2] Спојувањето е јасно спроведено од вид клетка до вид клетка и низ различни фази на клеточниот развој. Затоа, од клучно значење е сите внатреорганизамски или биоинформатички претпоставки за регулација на спојување да бидат потврдат внатре во организмот.[12] Минигените се користени за разјаснување на цис-регулаторни елементи, транс-регулаторни елементи и други регулатори на презрела спојување на РНК внатре во организмот.[2] Минигените се применети за проучување на разновидна низа генетски болести поради гореспоменатото изобилство на алтернативно споени гени и специфичноста и варијацијата забележани во регулацијата на спојувањето.[1][2][12] Следниве се примери за употреба на миниген кај различни болести. Иако не е исцрпен список, тој обезбедува подобро разбирање за тоа како се користени минигените.
Ендокрини заболувања
уредиГрешките во спојувањето на РНК може да имаат драстични ефекти врз тоа како функционираат белковините, вклучувајќи ги и хормоните што се лачат од ендокриниот систем. Овие ефекти врз хормоните се идентификувани како причина за многу ендокрини нарушувања, вклучувајќи патолошки состојби поврзани со штитната жлезда, рахитис, хиперинсулинемична хипогликемија и вродена адренална хиперплазија.[13] Еден специфичен пример за грешка при спојување што предизвикува ендокрино заболување што е проучувано со употреба на минигени е еден вид недостаток на хормонот за раст наречен изолиран недостаток на хормон за раст, болест што резултира со неуспех на растот. Изолираниот недостаток на хормон за раст од тип II е автосомно доминантен облик предизвикана од мутација во интервентната секвенца во непосредна близина на егзонот 3 од генот што го кодира хормонот за раст 1, генот GH-1. Овој мутиран облик на IVS3 предизвикува прескокнување на егзонот 3 во производот на информациска РНК. Информациската РНК (-E3) шифрира скратен облик на хормонот за човечки раст која потоа ја инхибира нормалната секреција на хормонот за човечки раст. Биле користени минигени за да биде утврдено дека точкестата мутација во засилувачот на спојување на интроните вграден во засилувачот на спојување на интроните 3 е виновен за прескокнувањето на E3. Покрај тоа, било утврдено дека функцијата на засилувачот на спојување на интроните е под влијание на блискиот транспонирачки елемент на наизменична струја, откривајќи дека оваа конкретна грешка при спојување е предизвикана од прекудејствувачки фактор.[14]
Невродегенеративни заболувања
уредиСобирањето на тау белковината е поврзано со невродегенеративни болести, вклучувајќи Алцхајмерова и Паркинсонова болест, како и други видови тауопатија.[15] Тау белковинските изоформи се создавани со алтернативно спојување на егзоните 2, 3 и 10. Регулирањето на тау спојувањето е специфично за фазата на развој, физиологијата и местото. Грешките во спојувањето на тау може да бидат појавени и во егзоните и во интроните и, во зависност од грешката, да резултираат со промени во структурата на белковините или губење на функцијата.[16] Агрегацијата на овие абнормални тау белковини директно е заемно со патогенезата и напредокот на болеста. Минигените се користени од неколку истражувачи за да помогнат во разбирањето на регулаторните компоненти одговорни за спојување на информациска РНК на генот TAU.[15][16][17]
Рак
уредиРакот е сложена, хетерогена болест која може да биде наследна или резултат на стимули од животната средина.[18] Минигените се користени за да им помогнат на онколозите да ги разберат улогите што ги игра прединформациската РНК спојувањето кај различни видови рак. Од особен интерес се генетските мутации специфични за ракот кои ги нарушуваат нормалните настани на спојување, вклучително и оние кои влијаат на компонентите на спојување и белковините кои се врзуваат со РНК како што се хетерогени нуклеарни рибонуклеочестички, белковини богати со серин/аргинин и мали рибонуклеобелковини.[19][20] Белковините кодирани од неправилно споени прединформациската РНК се функционално различни и придонесуваат за карактеристичните аномалии прикажани од ракородните клетки, вклучувајќи ја нивната способност да се размножуваат, да навлегуваат и да подлежат на ангиогенеза и метастази.[20] Минигените им помагаат на истражувачите да ги идентификуваат генетските мутации кај ракот што резултираат со грешки при спојување и да ги утврдат ефектите што тие грешки во спојувањето ги имаат врз генското изразување.[21] Користејќи го знаењето добиено од студиите кои користат минигени, онколозите предложиле тестови дизајнирани да забележуваат производи со абнормална генско изразување за дијагностички цели.[22] Дополнително, истражуван е изгледот за користење на минигени како имунотерапија за рак.[23][24]
Поврзано
уредиНаводи
уреди- ↑ 1,0 1,1 1,2 1,3 Stoss, O; Stoilov, P; Hartmann, AM; Nayler, O; Stamm, S (декември 1999). „The in vivo minigene approach to analyze tissue-specific splicing“. Brain Research. Brain Research Protocols. 4 (3): 383–94. doi:10.1016/s1385-299x(99)00043-4. PMID 10592349.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 Cooper, Thomas A. (декември 2005). „Use of minigene systems to dissect alternative splicing elements“. Methods. 37 (4): 331–340. doi:10.1016/j.ymeth.2005.07.015. PMID 16314262.
- ↑ 3,0 3,1 Desviat, LR; Pérez, B; Ugarte, M (2012). „Minigenes to Confirm Exon Skipping Mutations“. Exon Skipping. Methods Mol. Biol. 867. стр. 37–47. doi:10.1007/978-1-61779-767-5_3. ISBN 978-1-61779-766-8. PMID 22454053.
- ↑ Poonian, MS; McComas, WW; Nussbaum, AL (1977). „Chemical synthesis of two deoxyribododecanucleotides for the attachment of restriction termini to an artificial minigene“. Gene. 1 (5–6): 357–72. doi:10.1016/0378-1119(77)90040-3. PMID 590743.
- ↑ Clancy, S (2008). „RNA splicing: introns, exons and spliceosome“. Nature Education. 1 (31).
- ↑ Burge, Christopher. „Burge Lab Software“. Архивирано од изворникот на 2019-03-30. Посетено на 16 мај 2024.
- ↑ Divina, Petr; Kvitkovicova, Andrea; Buratti, Emanuele; Vorechovsky, Igor (14 јануари 2009). „Ab initio prediction of mutation-induced cryptic splice-site activation and exon skipping“. European Journal of Human Genetics. 17 (6): 759–765. doi:10.1038/ejhg.2008.257. PMC 2947103. PMID 19142208.
- ↑ Grodecká, Lucie; Lockerová, Pavla; Ravčuková, Barbora; Buratti, Emanuele; Baralle, Francisco E.; Dušek, Ladislav; Freiberger, Tomáš; Spilianakis, Charalampos Babis (21 февруари 2014). „Exon First Nucleotide Mutations in Splicing: Evaluation of In Silico Prediction Tools“. PLOS ONE. 9 (2): e89570. Bibcode:2014PLoSO...989570G. doi:10.1371/journal.pone.0089570. PMC 3931810. PMID 24586880.
- ↑ Barash, Yoseph; Vaquero-Garcia, Jorge; González-Vallinas, Juan; Xiong, Hui; Gao, Weijun; Lee, Leo J.; Frey, Brendan J. (2013). „AVISPA: a web tool for the prediction and analysis of alternative splicing“. Genome Biology. 14 (10): R114. doi:10.1186/gb-2013-14-10-r114. PMC 4014802. PMID 24156756.
- ↑ „Steps in producing a TOPO Vector“. Life sciences. Посетено на 16 февруари 2024.
- ↑ Lim, Kian; Huat; Ferraris, Luciana; Filloux, Madeleine E.; Raphael, Benjamin J.; Fairbrother, William G. (2011). „Using positional distribution to identify splicing elements and predict pre-mRNA processing defects in human genes“. Proceedings of the National Academy of Sciences. 108 (27): 11093–6. Bibcode:2011PNAS..10811093H. doi:10.1073/pnas.1101135108. PMC 3131313. PMID 21685335.
- ↑ 12,0 12,1 Stamm, Stefan. „Stamms-lab.net“. Архивирано од изворникот на 9 декември 2013. Посетено на 16 февруари 2024.
- ↑ Rosaria de Miranda, Elizabete (2009). „Splicing variants impact in thyroid normal physiology and pathological conditions“. Arq Bras Endocrinol Metabol. 53 (6): 709–714. doi:10.1590/S0004-27302009000600003. PMID 19893912.
- ↑ Mullis, PE (2010). „Genetics of isolated growth hormone deficiency“. J Clin Res Pediatr Endocrinol. 2 (2): 52–62. doi:10.4274/jcrpe.v2i2.52. PMC 3014602. PMID 21274339.
- ↑ 15,0 15,1 Kar, Amar; Fushimi, Kazuo; Zhou, Xiaohong; Ray, Payal; Shi, Chen; Chen, Xiaoping; Liu, Zhiren; Chen, She; Wu, Jane Y. (2011). „RNA Helicase p68 (DDX5) Regulates tau Exon 10 Splicing by Modulating a Stem-Loop Structure at the 5′ Splice Site“. Mol. Cell. Biol. 31 (9): 1812–1821. doi:10.1128/MCB.01149-10. PMC 3133221. PMID 21343338.
- ↑ 16,0 16,1 Rodriguez-Martin, Teresa; Karen Anthony; Mariano A. Garcia-Blanco; S. Gary Mansfield; Brian H. Anderton; Jean-Marc Gallo (2009). „Correction of tau mis-splicing caused by FTDP-17 MAPT mutations by spliceosome-mediated RNA trans-splicing“. Hum Mol Genet. 18 (17): 3266–3273. doi:10.1093/hmg/ddp264. PMC 2722988. PMID 19498037.
- ↑ Anfossi, M; Vuono, R; Maletta, R; Virdee, K; Mirabelli, M; Colao, R; Puccio, G; Bernardi, L; Frangipane, F (2011). „Compound heterozygosity of 2 novel MAPT mutations in frontotemporal dementia“. Neurobiol Aging. 32 (4): 757.e1–757.e11. doi:10.1016/j.neurobiolaging.2010.12.013. PMID 21295377.
- ↑ Rajan, P.; Elliott, DJ; Robson, CN; Leung, HY (Aug 2009). „Alternative splicing and biological heterogeneity in prostate cancer“. Nat Rev Urol. 6 (8): 454–460. doi:10.1038/nrurol.2009.125. PMID 19657379.
- ↑ Adler, AS; McCleland, ML; Yee, S; Yaylaoglu, M; Hussain, S; Cosino, E; Quinones, G; Modrusan, Z; Seshagiri, S (мај 2014). „An integrative analysis of colon cancer identifies an essential function for PRPF6 in tumor growth“. Genes Dev. 28 (10): 1068–84. doi:10.1101/gad.237206.113. PMC 4035536. PMID 24788092.
- ↑ 20,0 20,1 Guo, Rong; Yong Li; Jinying Ning; Dan Sun; Lianjun Lin; Xinmin Liu (2013). „HnRNP A1/A2 and SF2/ASF Regulate Alternative Splicing of Interferon Regulatory Factor-3 and Affect Immunomodulatory Functions in Human Non-Small Cell Lung Cancer Cells“. PLOS ONE. 8 (4): e62729. Bibcode:2013PLoSO...862729G. doi:10.1371/journal.pone.0062729. PMC 3639176. PMID 23658645.
- ↑ Acedo, Alberto; David J Sanz; Mercedes Durán; Mar Infante; Lucía Pérez-Cabornero; Cristina Miner; Eladio A Velasco (2012). „Comprehensive splicing functional analysis of DNA variants of the BRCA2 gene by hybrid minigenes“. Breast Cancer Research. 14 (3): R87. doi:10.1186/bcr3202. PMC 3446350. PMID 22632462.
- ↑ Di Giacomo, D.; Gaildrat, P; Abuli, A; Abdat, J; Frébourg, T; Tosi, M; Martins, A (2013). „Functional analysis of a large set of BRCA2 exon 7 variants highlights the predictive value of hexamer scores in detecting alterations of exonic splicing regulatory elements“. Hum. Mutat. 34 (11): 1547–57. doi:10.1002/humu.22428. PMID 23983145.
- ↑ Daniotti, Jose L.; Aldo A. Vilcaes; Vanina Torres Demichelis; Fernando M. Ruggiero; Macarena Rodriguez-Walker (2013). „Glycosylation of Glycolipids in Cancer: Basis for Development of Novel Therapeutic Approaches“. Front Oncol. 3: 306. doi:10.3389/fonc.2013.00306. PMC 3867695. PMID 24392350.
- ↑ Aurisicchio, L; Fridman, A; Bagchi, A; Scarselli, E; La Monica, N; Ciliberto, G (јануари 2014). „A novel minigene scaffold for therapeutic cancer vaccines“. Oncoimmunology. 3 (1): e27529. doi:10.4161/onci.27529. PMC 4002591. PMID 24790791.
Дополнителна книжевност
уреди- „Alternative pre-mRNA Splicing: Theory and Protocols“, од Стефан Стам, Крис Смит и Рајнхард Лирман. ISBN 978-3527326068
- „Molecular Diagnostics“, второ издание, од уред. Џорџ П. Патринос и Вилхелм Ансорж. ISBN 0123745373
- „DNA Vaccines“ уредено од Хилдегун Ертл. ISBN 1461349257
- „Alternative Splicing and Disease (Progress in Molecular and Subcellular Biology)“ од Филип Жантер. ISBN 3540344489
Надворешни врски
уреди- Мрежна страница на Стефан Стам на Универзитетот во Кентаки. Преглед на истражувањето на минигенот.
- Лабораторијата на Кристофер Бурџ на мрежната страница на МИТ Архивирано на 30 март 2019 г.. Теоретска анализа на спојување.
- Геномски прелистувач на Универзитетот во Јужна Калифорнија. Голема база на податоци за добивање информации за гените.