Арсен трихлорид
Арсен трихлорид — неорганско соединение со формулата AsCl3, познат и како арсен хлорид или путер од арсен. Ова отровно масло е безбојно, иако нечистите примероци може да изгледаат жолти. Тој е посредник во производството на органоарсенски соединенија.[4]
| |
Други називи Арсен(III) хлорид, Арсен трихлорид, Путер од арсен, Ден Валакинов раствор | |
| Назнаки | |
|---|---|
| 7784-34-1 | |
| ChemSpider | 22974 |
| EC-број | 232-059-5 |
| |
| 3Д-модел (Jmol) | Слика |
| PubChem | 24570 |
| RTECS-бр. | CG1750000 |
| |
| UNII | 5XW39M1300 |
| ОН-бр. | 1560 |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | безбојна мрсна течност |
| Густина | 2.163 g/cm3, течност |
| Точка на топење | |
| Точка на вриење | |
| Хидролизира | |
| Растворливост | растворливо во алкохол, диетил етер, HCl, HBr, хлороформ, CCl4[1] |
| -79.9·10−6 cm3/mol | |
| Показател на прекршување (nD) | 1.6006 |
| Вискозност | 9.77 x 10−6 Pa s |
| Опасност | |
| Безбедност при работа: | |
Главни опасности
|
Многу токсичен, канцероген, корозивен, се распаѓа при контакт со вода и се ослободува HCl |
| GHS-ознаки: | |
Пиктограми
|
   
|
Сигнални зборови
|
Опасност |
Изјави за опасност
|
H301, H310, H314, H331, H350, H410 |
Изјави за претпазливост
|
P201, P202, P260, P261, P262, P264, P270, P271, P273, P280, P281, P301+P310, P301+P330+P331, P302+P350, P303+P361+P353, P304+P340, P305+P351+P338, P308+P313, P310, P311, P321, P322, P330, P361, P363, P391, P403+P233, P405, P501 |
| NFPA 704 | |
| Смртоносна доза или концентрација: | |
LD50 (средна доза)
|
48 mg/kg |
LCLo (најниска објавена)
|
100 mg/m3 (мачка, 1 час) 200 mg/m3 мачка, 20 мин) 338 ppm (стаорец, 10 мин)[3] |
| NIOSH (здравствени граници во САД): | |
PEL (дозволива)
|
[1910.1018] TWA 0.010 mg/m3[2] |
REL (препорачана)
|
Ca C 0.002 mg/m3 [15-минути][2] |
IDLH (непосредна опасност)
|
Ca [5 mg/m3 (as As)][2] |
| Слични супстанци | |
| Други анјони | Арсен триоксид, Арсен трифлуорид |
| Други катјони | Антимон трихлорид |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Структура
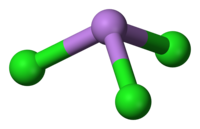
уредиAsCl3 е пирамидална молекула со C3v симетрија. As-Cl врската е 2,161 Å, а аголот Cl-As-Cl е 98° 25'±30.[5][6] AsCl3 има четири нормални начини на вибрации: ν1(A1) 416, ν2(A1) 192, ν3 393, и ν4(E) 152 cm−1.[7]
Синтеза
уредиОваа безбојна течност се подготвува со третман на арсен(III) оксид со хлороводород проследено со дестилација:
- As2O3 + 6 HCl → 2 AsCl3 + 3 H2O
Може да се подготви и со хлорирање на арсен на 80–85 °C, но овој метод бара елементарен арсен.[4]
- 2 As + 3 Cl2 → 2 AsCl3
Арсен трихлорид може да се подготви и со реакција на арсен оксид и сулфур монохлорид. Овој метод бара едноставна апаратура и продолжува ефикасно:[8]
- 2 As2O3 + 6 S2Cl2 → 4 AsCl3 + 3 SO2 + 9 S
Конвенционален лабораториски метод е рефлуксирање на арсен(III) оксид со тионил хлорид:[9]
- 2 As2O3 + 3 SOCl2 → 2 AsCl3 + 3 SO2
Реакции
уредиСо хидролиза се добива арсенова киселина и хлороводородна киселина:
- AsCl3 + 3 H2O → As(OH)3 + 3 HCl
Иако AsCl3 iе помалку чувствителен на влага отколку PCl3, сè уште испарува на влажен воздух.[10]
AsCl3 подложи на редистрибуција при третман со As2O3 за да се добие неорганскиот полимер AsOCl. Со извори на хлориди, AsCl3, формира соли кои го содржат анјонот [AsCl4]−. Реакцијата со калиум бромид и калиум јодид дава арсен трибромид и арсен тријодид, соодветно.
AsCl3 е корисен во органоарсенската хемија, на пример трифениларзин е дериват од AsCl3:[11]
- AsCl3 + 6 Na + C6H5Cl → As(C6H5)3 + 6 NaCl
Отровните гасови наречени Lewisites се подготвуваат со додавање на арсен трихлорид во ацетилен:
- AsCl
3 + C
2H
2 → ClCH=CHAsCl
2
Безбедност
уредиНеорганските соединенија на арсен се многу токсични,[12] и AsCl3 особено поради неговата испарливост и растворливост (во вода).
Класифициран е како исклучително опасна супстанција во Соединетите Држави како што е дефинирано во Дел 302 од Законот за планирање вонредни состојби и Заедницата за правото на знаење (42 U.S.C. 11002) и е предмет на строги барања за известување од страна на капацитетите што произведуваат, складираат, или да го користите во значителни количини.[13]
Наводи
уреди- ↑ John Rumble (June 18, 2018). CRC Handbook of Chemistry and Physics (англиски) (99th. изд.). CRC Press. стр. 4–41. ISBN 978-1138561632.
- ↑ 2,0 2,1 2,2 „Џебен водич за опасните хемиски материи #0038“. Национален институт за безбедност и здравје при работа (NIOSH). (англиски)
- ↑ „Arsenic (inorganic compounds, as As)“. Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ 4,0 4,1 Sabina C. Grund, Kunibert Hanusch, Hans Uwe Wolf "Arsenic and Arsenic Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, VCH-Wiley, 2008, Weinheim.doi:10.1002/14356007.a03_113.pub2
- ↑ P. Kisliuk; C. H. Townes. "The Microwave Spectra and Molecular Structure of Phosphorus and Arsenic Trichloride". J. Chem. Phys. 1950, 18.
- ↑ Jean Galy; Renee Enjalbertl Pierre Lecante; Andrzej Burian "AsCl3: From the crystalline to the liquid state. XRD (176< T (K) < 250) and WAXS (295K) studies" Inorg. Chem 2002, volume 41, pp. 693–698.doi:10.1021/ic0102788
- ↑ Klapoetke, Thomas M. "The vibrational spectrum of arsenic trichloride" Main Group Metal Chemistry 1997, volume 20, pp. 81–83.
- ↑ R. C. Smith, "Manufacture of Arsenic trichloride" The Journal of Industrial and Engineering Chemistry 1919, volume 11, pp. 109–110. doi:10.1021/ie50110a009
- ↑ S. K. Pandey, A. Steiner, H. W. Roesky, S. Kamepalli, A. H. Cowley, "Arsenic(III)chloride" Inorganic Synthesis 1997, volume 31, pp. 148-150. doi:10.1002/9780470132623.ch24
- ↑ Holleman, A. F.; Wiberg, E. Inorganic Chemistry Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ Shriner, R. L.; Wolf, C. N. (1963). „Tetraphenylarsonium Chloride Hydrochloride“. Organic Syntheses.; Collective Volume, 4, стр. 910. Describes the preparation of As(C6H5)3.
- ↑ Toxicity of inorganic compounds of arsenic
- ↑ „40 C.F.R.: Appendix A to Part 355—The List of Extremely Hazardous Substances and Their Threshold Planning Quantities“ (PDF) (July 1, 2008. изд.). Government Printing Office. Архивирано од изворникот (PDF) на February 25, 2012. Посетено на October 29, 2011. Наводот journal бара
|journal=(help)
