Тиоцијанска киселина
Тиоцијанската киселина е хемиско соединение со формула HSCN и структураH–S–C≡N, која постои како тавтомер со изотиоцијанска киселина (HNCS).[4] Изоформата има тенденција да доминира при што материјалот е околу 95% изотиоцијанска киселина во фазата на пареа.[5]
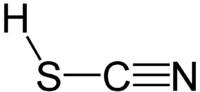
| |

| |
Други називи
| |
| Назнаки | |
|---|---|
| 463-56-9 | |
| 3DMet | B00344 |
| ChEBI | CHEBI:29200 |
| ChEMBL | ChEMBL84336 |
| ChemSpider | 760 |
| EC-број | 207-337-4 |
| 25178 | |
| 3Д-модел (Jmol) | Слика |
| KEGG | C01755 |
| MeSH | thiocyanic+acid |
| PubChem | 781 |
| |
| UNII | A5KWW7N91V |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | безбојна, мрсна течност |
| Мирис | остар |
| Густина | 2.04 g/cm3 |
| Точка на топење | |
| Мешање | |
| Растворливост | растворлив во етанол, диетил етер |
| log P | 0.429 |
| Киселост (pKa) | 0.926 |
| Константа на базицитет (pKb) | 13.071 |
| Опасност | |
| GHS-ознаки: | |
Пиктограми
|

|
Сигнални зборови
|
Предупредување |
Изјави за опасност
|
H302, H312, H332, H412 |
Изјави за претпазливост
|
P261, P264, P270, P271, P273, P280, P301+P312, P302+P352, P304+P312, P304+P340, P312, P322, P330, P363, P501 |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Тоа е умерено силна киселина,[6] со ap K a од 1,1 на 20 °C и екстраполирана на нула јонска јачина.[7]
Се предвидува дека HSCN има тројна врска помеѓу јаглеродот и азот. Набљудувана е спектроскопски, но не е изолирано како чиста супстанција.[8]
Солите и естерите на тиоцијанската киселина се познати како тиоцијанати . Солите се составени од тиоцијанат јон ( - SCN) и соодветен метален катјон (на пример, калиум тиоцијанат, KSCN). Естрите на тиоцијанската киселина имаат општа структура R–SCN.
Изотиоцијанската киселина, HNCS, е Луисова киселина чија слободна енергија, енталпија и ентропија се менуваат поради нејзината поврзаност 1:1 со разновидни луисови бази во раствор на јаглерод тетрахлорид на 25 Пријавени се °C.[9] Својствата на акцепторот на HNCS се дискутирани во моделот ECW .
Поврзано
уреди- ↑ Merck Index, 11th Edition, 9257.
- ↑ International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. стр. 784. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ↑ Richter, Victor von; Spielmann, Percy E., trans. (1922). Organic Chemistry or Chemistry of the Carbon Compounds. 1. Philadelphia, Pennsylvania, U.S.A.: P. Blakiston's Son & Co. стр. 466.
- ↑ Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 0-12-352651-5.
- ↑ Beard, C. I.; Dailey, B. P. (1950). „The Structure and Dipole Moment of Isothiocyanic Acid“ (PDF). The Journal of Chemical Physics. 18 (11): 1437. Bibcode:1950JChPh..18.1437B. doi:10.1063/1.1747507.
|hdl-access=бара|hdl=(help) - ↑ Munegumi, Toratane (23 January 2013). „Where is the Border Line between Strong Acids and Weak Acids?“. World Journal of Chemical Education. 1 (1): 12–16.
- ↑ Martell, A. E.; Smith, R. M.; Motelaitis, R. J. (2001). NIST Database 46. Gaithersburg, MD: National Institute of Standards and Technology.
- ↑ Wierzejewska, M.; Mielke, Z. (2001). „Photolysis of Isothiocyanic Acid HNCS in Low-Temperature Matrices. Infrared Detection of HSCN and HSNC Isomers“. Chemical Physics Letters. 349 (3–4): 227–234. Bibcode:2001CPL...349..227W. doi:10.1016/S0009-2614(01)01180-0.
- ↑ .
