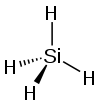
Силан
Силанот — неорганско соединение со хемиска формула, SiH
4 . Тоа е безбоен, пирофорен, токсичен гас со остар, одбивен мирис, нешто сличен на оној на оцетната киселина. Силанот е од практичен интерес како претходник на елементарниот силициум. Силаните со алкилни групи се ефективни водоотпорни за минерални површини како бетон и ѕидање. Силаните со органски и неоргански додатоци се користат како средства за спојување.
| |||
Назив според МСЧПХ Силан | |||
Други називи
| |||
| Назнаки | |||
|---|---|---|---|
| 7803-62-5 | |||
| ChEBI | CHEBI:29389 | ||
| ChemSpider | 22393 | ||
| 273 | |||
| |||
| 3Д-модел (Jmol) | Слика | ||
| PubChem | 23953 | ||
| RTECS-бр. | VV1400000 | ||
| |||
| UNII | 5J076063R1 | ||
| ОН-бр. | 2203 | ||
| Својства | |||
| Хемиска формула | |||
| Моларна маса | 0 g mol−1 | ||
| Изглед | Безбоен гас | ||
| Мирис | Одбивен[1] | ||
| Густина | 1.313 g/L[2] | ||
| Точка на топење | |||
| Точка на вриење | |||
| Реагира бавно[2] | |||
| Парен притисок | >1 atm (20 °C)[1] | ||
| Конјуг. киселина | Силаниум (понекогаш се пишува силиониум) | ||
| Структура | |||
| Геометрија на молекулата | Тетраедар r(Si-H) = 1.4798 Å[3] | ||
| Диполен момент | 0 D | ||
| Термохемија | |||
| Ст. енталпија на образување ΔfH |
34.31 kJ/mol | ||
| Стандардна моларна ентропија S |
204.61 J/mol•K | ||
| Специфичен топлински капацитет, C | 42.81 J/mol•K | ||
| Опасност | |||
| Безбедност при работа: | |||
Главни опасности
|
Исклучително запалив, пирофорен во воздухот | ||
| GHS-ознаки: | |||
Пиктограми
|
 Предлошка:GHS04 Предлошка:GHS04
| ||
Сигнални зборови
|
Опаесен | ||
Изјави за опасност
|
H220, H280 | ||
Изјави за претпазливост
|
P210, P222, P230, P280, P377, P381, P403, P410+P403 | ||
| NFPA 704 | |||
| Температура на запалување | Не е применлив, пирофорен гас | ||
| ~ 18 °C (64 °F; 291 K) | |||
| Граници на запалливост | 1.37–100% | ||
| NIOSH (здравствени граници во САД): | |||
PEL (дозволива)
|
никое[1] | ||
REL (препорачана)
|
TWA 5 ppm (7 mg/m3)[1] | ||
IDLH (непосредна опасност)
|
N.D.[1] | ||
| Безбедносен лист | ICSC 0564 | ||
| Дополнителни податоци | |||
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |||
| Наводи | |||
Производство
уредиКомерцијално производство
уредиСилан може да се произведува на неколку начини[4]. Обично, тоа произлегува од реакцијата на хлороводород со магнезиум силицид:
Се подготвува и од силициум од металуршки квалитет во процес во два чекора. Прво, силициумот се третира со хлороводород на околу 300 °C за да се произведе трихлоросилан, HSiCl3, заедно со водороден гас, според хемиската равенка
Потоа, трихлоросиланот се претвора во мешавина од силикон и силициум тетрахлорид:
Оваа реакција на прераспределба бара катализатор.
Најчесто користени катализатори за овој процес се метални халиди, особено алуминиум хлорид. Ова се нарекува реакција на редистрибуција, што е двојно поместување кое го вклучува истиот централен елемент. Може да се смета и како реакција на несразмерност, иако нема промена во бројот на оксидација за силициумот (Si има номинален оксидационен број IV кај сите три вида). Сепак, корисноста на концептот на оксидационен број за ковалентна молекула, дури и поларна ковалентна молекула, е двосмислена. Силиконскиот атом може да се рационализира дека има највисока формална оксидациска состојба и делумно позитивен полнеж во SiCl4 и најниската формална оксидациска состојба во SiH
4 , бидејќи Cl е многу поелектронегативен од H.
Алтернативен индустриски процес за подготовка на силикон со многу висока чистота, погоден за употреба во производството на силициум од полупроводничка класа, започнува со металуршки силициум, водород и силициум тетрахлорид и вклучува сложена серија на реакции на прераспределба (произведувајќи нуспроизводи кои се рециклираат во процесот) и дестилации. Реакциите се сумирани подолу:
Силанот произведен на овој пат може термички да се разложи за да произведе силициум и водород со висока чистота во еден премин.
Сепак, други индустриски патишта до силинот вклучуваат редукција на силициум тетрафлуорид (SiF4) со натриум хидрид (NaH) или редукција на SiCl4 со литиум алуминиум хидрид (LiAlH4).
Друго комерцијално производство на силин вклучува намалување на силициум диоксид (SiO2) под Al и H2 гас во мешавина од NaCl и алуминиум хлорид (AlCl3) при високи притисоци:
Патеки во лабораториски размери
уредиВо 1857 година, германските хемичари Хајнрих Буф и Фридрих Волер откриле силин меѓу производите формирани од дејството на хлороводородна киселина на алуминиум силицид, кои тие претходно го подготвиле. Тие го нареклр соединението силициран водород.
За демонстрации во училницата, силинот може да се произведе со загревање на песок со магнезиум во прав за да се произведе магнезиум силицид (Mg2Si), потоа се истура смесата во хлороводородна киселина. Магнезиумовиот силицид реагира со киселината за да произведе силилански гас, кој гори при контакт со воздух и произведува мали експлозии[5]. Ова може да се класифицира како хетерогено киселинско-базна хемиска реакција, бидејќи изолираната Si4− јон во Mg2Si антифлуоритната структура може да послужи како Бренстед-Лауриева база способна да прифати четири протони. Може да се напише како
Општо земено, алкално-земјените метали формираат силициди со следните стехиометрии: MII
2Si, MII
Si, and MII
Si
2. Во сите случаи, овие супстанции реагираат со Бренстед-Лауриевите киселини за да произведат некој тип на хидрид на силициум кој зависи од поврзаноста на Si анјонот во силицидот. Можните производи вклучуваат SiH
4 и/или повисоки молекули во хомологната серија SinH2n+2, полимерен силициум хидрид или силициумска киселина. Оттука, MII
Si со нивните цик-цак синџири на Si2− анјони (содржат два поединечни пара електрони на секој анјон Si кои можат да прифатат протони) го даваат полимерниот хидрид (SiH
2)
x.
Уште еден мал пат за производство на силин е од дејството на натриумовиот амалгам на дихлоросилан, SiH2Cl2, за да се добие моносилан заедно со малку жолт полимеризиран силициум хидрид (SiH)
x.[6].
Својства
уредиСиланот е силиконски аналог на метанот. Поради поголемата електронегативност на водородот во споредба со силициумот, овој поларитет на врската Si-H е спротивен од оној во C-H врските на метанот. Една последица на овој обратен поларитет е поголемата тенденција на силинот да формира комплекси со преодните метали. Втора последица е тоа што силинот е пирофорен — се подложува на спонтано согорување во воздух, без потреба од надворешно палење[7]. Сепак, тешкотиите во објаснувањето на достапните (често контрадикторни) податоци за согорувањето се припишуваат на фактот дека самиот силин е стабилен и дека природното формирање на поголеми силини за време на производството, како и чувствителноста на согорувањето на нечистотии како што се влагата и каталитичките ефекти на површините на контејнерите предизвикуваат нејзина пирофорност[8]. Над 420 °C, силинот се распаѓа на силициум и водород; затоа може да се користи при хемиско таложење на пареа на силициум.
Јачината на врската Si–H е околу 384 kJ/mol, што е околу 20% послаба од H–H врската во H2. Следствено, соединенијата што содржат Si-H врски се многу пореактивни отколку H2. Јачината на врската Si–H е скромно под влијание на други супституенти: јачината на врската SiHF3 419 kJ/mol, SiHCl3 382 kJ/mol, and SiHMe3 398 kJ/mol.[9][10]
Апликации
уредиИако постојат различни апликации за органосиланите, самиот силин има една доминантна примена, како претходник на елементарниот силициум, особено во индустријата за полупроводници. Повисоките силини, како што се ди- и трисилан, се само од академски интерес. Околу 300 метрички тони годишно силин биле потрошени во доцните 1990-ти[11]. Евтиното производство на соларни фотоволтаични модули довело до значителна потрошувачка на силин за таложење (PECVD) хидрогенизиран аморфен силициум (a-Si:H) на стакло и други подлоги како метал и пластика. Процесот на PECVD е релативно неефикасен при искористување на материјалите, при што приближно 85% од силинот се троши. За да се намали тој отпад и еколошкиот отпечаток на соларни ќелии базирани на a-Si:H, биле развиени дополнителни неколку напори за рециклирање[12][13].
Безбедност и мерки на претпазливост
уредиПријавени се голем број фатални индустриски несреќи предизвикани од согорување и детонација на истечениот силин во воздухот[14][15][16].
Поради слабите врски и водород силинот е пирофорен гас (способен за автозапалување на температури под 54 °C (129 °F))[17]
За посни мешавини е предложен процес на реакција во две фази, кој се состои од процес на потрошувачка на силилан и процес на оксидација на водород. Топлината на SiO
2(s) кондензацијата ја зголемува брзината на горење поради топлинска повратна информација[18].
Разредените силински мешавини со инертни гасови, како што се азот или аргон, имаат уште поголема веројатност да се запалат кога се испуштаат на отворено, во споредба со чистиот силин: дури и 1% мешавина од силиан во чист азот лесно се запали кога е изложена на воздух[19].
Во Јапонија, со цел да се намали опасноста од силин за производство на аморфни силициумски соларни ќелии, неколку компании почнале да го разредуваат силинот со водороден гас. Ова резултирало со симбиотска придобивка од правење постабилни соларни фотоволтаични ќелии бидејќи го намалува ефектот Штајблер-Вронски.
За разлика од метанот, силинот е прилично токсичен: смртоносната концентрација во воздухот за стаорци (LC 50) е 0,96% (9.600 ppm) во текот на 4-часовна изложеност. Дополнително, контактот со очите може да формира силициумска киселина со резултат на иритација[20].
Во однос на професионалната изложеност на силин на работниците, Националниот институт за безбедност и здравје при работа на САД поставил препорачана граница на изложеност од 5 ppm (7 mg/m 3 ) преку временски пондериран просек од осум часа[21].
Наводи
уреди- ↑ 1,0 1,1 1,2 1,3 1,4 „Џебен водич за опасните хемиски материи #0556“. Национален институт за безбедност и здравје при работа (NIOSH). (англиски)
- ↑ 2,0 2,1 Haynes, p. 4.87
- ↑ Haynes, p. 9.29
- ↑ Simmler, W., „Silicon Compounds, Inorganic“, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a24_001
- ↑ „Making Silicon from Sand“. Popular Science. Архивирано од изворникот 2010-11-29 – преку Theodore Gray..
- ↑ Mellor, J. W. "A Comprehensive Treatise on Inorganic and Theoretical Chemistry", vol. VI. Longmans, Green and Co. (1947), pp. 970–971.
- ↑ Emeléus, H. J.; Stewart, K. (1935). „The oxidation of the silicon hydrides“. Journal of the Chemical Society: 1182–1189. doi:10.1039/JR9350001182. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ Koda, S. (1992). „Kinetic Aspects of Oxidation and Combustion of Silane and Related Compounds“. Progress in Energy and Combustion Science. 18 (6): 513–528. doi:10.1016/0360-1285(92)90037-2.
- ↑ M. A. Brook "Silicon in Organic, Organometallic, and Polymer Chemistry" 2000, J. Wiley, New York. ISBN 0-471-19658-4.
- ↑ „Standard Bond Energies“. Michigan State University Organic Chemistry.
- ↑ Timms, P. L. (1999). „The chemistry of volatile waste from silicon wafer processing“. Journal of the Chemical Society, Dalton Transactions (6): 815–822. doi:10.1039/a806743k.
- ↑ Briend P, Alban B, Chevrel H, Jahan D. American Air, Liquide Inc. (2009) "Method for Recycling Silane (SiH4)". US20110011129 Архивирано на 22 септември 2013 г., EP2252550A2 Архивирано на 23 септември 2013 г..
- ↑ Kreiger, M.A.; Shonnard, D.R.; Pearce, J.M. (2013). „Life cycle analysis of silane recycling in amorphous silicon-based solar photovoltaic manufacturing“. Resources, Conservation and Recycling. 70: 44–49. doi:10.1016/j.resconrec.2012.10.002. S2CID 3961031. Архивирано од изворникот 2017-11-12.
- ↑ Chen, J. R. (2002). „Characteristics of fire and explosion in semiconductor fabrication processes“. Process Safety Progress. 21 (1): 19–25. doi:10.1002/prs.680210106. S2CID 110162337.
- ↑ Chen, J. R.; Tsai, H. Y.; Chen, S. K.; Pan, H. R.; Hu, S. C.; Shen, C. C.; Kuan, C. M.; Lee, Y. C.; Wu, C. C. (2006). „Analysis of a silane explosion in a photovoltaic fabrication plant“. Process Safety Progress. 25 (3): 237–244. doi:10.1002/prs.10136. S2CID 111176344. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ Chang, Y. Y.; Peng, D. J.; Wu, H. C.; Tsaur, C. C.; Shen, C. C.; Tsai, H. Y.; Chen, J. R. (2007). „Revisiting of a silane explosion in a photovoltaic fabrication plant“. Process Safety Progress. 26 (2): 155–158. doi:10.1002/prs.10194. S2CID 110741985. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ Silane MSDS Архивирано на 19 мај 2014 г.
- ↑ V.I Babushok (1998). „Numerical Study of Low and High Temperature Silane Combustion“. The Combustion Institute. 27 (2): 2431–2439. doi:10.1016/S0082-0784(98)80095-7.
- ↑ Kondo, S.; Tokuhashi, K.; Nagai, H.; Iwasaka, M.; Kaise, M. (1995). „Spontaneous Ignition Limits of Silane and Phosphine“. Combustion and Flame. 101 (1–2): 170–174. doi:10.1016/0010-2180(94)00175-R. Занемарен непознатиот параметар
|name-list-style=(help) - ↑ „MSDS for silane“ (PDF). vngas.com. Архивирано од изворникот на 2009-02-20.CS1-одржување: неподобна URL (link)
- ↑ „Silicon tetrahydride“. NIOSH Pocket Guide to Chemical Hazards. Centers for Disease Control and Prevention. April 4, 2011. Архивирано од изворникот July 26, 2014. Посетено на November 18, 2013.