Прогресивна осифирачка фибродисплазија
Прогресивна осифирачка фибродисплазија (ПОФ -Fybrodysplasia ossificans progressiva (FOP)) е исклучително ретка болест на сврзното ткиво . Тоа е сериозно, оневозможено нарушување, без лекување, и е единствената позната медицинска состојба кога еден систем на органи се менува во друг.
Нарушувањето е предизвикано од мутација на механизмот за поправање на телото, што предизвикува фиброзно ткиво (вклучувајќи ги мускулите, тетивите и лигаментите ) да се осифицира спонтано или кога е оштетено. Во многу случаи, во спротивно, помалите повреди можат да предизвикаат зглобовите да бидат постојано замрзнати на место, бидејќи се формираат нови коски и го заменуваат оштетеното мускулно ткиво. Ова ново формирање на коски (Познато како „Хетеротско осификација“) на крајот формира секундарен скелет и постепено ја ограничува способноста на пациентот да се движи. Тековните докази сугерираат дека болеста може да предизвика деградација на зглобовите одделно од карактеристичниот раст на коските.[1]
Се покажало дека хируршкото отстранување на дополнителните израстоци на коските предизвикува дека телото „ја поправа“ погодената област со уште повеќе коски. Иако стапката на раст на коските се развива различно во зависност од пациентот, состојбата на крајот ги остава погодените во „замрзната“ позиција бидејќи новата коска ја заменува мускулатурата и осигурувачите со скелетот. Некои пациенти се обиделе да ги постават своите тела во позиција во која претпочитале да бидат затворени за време на разгорување. Ова не е обично успешно.
Знаци и симптоми
уредиОд непознати причини, децата родени со ПОФ често имаат деформирани големи прсти, понекогаш недостасува зглоб или, во други случаи, едноставно претставувајќи се со забележителна грутка на малолетникот. Првиот „одблесок“ што доведува до формирање на коски на ПОФ обично се јавува пред 10-годишна возраст. Растот на коските напредува од врвот на телото надолу, исто како што коските растат кај фетусите. Дете со ПОФ обично ќе развие дополнителни коски почнувајќи од вратот, потоа на рамената, рацете, пределот на градите и на крај, на нозете.
Симптомите започнуваат уште во раното детство и се појавуваат во форма на чувствителен оток на главата, вратот или грбот, кој потоа се претвора во коска. Обидите да се отстрани новонастаната коска и која било форма на физичка (биопсија, инекција, хируршка процедура, мозочен удар) или метаболичка траума кај луѓето со ФОП доведува до незапирлива прогресија и ново формирање на коски и инвалидитет. Исклучително е важно да се работи на подигање на свеста за ФОП бидејќи несоодветните интервенции и погрешно дијагностицирање се погубни за луѓето со ФОП. Иако ФОП во принцип не ги напаѓа внатрешните органи,но срцето, а особено белите дробови, се крајно ранливи од фактот дека телото е како во коскен оклоп.
Поточно, осификацијата обично се појавува во дорзалните, осните, кранијалните и проксималните региони на телото. Подоцна болеста напредува во вентралниот, слепото црево, каудалното и дисталното подрачје на телото.[2] Сепак, не мора да се појавува во овој редослед заради одблесоци предизвикани од повреди. Честопати, грутки слични на тумор кои ја карактеризираат болеста се појавуваат ненадејно. Оваа состојба предизвикува губење на подвижност на погодените зглобови, вклучително и неможност за целосно отворање на устата, ограничување на говорот и јадење; специфична појава на оваа состојба на зглобовите на стапалото може да резултира во ограничена способност на пациентот ПОФ да постави стапало рамно на земја. Растот на коските исто така може да резултира во имобилизација на колкот или коленото, влијае на способноста на поединецот да оди. Дополнителното формирање на коските околу кафезот на ребрата го ограничува проширувањето на белите дробови и дијафрагмата што предизвикува респираторни компликации.
Бидејќи нарушувањето е толку ретко, состојбата може погрешно да се дијагностицира како карцином или фиброза . Ова ги тера лекарите да нарачаат биопсии што можат да го влошат растот на коската на ПОФ.[3] Присуството на неправилни прсти или палци кај родените со ПОФ помага да се разликува ова нарушување од другите проблеми со скелетот.[4]
Средната возраст на преживување е 40 години со соодветно медицинско управување. Сепак, одложената дијагноза, траума и инфекции може да го намалат животниот век.[5]
Причини
уредиПОФ е предизвикана од автозомно доминантен алел на хромозомот 2q23-24.[6] Алелот има променлива експресивност, но целосен продор . Повеќето случаи се предизвикани од спонтана мутација во гамите ; повеќето луѓе со ПОФ не можат или да изберат да немаат деца. Слична, но помалку катастрофална болест е фиброзна дисплазија, која е предизвикана од пост-зиготска мутација . Причинител за оваа болест е мутацијата на генот ACVR1 и секогаш се јавува на истото место во генот, а болеста е наследна автозомно доминантно, што значи дека една копија на променетиот ген во клетката е доволна за да предизвика болест. Затоа, детето на родители, од кои едниот е хетерозигот кој страда од ФОП, а другиот во никој случај не се поврзани со ФОП, има 50% шанси да развие ФОП сам. Мутација во генот АКВР1 (позната и како киназа слична на активин 2 (АЛК2)) е одговорна за оваа болест.[7] АКВР1 кодира активин рецептор тип-1, рецептор БМП тип-1. Мутацијата предизвикува супституција на кодонот 206 од аргинин до хистидин во АКВР1 белковината.[8] Оваа замена предизвикува абнормално активирање на АКВР1, што доведува до трансформација на сврзното ткиво и мускулното ткиво во секундарен скелет. Ова предизвикува ендотелијалните клетки да се трансформираат во мезенхимални матични клетки, а потоа во коска.[9]
Генетика
уредиПОФ е автозомно доминантно нарушување. Така, децата на заболениот хетерозиготски родител и нефициран родител имаат 50% веројатност да бидат заразени. Две погодени лица можат да произведат несакани деца. Хомозиготната доминантна форма е потешка од хетерозиготната форма.[10]
Белковината што предизвикува осификација нормално се деактивира со инхибиторна белковина откако коските на фетусот се формираат во матката, но кај пациенти со ПОФ белковината продолжува да работи. Аберантско формирање на коски кај пациенти со ПОФ се јавува кога повредени сврзно ткиво или мускулни клетки на местата на повреда или раст неправилно изразуваат ензим за поправка на коските за време на апоптоза (саморегулирана смрт на клетките), што резултира во лимфоцити кои содржат вишок на коскено морфогенетска белковина 4 (БМП4 ) обезбедени при одговор на имунолошкиот систем. Коската што резултира се јавува независно од нормалниот скелет, формирајќи свои дискретни скелетни елементи. Сепак, овие елементи можат да се спојат со нормална коскена коска.[11] Дијафрагмата, јазикот и вон-окуларните мускули се поштедени во овој процес, како и срцевиот и мазниот мускул .[2] Бидејќи неправилниот ензим останува нерешен во рамките на имунолошкиот одговор, телото продолжува да ги обезбедува неправилните лимфоцити кои содржат БМП4. БМП4 е производ што придонесува за развој на скелетот во нормалниот ембрион.[12]
AKВР1 генот кодира рецептор на коскено морфогена белковина (БМП); овој ген е мутиран во ПОФ. Одговорен е за раст и развој на коските и мускулите. Типичната мутација, Р202Х, го прави инхибиторот ФКБП1А да се врзува помалку цврсто на јамката за активирање ГС.[13] Крајниот резултат е дека АКВР не е ефикасно исклучен и се јавува преголем раст на коските и ’рскавицата и спојување на зглобовите.[14] Атипични мутации кои вклучуваат други остатоци работат слично. Во некои случаи, рецепторот може да заврши со сигнализација дека е активен без да биде врзан за неговата активирачка лиганд.[15]
Повеќето случаи на ПОФ се резултат на нова генетска мутација: овие луѓе немаа историја на ова пореметување во нивното семејство. Постојат некои случаи кога поединецот ја наследил мутацијата од еден засегнат родител.[14]
Дијагноза
уредиКлучот за да се постави прецизна дијагноза е деформитетот на прстите со кои се раѓаат повеќето луѓе со ФОП, кои лесно се препознаваат при раѓање. ФОП се одликува со прогресивно осификација на мускулите, лигаментите, тетивите и мекото ткиво воопшто, што резултира во формирање на дополнителен скелет и трајна и тешка форма на физичка попреченост. Повеќето луѓе со ФОП се корисници на инвалидска количка. Избувнувањата може да се мерат клинички со покачени нивоа на алкална фосфатаза и алкална фосфатаза специфична за коските .[16]
Третман
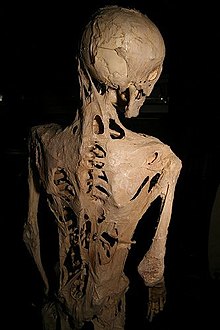
уредиОпциите за третман на прогресивна осифицирачка фибродисплазија се чисто симптоматски - насочени кон ублажување на симптоматологијата и одложување на компликациите - бидејќи нема третмани, барем засега, способни да ја откажат мутацијата, или пред раѓање или раѓање. одговорни за предметната болест и нејзините последици. Harry Eastlack е најпознат пациент од ФОП. Неговите симптоми станале позначајни на 10-годишна возраст, а пред да умре од пневмонија непосредно пред неговиот 40-ти роденден, ткивата му биле окостени до тој степен што можел само да ги мрда само усните. Свесен за реткоста на неговата состојба, тој го донираше своето тело на науката, а неговиот скелет е изложен денес во музејот “Mütter” во Филаделфија. Светски ден за подигање на свеста за ФОП е23 април.
Нема лек или одобрен третман за ПОФ.[17] Обидите за хируршко отстранување на коската може да резултираат во експлозивен раст на коските.[18] Додека се наоѓаат под анестезија, лицата со ПОФ може да наидат на потешкотии при интубација, рестриктивно белодробно заболување и промени во системот за електрична спроводливост на срцето .[19] Треба да се избегнуваат активности што го зголемуваат ризикот од паѓање или оштетување на меките ткива, бидејќи дури и ситна траума може да предизвика хетеропична формација на коските.[20]
Епидемиологија
уредиОд 2017 година, околу 800 случаи на ПОФ се потврдени ширум светот, со што ПОФ е една од најретките заболувања.[17] Проценетата зачестеност на ПОФ е 0,5 случаи на милиони луѓе и ги погодува сите етникуми.
Историја
уредиМедицински извештаи кои опишуваат лица погодени од ПОФ датира уште од седумнаесеттиот век.[17] ПОФ првично беше наречен миозитис осифирачка фибродисплазија и се сметаше дека е предизвикано од мускулно воспаление ( миозитис ) што предизвикало формирање на коски. Болеста е преименувана во Виктор А. Меккусик во 1970 година по откритието дека мекото ткиво, освен мускулите (на пр. Лигаментите ), исто така, влијаело на процесот на болеста.
Најпознатиот случај на ПОФ е оној на Хари Истлек (1933-1973). Неговата состојба започна да се развива на десетгодишна возраст, а до моментот на смртта од пневмонија во ноември 1973 година, шест дена пред неговиот 40-ти роденден, неговото тело беше целосно осифицирано, оставајќи го во можност да ги движи само усните. Истлак се запозна со едно друго лице со ПОФ за време на неговиот живот.
Истлак го донираше своето тело на науката. Неговиот скелет сега е во музејот Миттер во Филаделфија и се покажа како непроценлив извор на информации во студијата на ПОФ. Друго настрадано лице од ПОФ, Керол Орзел ( 1960–2018), исто така, го донираше своето тело во музејот и нејзиниот скелет беше поставен на изложбата таму, во непосредна близина на Истлек, во февруари 2019 година.[21]
Истражување
уредиКлиничките испитувања на изотретиноин, етидронат со орални кортикостероиди и перхексилин не успеаја да ја покажат ефикасноста, иако варијабилниот тек на болеста и малата застапеност предизвикува неизвесност.[16]
Неколку фармацевтски компании фокусирани на ретки болести во моментот се во различни фази на испитување на различни терапевтски пристапи за ПОФ.
Во август 2015 година, Климентсија Фармацевтика започна со запишување на деца (на возраст од 6 и повеќе години) во клиничкото испитување на Фаза II, што го испитува паловаротин за третман на ПОФ.[22] Предклиничките студии покажаа дека паловаротин, гама агонист на рецептори на ретиноична киселина, блокираше абнормално формирање на коски кај животински модели со инхибиција на секундарни системи на гласникот во патека на БМП.[23] Клименција ја Рош Фармацевтски иценцираше паловаротин од која претходно го оцени соединението кај повеќе од 800 лица, вклучително и здрави доброволци и пациенти со хронично опструктивно белодробно заболување. Паловаротен добил ознака Брза патека од ФДА и сирачиња за третман на ПОФ и од ФДА и од Европската агенција за лекови (ЕАЛ).
Во септември 2015 година, Регенеран објави нов увид во механизмот на заболување што вклучува активирање на АКВР1 рецепторот од активин А. Во 2016 година, компанијата иницираше фаза 1 студија на неговото активирано антитело, РЕГ 2477, кај здрави волонтери; беше спроведена фаза на судење во фаза 2 кај пациенти со ПОФ во 2017 година.[24]
Друг потенцијален терапевтски пристап вклучува мешање специфични за ПХК специфични за алели, кои се насочени кон мутирана ПХА за деградација при зачувување на нормалниот израз на генот АКВР1.[25]
Понатамошна истрага за механизмите на хетеротско формирање на коските во ПОФ може да помогне во развојот на третмани за други нарушувања кои вклучуваат вонскелетни коски.
Фибро / адипогени прогенитори (ФАП) може да бидат типичен клетки што предизвикуваат болести одговорни за активин А зависна ектопична коскена формација и во мускулите и во тетивите на глувците кои носат ПОФ, што предизвикува мутација на АКВР1 (Р206Х).[26]
Клиничките испитувања на повеќе потенцијални третмани се во тек од 2019 година.[27]
Поврзано
уреди- Меѓународна асоцијација ПОФ
- Остеогенеза имперфекта, состојба која се одликува со лесно кршење на коските, предизвикана од мутации во гените поврзани со оние одговорни за ПОФ
- Пријатели на ПОФ
Наводи
уреди- ↑ "Here's What Happens When Your Body Tissues Turn to Bone", National Geographic, 1 March 2019
- ↑ 2,0 2,1 Fibrodysplasia ossificans progressiva. Frederick S. Kaplan, MD, Martine Le Merrer, MD, PhD, Professor of Genetics, David L. Glaser, MD, Robert J. Pignolo, MD, PhD, Robert Goldsby, MD, Joseph A. Kitterman, MD, Jay Groppe, PhD, and Eileen M. Shore, PhD
- ↑ Obamuyide HA, Ogunlade SO. "A Tumour for which Surgery will do more harm than good: A Case Report of Fibrodysplasia Ossificans Progressiva". Niger Postgrad Med J. 2015;22(1):83–88.
- ↑ „Fibrodysplasia ossificans progressiva“. Lister Hill National Center for Biomedical Communications. Посетено на 2013-12-12.
- ↑ Saleh, Mohammed; Commandeur, Joost; Bocciardi, Renata; Kinabo, Grace; Hamel, Ben (2015). „Fibrodysplasia ossificans progressiva with minor unilateral hallux anomaly in a sporadic case from Northern Tanzania with the common ACVR1c.617G>A mutation“. The Pan African Medical Journal. 22: 299. doi:10.11604/pamj.2015.22.299.8032. PMC 4769042. PMID 26966495.
- ↑ Feldman, G. „A recurrent mutation in the BMP type I receptor ACVR1 (HSC'13) causes inherited and sporadic fibrodysplasia ossificans progressiva“ (PDF).
- ↑ Shore EM; Xu M; Feldman GJ; и др. (2006). „A recurrent mutation in the BMP type I receptor ACVR1 causes inherited and sporadic fibrodysplasia ossificans progressiva“. Nat. Genet. 38 (5): 525–527. doi:10.1038/ng1783. PMID 16642017.
- ↑ Hatsell, Sarah J.; Idone, Vincent; Wolken, Dana M. Alessi; Huang, Lily; Kim, Hyon J.; Wang, Lili; Wen, Xialing; Nannuru, Kalyan C.; Jimenez, Johanna (2015). „ACVR1R206H receptor mutation causes fibrodysplasia ossificans progressiva by imparting responsiveness to activin A“. Science Translational Medicine. 7 (303): 303ra137. doi:10.1126/scitranslmed.aac4358. PMC 6164166. PMID 26333933.
- ↑ Dinther; и др. (2010). „ALK2 R206H mutation linked to fibrodysplasia ossificans progressiva confers constitutive activity to the BMP type I receptor and sensitizes mesenchymal cells to BMP-induced osteoblast differentiation and bone formation“. Journal of Bone and Mineral Research. 25 (6): 091211115834058–35. doi:10.1359/jbmr.091110. PMID 19929436.
- ↑ Cummings, Michael R. Human Heredity: Principles and Issues Cengage Learning, 2011, [2009]. p. 77
- ↑ Shore Eileen M.; Kaplan Frederick S. (2008). „Insights from a Rare Genetic Disorder of Extra-Skeletal Bone Formation, Fibrodysplasia Ossificans Progressiva (FOP)“. Bone. 43 (3): 427–443. doi:10.1016/j.bone.2008.05.013. PMC 2601573. PMID 18590993.
- ↑ Kierszenbaum, Abraham (2002). Histology and cell biology. New York: Mosby. ISBN 978-0-323-01639-1.
- ↑ "AVCR1", Genetics Home Reference, U.S. National Library of Medicine, August 2007. Accessed February 18, 2014.
- ↑ 14,0 14,1 "Fibrodysplasia ossificans progressiva", Genetics Home Reference, U.S. National Library of Medicine, August 2007. Accessed February 18, 2014.
- ↑ Petrie, KA; Lee, WH; Bullock, AN; Pointon, JJ; Smith, R; Russell, RG; Brown, MA; Wordsworth, BP; Triffitt, JT (2009). „Novel mutations in ACVR1 result in atypical features in two fibrodysplasia ossificans progressiva patients“. PLOS ONE. 4 (3): e5005. Bibcode:2009PLoSO...4.5005P. doi:10.1371/journal.pone.0005005. PMC 2658887. PMID 19330033.
- ↑ 16,0 16,1 Hiroshi Kitoh; и др. (2013). „Perhexiline maleate in the treatment of fibrodysplasia ossificans progressiva: an open-labeled clinical trial“. Orphanet Journal of Rare Diseases. 8: 163. doi:10.1186/1750-1172-8-163. PMC 4015865. PMID 24131551.
- ↑ 17,0 17,1 17,2 „Cellular and morphological aspects of fibrodysplasia ossificans progressiva. Lessons of formation, repair, and bone bioengineering“. Organogenesis (Review). 10 (3): 303–311. 2014. doi:10.4161/org.29206. PMC 4750545. PMID 25482313.
- ↑ American Academy of Orthopaedic Surgeons (May 2006). „Fibrodysplasia Ossificans Progressiva (FOP)“. orthoinfo.aaos.org. Архивирано од изворникот на 21 June 2012. Посетено на 2011-10-07.
- ↑ Newton, M.C.; Allen, P.W.; Ryan, D.C. (1990). „Fibrodysplasia Ossificans Progressiva“. стр. 246–250. doi:10.1093/bja/64.2.246. PMID 2317429. Посетено на October 25, 2011.
- ↑ „Архивиран примерок“. Архивирано од изворникот на 2015-12-22. Посетено на 2015-11-22.
- ↑ McCullough, Marie (February 28, 2019). „New Mutter Museum exhibit grants final wish for woman who turned to bone“. The Philadelphia Inquirer. Посетено на February 28, 2019.
- ↑ „Clementia Pharmaceuticals Expands Ongoing Phase 2 Study to Include Children with Fibrodysplasia Ossificans Progressiva (FOP)“. PRNewswire. August 25, 2015. Посетено на 22 November 2015.
- ↑ „Pipeline“. www.clementiapharma.com. Архивирано од изворникот на 29 September 2015. Посетено на 22 November 2015.
- ↑ „Regeneron Shares Updates on its Ongoing FOP Research Program“. International Fibrodysplasia Ossificans Progressiva Association. March 9, 2017.
- ↑ J. W. Lowery; V. Rosen (2012). „Allele-Specific RNA Interference in FOP Silencing the FOP gene“. Gene Therapy. 19 (7): 701–702. doi:10.1038/gt.2011.190. PMID 22130446.
- ↑ John B. Lees-Shepard; Masakazu Yamamoto; Arpita A. Biswas; и др. (2018). „Activin-dependent signaling in fibro/adipogenic progenitors causes fibrodysplasia ossificans progressiva“. Nature Communications. 9 (471): 471. Bibcode:2018NatCo...9..471L. doi:10.1038/s41467-018-02872-2. PMC 5797136. PMID 29396429.
- ↑ Marie McCullough, Therapies in sight for FOP, a disease that turns muscle to bone, Philadelphia Inquirer, 29 February 2019.
Дополнителна литература
уреди- Cohen, MM; Howell, RE (October 1999). „Etiology of fibrous dysplasia and McCune-Albright syndrome“. International Journal of Oral and Maxillofacial Surgery. 28 (5): 366–371. doi:10.1016/s0901-5027(99)80085-x. PMID 10535539.
Надворешни врски
уреди| Класификација | |
|---|---|
| Надворешни извори |