Закон за запазување на масата
Законот за зачувување на масата/материјата, некаде познат и како принцип за зачувување на масата/материјата или закон за неуништливост на материјата, е еден од основните закони во физиката и хемијата (и природата, воопшто) кој гласи дека масата на еден затворен систем ќе остане постојана со текот на времето, без разлика на процесите кои се одвиваат во системот. Слично, масата не може да се создаде или уништи, но може да се прераспореди во просторот и да се измени во различни типови на честички. Ова укажува дека при секоја хемиска реакција во еден затворен систем, масата на реактантите мора да е еднаква на масата на производите. Ова е и главната замисла на Првиот закон на термодинамиката.
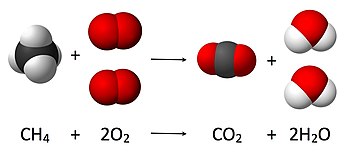
Масата не се зачувува целосно во отворените системи, кога различни видови на енергија влегуваат или излегуваат од системот.
Историски развој
уредиЛавоазје во 1774 година, во експеримент во кој загревал калај со воздух во затворениот сад, приметил дека тежината на целиот систем е иста пред и после калцинацијата. Со ова е докажано дека системот ниту добил, ниту изгубил на тежина. Овој експеримент укажал на фактот дека нема промени во количината на материјата пред и после реакцијата.
Дефиниција
уредиЗаконот за зачувување на масата може да се дефинира на следниот начин:
Вкупната тежина на супстанцата која влегува во реакција е еднаква на вкупната тежина од производот на реакцијата.
Доколку A и B претставуваат тежини на две супстанци кои учествуваат во некоја хемиска реакција во која се создаваат тежините C и D на другите две (хемиски променети) супстанци, законот за зачувување на масата може да се изрази како:
A+B = C+D
Иако демонстрацијата на овој закон се припишува на Лавоазје, овој закон бил јасно дефиниран од страна на рускиот хемичар М. В. Ломоносов во 1756 година. Х. Ландолт (1893) и А. Хејдвејлер (1901) извршиле експерименти со кои ја потврдиле точноста на овој закон. Од овие експерименти заклучиле дека постои мало отстапување во вкупните маси, но дека овие отстапувања се во рамките на експериментални грешки.
Џ. Џ. Мали во 1912 употребил вага која била силно усовршена за да се отстрани недостатокот од горенаведените експерименти. Тој успеал да докаже дека во случај на реакција меѓу бариум хлорид и натриум сулфат, секоја промена во масата мора да биде помала од еден милионити дел.
Кога се зборува за овој закон, мора да се забележи дека според теоријата за релативноста на материјата (како облик на енергија) и енергијата може да преоѓа од една во друга форма, во меѓусебен однос кој е дефиниран со познатата Ајнштајнова равенка:
E = mc2
каде:
E - ослободена или апсорбирана енергија
m - губиток или добиток на маса
c – брзина на светлината.
Со други зборови, наместо двата фундаментални закони: закон за одржување на масата и законот за одржување на енергијата, постои само еден принцип.
При било која хемиска реакција која е придружена со промена на температурата, се врши и одговарачката промена на масата. Тоа значи дека при хемиската реакција се врши промена на масата, но ако се земе предвид високата вредност c, губитокот на масата е исклучително низок и според тоа законот за зачувување на масата како што погоре е наведен може да се земе за точен за сите експериментални мерења.