Цезиум бромид
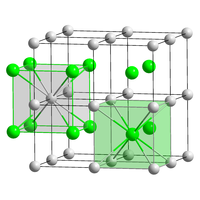
Цезиум бромид — јонско соединение на цезиум и бром со хемиска формула CsBr. Тоа е бела или провидна цврста супстанца со точка на топење од 636 °C што лесно се раствара во вода. Неговите кристали имаат кубична структура на CsCl, но структурата се менува во типот кој го има камената сол кога е во нанометарски тенок филм кој се одгледува на супстрати од микашист, LiF, KBr или NaCl.[6]
| |

| |
Назив според МСЧПХ Цезиум бромид | |
Други називи Цезиум бромид, | |
| Назнаки | |
|---|---|
| 7787-69-1 | |
| ChemSpider | 22994 |
| EC-број | 232-130-0 |
| |
| 3Д-модел (Jmol) | Слика |
| PubChem | 24592 |
| |
| UNII | 06M25EDM3F |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | Бела кристална супстанца |
| Густина | 4.43 g/cm3[1] |
| Точка на топење | |
| Точка на вриење | |
| 1230 g/L (25 °C)[1] Спорно.
420 g/L (11 °C) | |
| -67.2·10−6 cm3/mol[2] | |
| Показател на прекршување (nD) | 1.8047 (0.3 µm) 1.6974 (0.59 µm) 1.6861 (0.75 µm) 1.6784 (1 µm) 1.6678 (5 µm) 1.6439 (20 µm)[3] |
| Структура | |
| Кристална структура | CsCl, cP2 |
| Pm3m, No. 221[4] | |
| Кубична (Cs+) Кубична (Br−) | |
| Опасност | |
| GHS-ознаки: | |
Пиктограми
|

|
Сигнални зборови
|
Предупредување |
Изјави за опасност
|
H302, H315, H319, H335 |
Изјави за претпазливост
|
P261, P264, P270, P271, P280, P301+P312, P302+P352, P304+P340, P305+P351+P338, P312, P321, P330, P332+P313, P337+P313, P362, P403+P233, P405, P501 |
| NFPA 704 | |
| Температура на запалување | Non-flammable |
| Смртоносна доза или концентрација: | |
LD50 (средна доза)
|
1400 mg/kg (орално, стаорец)[5] |
| Слични супстанци | |
| Други анјони | Цезиум флуорид Цезиум хлорид Цезиум јодид Цезиум астатид |
| Други катјони | Натриум бромид Натриум бромид Натриум бромид Натриум бромид |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Synthesis
уредиЦезиум бромид може да се подготви преку следните реакции:
- CsOH (aq) + HBr (aq) → CsBr (aq) + H2O (l)
- Cs2(CO3) (aq) + 2 HBr (aq) → 2 CsBr (aq) + H2O (l) + CO2 (g)
- Дирекртна синтеза:
- 2 Cs (s) + Br2 (g) → 2 CsBr (s)
Директната синтеза е енергична реакција на цезиумот со други халогени. Поради високата цена, не се користи за подготовка.
Употреба
уредиЦезиум бромидот понекогаш се користи во оптика како компонента на разделувачот на зракот во спектрофотометрите со широк опсег.
Наводи
уреди- ↑ 1,0 1,1 1,2 Haynes, p. 4.57
- ↑ Haynes, p. 4.132
- ↑ Haynes, p. 10.240
- ↑ Vallin, J.; Beckman, O.; Salama, K. (1964). „Elastic Constants of CsBr and CsI from 4.2°K to Room Temperature“. Journal of Applied Physics. 35 (4): 1222. Bibcode:1964JAP....35.1222V. doi:10.1063/1.1713597.
- ↑ Caesium bromide. nlm.nih.gov
- ↑ Schulz, L. G. (1951). „Polymorphism of cesium and thallium halides“. Acta Crystallographica. 4 (6): 487–489. doi:10.1107/S0365110X51001641.
Цитирани извори
уреди- Haynes, William M., уред. (2011). CRC Handbook of Chemistry and Physics (XCII. изд.). Boca Raton, FL: CRC Press. ISBN 1439855110.
Надворешни врски
уреди- Цезиум бромид на Ризницата ?
- MSDS at Oxford University Архивирано на 17 октомври 2007 г.
- Crystran Physical data Архивирано на 18 декември 2012 г., IR transmission spectrum
- Ultra-violet photoabsorption measurements in alkali iodide and caesium bromide evaporated films
