Селен монохлорид
Селен монохлорид — неорганско соединение со формулата Se 2 Cl 2 . Иако се нарекува селен монохлорид, поописно име може да биде дизелен дихлорид. Тоа е црвено-кафеава, мрсна течност која бавно се хидролизира. Постои во хемиска рамнотежа со SeCl <sub id="mwCw">2</sub>, SeCl 4, хлор и елементарен селен .[1] Селен монохлорид главно се користи како реагенс за синтеза на соединенија што содржат Se.
| |
Назив според МСЧПХ Селен монохлорид | |
Други називи Дихлородизеленид, Диселениум дихлорид, Селен хлорид, 1,2-дихлородизелан | |
| Назнаки | |
|---|---|
| 10025-68-0 | |
| ChemSpider | 59591 |
| EC-број | 233-037-8 |
| |
| 3Д-модел (Jmol) | Слика |
| PubChem | 66206 |
| |
| UNII | 2A5292FC4P |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | Reddish-brown oily liquid |
| Густина | 2.7741 g/cm3 |
| Точка на топење | |
| Точка на вриење | |
| нерастворливи | |
| Растворливост во други растворувачи | Растворлив во хлороформ, јаглерод дисулфид и ацетонитрил |
| −94.8·10−6 cm3/mol | |
| Опасност | |
| GHS-ознаки: | |
Пиктограми
|
   
|
Сигнални зборови
|
Опасност |
Изјави за опасност
|
H301, H311, H314, H331, H373, H410 |
Изјави за претпазливост
|
P260, P261, P264, P270, P271, P273, P280, P301+P310, P301+P330+P331, P302+P352, P303+P361+P353, P304+P340, P305+P351+P338, P310, P311, P312, P314, P321, P322, P330, P361, P363, P391, P403+P233, P405, P501 |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Структура и својства
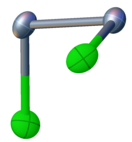
уредиСелен монохлорид има поврзаност Cl-Se-Se-Cl. Со нерамна структура, има C2 молекуларна симетрија, слична на водород пероксид и сулфур монохлорид . Должината на врската Se-Se е 2,23 Å, а должината на врската Se-Cl е 2,20 Å. Диедралниот агол е 87°.[2]
Подготовка
уредиРаните патишта до селен монохлорид вклучуваа хлорирање на елементарниот селен.[3] Подобрен метод вклучува реакција на мешавина од селен, селен диоксид и хлороводородна киселина:[4]
- 3 Se + SeO 2 + 4 HCl → 2 Se 2 Cl 2 + 2 H 2 O
Од реакционата смеса се таложи густ слој на селен монохлорид, кој може да се прочисти со негово растворање во испарувана сулфурна киселина и повторно таложење со хлороводородна киселина . Вториот метод за синтеза вклучува реакција на селен со олеум и хлороводородна киселина:[4]
- 2 Se + 2 SO 3 + 3 HCl → Se 2 Cl 2 + H 2 SO 3 + SO 2 (OH)Cl
Суровиот селен монохлорид се отстранува преку сепараторна инка. Селен монохлорид не може да се дестилира без распаѓање, дури и при намален притисок.[4]
Во растворите на ацетонитрил, тој постои во рамнотежа со SeCl 2 и SeCl 4 .[5] Селен дихлорид се разградува до монохлорид по неколку минути на собна температура:[6]
- 3 SeCl 2 → Se 2 Cl 2 + SeCl 4
Реакции
уредиСелен монохлорид е електрофилен селенизирачки агенс, и затоа реагира со едноставни алкени и дава бис ( β -хлороалкил) селенид и бис(хлороалкил)селен дихлорид. Ги претвора хидразоните на попречените кетони во соодветните селенокетони, структурни аналози на кетоните при што атомот на кислород се заменува со атом на селен. Конечно, соединението е искористено за воведување на премостувачки селенски лиганди помеѓу металните атоми на некои комплекси на железо и хром карбонил.
Наводи
уреди- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. изд.). Butterworth-Heinemann. ISBN 0080379419.
- ↑ Kniep, Rüdiger; Körte, Lutz; Mootz, Dietrich (1 January 1983). „Kristallstrukturen von Verbindungen A2X2 (A = S, Se; X = Cl, Br)“. Zeitschrift für Naturforschung B. 38 (1): 1–6. doi:10.1515/znb-1983-0102.
- ↑ Lenher, Victor; Kao, C. H. (1925). „The Preparation of Selenium Monochloride and Monobromide“. Journal of the American Chemical Society. 47 (3): 772–774. doi:10.1021/ja01680a025.
- ↑ 4,0 4,1 4,2 Fehér, F. "Diselenium Dichloride". In Handbook of Preparative Inorganic Chemistry; Brauer, G., Ed.; Academic Press: New York, 1963; Vol. 1; p 422-433.
- ↑ Lamoureux, Marc; Milne, John (1990). „Selenium chloride and bromide equilibria in aprotic solvents; a 77Se NMR study“. Polyhedron. 9 (4): 589–595. doi:10.1016/S0277-5387(00)86238-5.
- ↑ Maaninen, Arto; Chivers, Tristram; Parvez, Masood; Pietikäinen, Jarkko; Laitinen, Risto S. (1999). „Syntheses of THF Solutions of SeX2(X = Cl, Br) and a New Route to Selenium Sulfides SenS8−n(n = 1−5): X-ray Crystal Structures of SeCl2(tht)2 and SeCl2·tmtu“. Inorganic Chemistry. 38 (18): 4093–4097. doi:10.1021/ic981430h.