Наследна хеморагична телеангиектазија
Наследна хеморагична телеангиектазија ( HHT ), исто така позната како Ослер-Вебер-Ренду болест и Ослер-Вебер-Ренду синдром, била ретко автосомно доминантно генетско нарушување што доведувало до абнормално формирање на крвните садови во кожата, мукозните мембрани и често во органите како што се белите дробови, црниот дроб и мозокот.
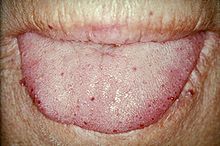
Тоа можело да доведе до крварење од носот, акутно и хронично крварење од дигестивниот тракт и разни проблеми поради зафаќање на други органи. Третманот се фокусирал на намалување на крварењето од лезии на крвните садови, а понекогаш и на операција или други насочени интервенции за отстранување на артериовенските малформации во органите. За хроничното крварење често биле потребни додатоци на железо, а понекогаш и трансфузија на крв. HHT се пренесувал на автосомно доминантен начин и се јавувал кај еден од 5.000-8.000 луѓе во Северна Америка.
Болеста ги носела имињата на Сер Вилијам Ослер, Анри Жил Луис Мари Ренду и Фредерик Паркс Вебер, кои ја опишале кон крајот на 19 и почетокот на 20 век.
Знаци и симптоми
уредиТелеангиектазии
уредиТелеангиектазија (мали васкуларни малформации) можела да се појави во кожата и мукозните обвивки на носот и гастроинтестиналниот тракт. Најчест проблем бил крварењето од носот (епистакса), кое се случувало често од детството и влијаело на околу 90-95% од луѓето со ХХТ. Лезиите на кожата и во устата крвареле поретко, но се сметале за козметички непријатни; тие зафаќале околу 80%. Кожните лезии карактеристично се јавувале на усните, носот и прстите и на кожата на лицето во областите изложени на сонце. Тие се појавувале одеднаш, а бројот се зголемувал со текот на времето.
Околу 20% биле погодени од симптоматски лезии на дигестивниот тракт, иако поголем процент имале лезии кои не предизвикувале симптоми. Овие лезии можеле наизменично да крварат, што ретко е доволно значајно за да се забележи (во форма на крваво повраќање или црна столица ), но на крајот можело да се доведе до трошење на железото во телото, што резултирал со анемија со дефицит на железо.
Артериовенска малформација
уредиАртериовенски малформации (AVM, поголеми васкуларни малформации) се јавувале кај поголемите органи, претежно белите дробови ( пулмонални AVM ) (50%), црниот дроб (30-70%) и мозокот ( церебрални AVMs, 10%), со многу мал дел ( <1%) од AVM во ’рбетниот мозок.
Васкуларни малформации во белите дробови можеле да предизвикаат голем број проблеми. Белите дробови вообичаено ги „филтрирале“ бактериите и згрутчувањето на крвта од крвотокот; AVM ја заобиколувале капиларната мрежа на белите дробови и им дозволувале на нив да мигрираат во мозокот, каде бактериите можеле да предизвикаат мозочен апсцес, а згрутчувањето на крвта можело да доведе до мозочен удар. HHT била најчеста причина за AVM на белите дробови: од сите луѓе за кои е откриено дека имале белодробни AVM, 70-80% се должат на HHT. Крварењето од белодробните AVM било релативно невообичаено, но можело да предизвика хемоптиза (кашлање крв) или хемоторакс (крв што се акумулира во градната празнина). Големите васкуларни малформации во белите дробови овозможувале крвта осиромашена со кислород од десната комора да ги заобиколи алвеолите, што значи дека оваа крв немала можност да апсорбира свеж кислород. Ова можело да доведе до останување без здив. Големите AVM можеле да доведат до птицечја, тешкотии во дишењето што е поизразено при седење во споредба со лежење; ова веројатно ги одразувало промените во протокот на крв поврзани со позиционирањето. Многу големи AVM предизвикувале изразена неспособност за апсорпција на кислород, што можело да се забележи со цијаноза (сина промена на бојата на усните и кожата), крцкање на ноктите (често се среќавале при хронично ниски нивоа на кислород) и бучава од зуење над погодениот дел од белите дробови што се откривале со стетоскоп.
Симптомите произведени од AVM во црниот дроб зависеле од типот на абнормална врска што ја формирале помеѓу крвните садови. Ако врската била помеѓу артериите и вените, голема количина крв ги заобиколувала органите на телото, за што срцето компензирало со зголемување на срцевиот минутен волумен . На крајот се развивала конгестивна срцева инсуфициенција („срцева инсуфициенција со висок излез“), со останување без здив и отекување на нозете меѓу другите проблеми. Ако AVM создал врска помеѓу порталната вена и крвните садови на црниот дроб, резултатот можел да биде портална хипертензија (зголемен притисок на порталната вена), во која се формирале колатерални крвни садови во хранопроводникот ( езофагеални варикси ), кои можеле да крварат насилно; дополнително, зголемениот притисок можел да доведе до акумулација на течност во абдоминалната празнина ( асцит ). Ако протокот во AVM бил во друга насока, порталната венска крв течела директно во вените наместо да тече низ црниот дроб; ова можело да доведе до хепатална енцефалопатија (конфузија поради порталните отпадни производи кои го иритираат мозокот). Ретко, жолчните канали биле лишени од крв, што доведувало до тежок холангитис (воспаление на жолчните канали). Црниот дроб AVM можел да детектира над 70% од луѓето со HHT, но само 10% имале проблеми како резултат.
Во мозокот, AVM повремено вршеле притисок, што доведувал до главоболки . Тие исто така можеле да го зголемат ризикот од напади, како и секое абнормално ткиво во мозокот. Конечно, хеморагијата од AVM можела да доведе до интрацеребрална хеморагија (крварење во мозокот), што ги предизвикувал некој од симптомите на мозочен удар, како што се слабост во дел од телото или тешкотии во говорот. Ако крварењето се појавело во субарахноидалниот простор ( субарахноидална хеморагија ), обично имало силна, ненадејна главоболка и намалено ниво на свест и често слабост на дел од телото.
Други проблеми
уредиМногу мал дел (оние кои биле погодени од SMAD4 (MADH4) мутации, видете подолу) имале повеќе бенигни полипи во дебелото црево, кои можеле да крварат или да се трансформираат во колоректален карцином . Слично мал дел доживувале пулмонална хипертензија, состојба во која притисокот во белодробните артерии бил зголемен, вршел притисок на десната страна на срцето и предизвикувал периферен едем (отекување на нозете), несвестица и напади на болка во градите . Забележано било дека ризикот од тромбоза (особено венска тромбоза, во форма на длабока венска тромбоза или белодробна емболија ) можел да се зголеми. Постои сомневање дека оние со HHT можеле да имаат блага имунодефициенција и затоа се со малку зголемен ризик од инфекции.
Генетика
уредиHHT било генетско нарушување со автосомно доминантен модел на наследување. Оние со HHT симптоми кои немале роднини со болеста можеле да имаат нова мутација.
Се препознавале пет генетски типови на HHT. Од нив, три биле поврзани со одредени гени, додека двата преостанати моментално биле поврзани само со одреден локус . Повеќе од 80% од сите случаи на HHT се должат на мутации во ENG или ACVRL1. Вкупно биле познати преку 600 различни мутации. Веројатно ќе има доминација на било кој тип во одредени популации, но податоците се спротивставени. MADH4 мутациите, кои покрај HHT предизвикувале полипоза на колонот, сочинувале околу 2% од мутациите што предизвикувале болест. Освен MADH4, не е јасно дали мутациите во ENG и ACVRL1 доведувале до одредени симптоми, иако некои извештаи сугерирале дека ENG мутациите биле со поголема веројатност да предизвикаат проблеми со белите дробови додека мутациите на ACVRL1 можеле да предизвикаат повеќе проблеми со црниот дроб, и пулмоналната хипертензија можела да биде посебен проблем кај луѓето со ACVRL1 мутации. Луѓето со потполно исти мутации можеле да имаат различна природа и сериозност на симптомите, што сугерирала дека дополнителни гени или други фактори на ризик можеле да ја одредат брзината со која се развивале лезиите; тие сè уште не се идентификувани.
| Име | ОМИМ | ген | Локус | Опис |
|---|---|---|---|---|
| HHT1 | ENG | 9 q34.1 | ENG кодови за ендоглин, рецептор на TGF-β1 ( трансформирачки фактор на раст бета 1 ) и TGF-β3 ; генетската поврзаност беше идентификувана во 1994 година. Забележан е висок процент на мутации на поместување на рамката. Практично сите мутации се случуваат во вонклеточниот дел од белковината (делот што се наоѓа на површината на клетката ). | |
| HHT2 | ACVRL1 | 12 q11-q14 | ACVRL1 шифрира за Alk-1 ( ACVR1, киназа 1 слична на рецептор на активин), рецептор TGF-β1; генетската поврзаност беше идентификувана во 1996 година. | |
| HHT3 | Непознат | 5 q31 | Функцијата непозната, поврзаноста е идентификувана во 2005 година.[1] | |
| HHT4 | Непознат | 7 стр14 . | Функцијата непозната, поврзаноста е идентификувана во 2006 година.[2] | |
| JPHT | MADH4 | 18 q21.1 | MADH4 шифрира за SMAD4, внатреклеточен сигнална белковина за рецепторите од суперсемејството TGF. Мутациите на овој ген предизвикуваат HHT и јувенилна полипоза. Поврзаноста беше идентификувана во 2004 година.[3] Мутации претежно во егзоните 8-11, често de novo (ново стекнати, ненаследни). |
Патофизиологија
уредиСе сметало дека телеангиектазиите и артериовенските малформации во HHT се јавувале поради промените во ангиогенезата, развојот на крвните садови надвор од постоечките. Развојот на нов крвен сад барал активирање и миграција на различни типови на клетки, главно ендотел, мазни мускули и перицити . Точниот механизам со кој HHT мутациите влијале на овој процес сè уште не бил јасен, и веројатно било дека тие ја нарушуваат рамнотежата помеѓу про- и антиангиогените сигнали во крвните садови. Ѕидот на телеангиектазии бил невообичаено ронлив, што ја објаснувал тенденцијата на овие лезии да крварат.
Сите гени досега познати дека се поврзани со HHT кодот за белковините во сигналниот пат на TGF-β . Ова била една од групите на белковини кои учествувала во трансдукцијата на сигналот на хормоните од суперфамилијата на трансформирачкиот фактор на раст бета (класите на трансформациониот фактор на раст бета, коскениот морфогенетска белковина и факторите за диференцијација на раст ), особено BMP9/GDF2 и BMP10 . Хормоните не влегувале во клетката, туку се поврзувале со рецепторите на клеточната мембрана,а тие потоа ги активирале другите белковини, на крајот влијаејќи на клеточното однесување на повеќе начини како што се клеточното преживување, пролиферацијата (зголемување на бројот) и диференцијација (станување поспецијализирано). За хормонскиот сигнал да биде соодветно трансдуциран, потребна била комбинација од белковини: по два од двата типа мембрански рецептори од типот на киназа специфични за серин/треонин и ендоглин. Кога се врзувале за хормонот, рецепторните белковини од тип II фосфорилирале (трансфер фосфат ) на рецепторни белковини тип I (од кои еден е и Alk-1), кои пак фосфорилирале комплекс од SMAD белковини (главно SMAD1, SMAD5 и SMAD8 ). Овие се врзувале за SMAD4 и мигрирале во клеточното јадро каде што дејствувале како фактори на транскрипција и учествувале во транскрипцијата на одредени гени. Покрај патеката SMAD, мембранските рецептори дејствувале и на патеката MAPK, која имала дополнителни дејства врз однесувањето на клетките. И Алк-1 и ендоглин се изразувале претежно во ендотелот, можеби објаснувајќи зошто мутациите кои предизвикувале HHT во овие белковини доминантно секогаш доведувале до проблеми со крвните садови. И ENG и ACVRL1 мутациите воделе најчесто до недоволно производство на поврзаните белковини, наместо неправилно функционирање на белковините.
Дијагноза
уредиДијагностички тестови можеле да се спроведат од различни причини. Прво, потребни биле некои тестови за да се потврди или побие дијагнозата. Второ, некои биле потребни за да се идентификуваат можните компликации.
Телеангиектазии
уредиТелеангиектазиите на кожата и усната шуплина биле визуелно препознатливи при физичкиот преглед, а на сличен начин лезиите во носот можеле да се видат при ендоскопија на назофаринксот или на ларингоскопија . Тежината на крвавењето од носот можела објективно да се квантифицира со помош на прашалник сличен на мрежа во кој се евидентирале бројот на епизоди на крварење од носот и нивното времетраење.
Телеангиектазии на дигестивниот тракт можеле да се идентификуваат при езофагогастродуоденоскопија (ендоскопија на хранопроводникот, желудникот и првиот дел од тенкото црево). Оваа процедура обично ќе се спровела само ако имала анемија која е поизразена од очекуваното од сериозноста на крварењето од носот, или ако имала докази за тешко крварење (повраќање крв, црна столица). Ако бројот на лезии забележани на ендоскопија бил неочекувано низок, остатокот од тенкото црево можело да се испита со капсулна ендоскопија, во која пациентот голтал уред во облик на капсула кој содржела минијатурна камера која пренесувала слики од дигестивниот тракт на пренослив дигитален рекордер.
Артериовенски малформации
уредиИдентификацијата на AVM барала детално медицинско снимање на органите кои најчесто биле погодени од овие лезии. Не сите AVM предизвикувале симптоми или биле изложени на ризик да го сторат тоа, и оттука постоел одреден степен на варијација помеѓу специјалистите за тоа дали таквите испитувања ќе се вршат и со кој модалитет; често, одлуките за ова прашање се донесувале заедно со пациентот.
АВМ на белите дробови можеле да се приметат поради абнормален изглед на белите дробови на рендген на граден кош, или хипоксија (ниски нивоа на кислород) при пулсна оксиметрија или одредување на гасови во артериската крв . Ехокардиографијата со контраст со меурчиња (ехо со меурчиња) можела да се користи како алатка за скрининг за да се идентификувале абнормални врски помеѓу белодробните артерии и вените . Ова вклучувало инјектирање на вознемирен физиолошки раствор во вена, проследено со снимање на срцето базирано на ултразвук. Нормално, белите дробови ги отстранувале малите воздушни меури од циркулацијата и затоа се гледаат само во десната преткомора и десната комора . Ако бил присутен AVM, меурчињата се појавувале во левата преткомора и левата комора, обично 3-10 срцеви циклуси по десната страна; ова е побавно отколку кај срцевите мани, кај кои има директни врски помеѓу десната и левата страна на срцето. Поголем број на меурчиња било поверојатно да укаже на присуство на AVM. Ехото на меурчиња не било совршена алатка за скрининг бидејќи можело да пропушти помали AVM и не ја идентификувало локацијата на AVM. Често се користела компјутерска томографија со зголемена контраст (КТ ангиографија) за да се идентификувале белодробните лезии; овој модалитет имал чувствителност од над 90%. Можеби било можно да се изостави администрацијата на контраст на современите КТ скенери. Ехокардиографијата исто така се користела ако постоело сомневање за пулмонална хипертензија или срцева слабост со висок излез поради големи лезии на црниот дроб, понекогаш проследена со срцева катетеризација за мерење на притисоците во различните комори на срцето.
Генетско тестирање
уредиДостапни се генетски тестови за мутациите ENG, ACVRL1 и MADH4 . Тестирањето не било секогаш потребно за дијагноза, бидејќи симптомите биле доволни за да се разликува болеста од другите дијагнози. Постојат ситуации во кои тестирањето може да биде особено корисно. Прво, децата и младите возрасни со родител со дефинитивен HHT можеле да имаат ограничени симптоми, но сепак да бидат изложени на ризик од некои од компликациите споменати погоре; ако мутацијата била позната кај засегнатиот родител, отсуството на оваа мутација кај детето би ја спречило потребата од скрининг тестови. Понатаму, генетското тестирање можелода ја потврди дијагнозата кај оние со ограничени симптоми кои инаку би биле означени како „можен HHT“ (види подолу).
Мутациите во генот MADH4 обично биле поврзани со јувенилна полипоза, а откривањето на таква мутација би укажало на потребата да се направи скрининг на пациентот и засегнатите роднини за полипи и тумори на дебелото црево.
Критериуми
уредиИ покрај ознаката „можно“, некој со висцерална AVM и семејна историја, но без крварење од носот или телеангиектазии, сè уште е исклучително веројатно да има HHT, бидејќи овие AVM се многу невообичаени кај општата популација. Во исто време, истото не може да се каже за крварење од носот и ретки телеангиектазии, кои се јавуваат кај луѓе без HHT, во отсуство на AVM. Нечиј дијагностички статус може да се промени во текот на животот, бидејќи малите деца можеби сè уште не ги покажуваат сите симптоми; на 16-годишна возраст, тринаесет проценти се сè уште неодредени, додека на 60-годишна возраст огромното мнозинство (99%) имаат дефинитивна дијагностичка класификација. Затоа, децата на воспоставените пациенти со ХХТ може да бидат означени како „можни ХХТ“, бидејќи 50% може да испадне дека имаат ХХТ во текот на нивниот живот.
- ↑ „A new locus for hereditary haemorrhagic telangiectasia (HHT3) maps to chromosome 5“. Journal of Medical Genetics. 42 (7): 577–82. 2005. doi:10.1136/jmg.2004.028712. PMC 1736109. PMID 15994879.
- ↑ „A fourth locus for hereditary hemorrhagic telangiectasia maps to chromosome 7“. American Journal of Medical Genetics. 140 (20): 2155–62. 2006. doi:10.1002/ajmg.a.31450. PMID 16969873.
- ↑ „A combined syndrome of juvenile polyposis and hereditary haemorrhagic telangiectasia associated with mutations in MADH4 (SMAD4)“. Lancet. 363 (9412): 852–9. March 2004. doi:10.1016/S0140-6736(04)15732-2. PMID 15031030.