Естер
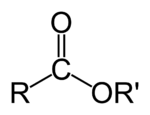
Естри — органски соединенија кои всушност претставуваат функционални деривати на карбоксилните киселини. Функционална група на естрите е ацил групата поврзана со алкоkси (-OR) или фенокси (-OAr) група. Естрите се добиваат при т.н. реакција на естерификација во која од алкохол и киселина се добива естер и вода. Естрите влегуваат во составот на многу природни производи; тие го даваат мирисот на повеќето зеленчуци, овошја и цвеќиња.
Именување
уредиПотекло на поимот
уредиЗборот естер за првпат го вовел хемичарот Леополд Гмелин во 1848 година.
IUPAC номенклатура на естри
уредиСпоред МСЧПХ (IUPAC), за да се именува еден естер, најпрво се пишува името на алкил групата поврзана со кислород (-OR или -OAr). Ацил делот од естерот се изведува од карбоксилна киселина и добива име како карбоксилат. Алкил делот од секоја молекула се прикажува од десната страна на структурата. Во името на естерот прво се пишува алкил името без оглед на тоа како е нацртана структурата. Така на пример:
Некои естри имаат вообичаени (тривијални) имиња. Ова особено се однесува на естрите изведени од оцетната киселина и мравската киселина:
Физички својства
уредиТочка на вриење и растворливост
уредиЕстрите се поларни молекули, но нивните точки на вриење се пониски од оние на карбоксилните киселини и алкохолите со слична молекулска маса, бидејќи кај молекулите на естрите не е можно меѓумолекулско поврзување со водородни врски.
Естрите можат да образуваат водородни врски преку нивните кислородни атоми со водородните атоми од молекулите на водата. Така, естрите се слабо растворливи во вода. Меѓутоа, бидејќи естрите немаат водороден атом за да образуваат водородна врска со еден кислороден атом од водата, тие се помалку растворливи од карбоксилните киселини.
Мирис на естрите
уредиМирисите на естрите се значително поразлични од оние на соодветните карбоксилни киселини од кои се добиени. Киселините имаат непријатен мирис, додека естрите имаат овошни мириси. Всушност, мирисите на многу овошја се должат на естрите. На пример, етил етаноат се наоѓа во ананасот, 3-метилбутил етаноат во јаболките и бананите, а октил ацетат во портокалите. Меѓутоа, бидејќи естрите имаат ниски точки на вриење, мирисот на овошјата при загревање или топлинска обработка се губи.
Естрите во состав на мастите и маслата
уредиМастите и маслата се сложени смеси од повеќе соединенија во чиј состав преовладуваат естрите на глицеролот со вишите масни киселини наречени глицериди.
Бидејќи глицеролот има три хидроксилни групи, естерификацијата може да настане на една -OH група, при што се добива моноглицерид, на две триглицерид и на три триглицерид.
Добивање
уредиЕстрите се добиваат меѓу другото со реакција на естерификација. Таа се одвива во два чекори. Во првиот се претвора во ацил хлорид, додека во вториот ацил хлоридот реагира со алкохол и дава естер. Меѓутоа, карбоксилните киселини директно се претвораат во естри преку т.н. Фишерова реакција на естерификација. Оваа реакција е пример за реакција на кондензација; таа бара здружување на два реактанти во еден поголем продукт со истовремено образување на втор помал производ (како вода). Една карбоксилна киселина реагира со алкохол во реакција на кондензација и дава естер и вода. Така, естерот содржи дел и од алкохолот и од киселината. Во општата реакција подолу, H — O — A е киселина (неорганска или органска). За една органска киселина, A претставува ацил група:
- A-O-H + H-O-R → A-O-R + H2O
каде A-O-H е киселина, H-O-R е алкохол, а производот е естер. Притоа, водата се одвојува од OH групата на киселината и водородниот атом од OH групата на алкохолот. Естрите во ваква реакција можат да се создаваат од многу различни киселини.