Бизмут трифлуорид
Бизмут(III) флуорид или бизмут трифлуорид — хемиско соединение од бизмут и флуор. Хемиската формула е BiF3. Станува збор за сиво-бел прашок кој се топи на 649 °C. Се јавува во природата како редок минерал гананит.
| |
Назив според МСЧПХ Бизмут(III) флуорид | |
Други називи Бизмут трифлуорид | |
| Назнаки | |
|---|---|
| 7787-61-3 | |
| ChemSpider | 21172751 |
| EC-број | 232-124-8 |
| |
| 3Д-модел (Jmol) | Слика |
| PubChem | 82233 |
| |
| UNII | 6I46O71A7B |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | сиво-бел прав |
| Густина | 5,32 g cm−3[1] |
| Точка на топење | |
| Нерастворлив во вода[1] | |
| -61,0·10−6 cm3/mol | |
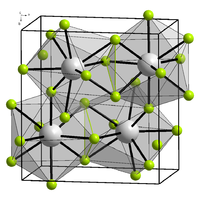
| Структура | |
| Кристална структура | Орторомбична, oP16, SpaceGroup = Pnma, No. 62 (β phase) |
| Опасност | |
| Безбедност при работа: | |
Главни опасности
|
Раздразнувач |
| GHS-ознаки: | |
Пиктограми
|

|
Сигнални зборови
|
Опасност |
Изјави за опасност
|
H314 |
Изјави за претпазливост
|
P260, P264, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P363, P405, P501 |
| NFPA 704 | |
| Слични супстанци | |
| Други анјони | Бизмут хлорид |
| Други катјони | |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Синтеза
уредиБизмут флуоридот може да се подготви со реакција на бизмут(III) оксид со флуороводородна киселина:[2]
- Bi2O3 + 6 HF → 2 BiF3 + 3 H2O
Структура
уредиα-BiF3 има кубна кристална структура (Пирсон симбол cF16, просторна група Fm-3m, бр. 225). BiF3 е прототип за структурата D03, која е усвоена од неколку интерметали, вклучувајќи Mg3Pr, Cu3Sb, Fe3Si и AlFe3,[3] како и од хидридот LaH3.0.[4] Бизмут(III) флуоридот има централна кубична форма со Bi во центрите и темињата и F на октаедралното место (средините рабови, центар) и тетраедарските места (центрите на 8-те подкоцки) - на тој начин содржи 4 Bi и 12 F.[5] Алтернативно, со поместена единечна ќелија (1/4,1/4,1/4), описот може да биде на fcc ќелија со лице, раб, агол и центри исполнети со F, и половина (4 од) октантните центри со F, другата половина со Bi (секој октант тип тетраедрално распореден).[4] Должината на рабовите на ќелијата BiF3 е 0,5853 nm.[4]
β-BiF3 има YF3 структура каде што атомот на бизмутот има искривена 9та координација, тригонална призма.[6] Оваа структура генерално се смета за јонска и е во контраст со флуоридите на полесните членови од групата 15, фосфор трифлуорид, PF3, арсен трифлуорид, AsF3 и антимон трифлуорид, SbF3, каде што MX3 молекуларни единици се присутни во цврстото тело.[7]
Реакции
уредиBiF3 не влегува во реакција со водата и е речиси нерастворлив. Не формира комплекси лесно, но следниве BiF3.3HF и BiF4- во NH4BiF 4, се познати. Додатното соединение H3BiF6 се хидролизира со вода што формира BiOF.[8]
Употреба
уредиBiF3 доби истражувачко внимание како можен електроден материјал за литиумски батерии и како луминисцентен домаќин материјал за фосфори допингуван со лантан.[9]
Наводи
уреди- ↑ 1,0 1,1 http://www.alfa.com/content/msds/english/11844.pdf [мртва врска]
- ↑ 2,0 2,1 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. изд.). Butterworth-Heinemann. ISBN 0080379419.
- ↑ De Graef, Marc; McHenry, Michael (уред.), „Appendix 1. Crystal Structure Descriptions“, The Structure of Materials, Cambridge University Press, A1-2, A1-11
- ↑ 4,0 4,1 4,2 Galasso, Francis S. (1970), Structure and Properties of Inorganic Solids: International Series of Monographs in Solid State Physics, Pergammon Press, 3.5. BiF3, DO3, Fm3m, Cubic. pp. 50–51
- ↑ Sólyom, Jenö (2007), Fundamentals of the Physics of Solids: Volume 1: Structure and Dynamics, стр. 220, ISBN 978-3-540-72599-2
- ↑ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ↑ name = "Wells"
- ↑ Norman, Nicholas C (1998). Chemistry of arsenic, antimony, and bismuth. стр. 88. ISBN 978-0-7514-0389-3.
- ↑ Xie, Zhi; Wei, Bin; Wang, Zhongchang (2018-06-01). „Structural stability, electronic structures and enhanced photocatalytic properties of BiF3 nanowires: A first-principles study“. Ceramics International (англиски). 44 (8): 9623–9632. doi:10.1016/j.ceramint.2018.02.189. ISSN 0272-8842. S2CID 139879224.
