Нитрилотриоцетна киселина
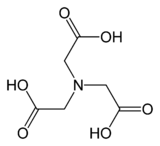
Нитрилотриоцетна киселина (NTA) е аминополикарбоксилна киселина со хемиска формула N(CH 2CO2H)3. Претставува безбоен солид и се користи како хелатен агенс кој формира соединенија со метални јони (хелати) како што се Ca 2+, Co 2+, Cu 2+ и Fe 3+.[3]
| |
Други називи N,N-Бис(карбоксиметил)глицин | |
| Назнаки | |
|---|---|
| 139-13-9 (слободна киселина) 5064-31-3 | |
| Бајлштајн | 1710776 |
| ChEBI | CHEBI:44557 |
| ChemSpider | 8428 |
| DrugBank | DB03040 |
| EC-број | 205-355-7 |
| 3726 | |
| 3Д-модел (Jmol) | Слика |
| KEGG | C14695 |
| MeSH | киселина Нитрилотриоцетна киселина |
| PubChem | 8758 |
| RTECS-бр. | AJ0175000 |
| |
| UNII | KA90006V9D E3C8R2M0XD |
| ОН-бр. | 2811 |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | Бели кристали |
| Точка на топење | |
| Нерастворлива. <0.01 g/100 mL at 23℃ [2] | |
| Термохемија | |
| Ст. енталпија на образување ΔfH |
−1.3130–−1.3108 MJ mol−1 |
| Опасност | |
| GHS-ознаки: | |
Пиктограми
|
 
|
Сигнални зборови
|
Предупредување |
Изјави за опасност
|
H302, H319, H351 |
Изјави за претпазливост
|
P281, P305+P351+P338 |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Производство и употреба
уредиНитрилотриоцетната киселина е комерцијално достапна како слободна киселина и како натриумова сол. Се произведува од амонијак, формалдехид и натриум цијанид или цијановодород. Се проценува дека нејзиното производство е 100 илјади тони годишно. NTA исто така се добива и како нечистотија во синтезата на EDTA.[4] Постарите патишта за добивање на NTA вклучуваат алкилација на амонијак со хлорооцетна киселина и оксидација на триетаноламин.
Координативна хемија и апликации
уредиNTA е триподен тетрадентатен трианионски лиганд.[5]
Употребите на NTA се слични на оние на EDTA, бидејќи и двете се хелатни агенси. Се користи за омекнување на водата и како замена за натриум и калиум трифосфат во детергенти и средства за чистење.
NTA како хелатен агенс ги отстранува Cr, Cu и As од дрва кое се обработени со хромиран бакарен арсенат.[6]
Токсичност и животна средина
уредиНитрилоцетна киселина може да предизвика иритација на очите, кожата и респираторниот тракт; и може да предизвика оштетување на бубрезите и мочниот меур. Соединението се очекува да има потенцијал да предизвика рак кај луѓето.
За разлика од EDTA, NTA е лесно биоразградлив и речиси целосно се отстранува за време на третманот на отпадните води. Влијанијата на НТА врз животната средина се минимални. И покрај широката употреба во производите за чистење, концентрацијата во снабдувањето со вода е премногу ниска за да има значително влијание врз здравјето на луѓето или квалитетот на животната средина.[7]
Наводи
уреди- ↑ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. стр. 21, 679. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ↑ 2,0 2,1 2,2 ChemBK Chemical Database http://www.chembk.com/en/chem/Nitrilotriacetic%20acid
- ↑ Nitrilotriacetic Acid and Its Salts, International Agency for Research on Cancer
- ↑ Hart, J. Roger (2005) "Ethylenediaminetetraacetic Acid and Related Chelating Agents" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. doi:10.1002/14356007.a10_095
- ↑ B. L. Barnett, V. A. Uchtman (1979). „Structural Investigations of Calcium-Binding Molecules. 4. Calcium Binding to Aminocarboxylates. Crystal Structures of Ca(CaEDTA).7H2O and Na(CaNTA)“. Inorg. Chem. 18 (10): 2674–2678. doi:10.1021/ic50200a007.
- ↑ Fang-Chih, C.; Ya-Nang, W.; Pin-Jui, C.; Chun-Han, K. Factors affecting chelating extraction of Cr, Cu, and As from CCA-treated wood.
- ↑ Brouwer, N.; Terpstra, P. Ecological and Toxicological Properties of Nitrilotriacetic Acid (NTA) as a Detergent Builder.