Ниобиум пентоксид
Ниобиум пентоксид — неорганско соединение со хемиска формула Nb2O5. Безбоен, нерастворлив и прилично нереактивна и цврст, тој е најраспространетиот прекурсор за други соединенија и материјали што содржат ниобиум. Претежно се користи во легирање и други специјализирани употреби во кондензаторите, оптичките очила и производство на литиум ниобат.[1]
| |
Назив според МСЧПХ Niobium(V) oxide | |
Други називи Niobium pentoxide | |
| Назнаки | |
|---|---|
| 1313-96-8 | |
| 3Д-модел (Jmol) | Слика |
| PubChem | 123105 |
| |
| UNII | K9343U17IN |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | white orthogonal solid |
| Густина | 4.60 g/cm3 |
| Точка на топење | |
| insoluble | |
| Растворливост | soluble in HF |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Структура
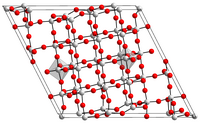
уредиИма многу полиморфни форми, сите главно базирани на октаедрално координирани атоми на ниобиум.[2][3] Полиморфите се идентификуваат со различни префикси.[2][3] TФормата што најчесто се среќава е моноклиничен H-Nb2O5, која има сложена структура со единечна ќелија која содржи 28 атоми на ниобиум и 70 кислород, каде што 27 од атомите на ниобиум се октаедрално координирани и еден тетраедарски.[4] Има необележан цврст хидрат, Nb
2O
5 · nH
2O, таканаречената ниобна киселина (претходно наречена колумбинска киселина), која може да се подготви со хидролиза на базен раствор на ниобиум пентахлорид или Nb2O5 растворен во HF.[5]
Стопениот ниобиум пентооксид има помали средни координативни броеви од кристалните форми, со структура која главно се состои од полиедри на NbO5 и NbO6.[6]
Производство
уредиХидролиза
уредиNb2O5 се подготвува со хидролиза на алкално-метални ниобати, алкоксиди или флуориди со користење на база. Ваквите навидум едноставни процедури овозможуваат хидрирани оксиди кои потоа може да се калцинираат. Чистиот Nb2O5 може да се подготви и со хидролиза на NbCl5:[7]
- 2 NbCl5 + 5 H2O → Nb2O5 + 10 HCl
Пријавен е метод на производство преку техники на сол-гел со хидролизирање на ниобиум алкоксиди во присуство на оцетна киселина, проследено со калцинирање на геловите за да се добие ортохомбична форма,[2] T-Nb2O5.[8]
Оксидација
уредиИмајќи предвид дека Nb2O5 најзастапеното и најцврстото соединение на ниобиумот, постојат многу методи, и практични и езотерични, за неговото формирање. Оксидот на пример, настанува кога ниобиум металот се оксидира во воздухот.[9] Оксидацијата на ниобиум диоксид, NbO2 во воздухот го формира полиморфот, L-Nb2O5.[10]
Честичките на ниобиум пентооксид со нано големина се синтетизирани со редукција на NbCl со LiH 5, проследено со воздушна оксидација како дел од синтезата на нано структурирани ниобати.[се бара извор]
Реакции
уредиNb2O5 е нападнат од HF и се раствора во соединети алкали.[5][9]
Редукција до металот
уредиКонверзијата на Nb2O5 е главниот пат за индустриско производство на ниобиум метал. Во 1980-тите, околу 15.000.000 kg Nb2O5 се трошеле годишно за редукција до метал.[11] Главниот метод е редукција на овој оксид со алуминиум:
- 3 Nb2O5 + 10 Al → 6 Nb + 5 Al2O3
Алтернативен, но помалку практикуван пат вклучува карботермална редукција, која се одвива преку редукција со јаглерод и ја формира основата на двостепениот Балке процес:[12][13]
- Nb2O5 + 7 C → 2 NbC + 5 CO (се загрева под вакуум на 1800 °C)
- 5 NbC + Nb2O5 → 7 Nb + 5 CO
Конверзија во халиди
уредиПознати се многу методи за конверзија наNb2O5 во халиди. Главниот проблем е нецелосната реакција за давање на оксихалиди. Во лабораторија, конверзијата може да се изврши со тионил хлорид:[14]
- Nb2O5 + 5 SOCl2 → 2 NbCl5 + 5 SO2
Nb2O5 реагира со CCl4 и дава ниобиум оксихлорид NbOCl3.
Конверзија во ниобати
уредиТретирањето на Nb2O5 wсо воден NaOH на 200 °C може да даде кристален натриум ниобат, NaNbO3 додека реакцијата со KOH може да даде растворливи хексаниобат од типот Lindqvist, Nb6O8−
19.[15] Литиум ниобатите како LiNbO3 and Li3NbO4 може да се подготват со реакција на литиум карбонат и Nb2O5.[16][17]
Конверзија во редуцирани ниобиум оксиди
уредиВисоката редукција на температурата со H2 дава NbO2:[9]
- Nb2O5 + H2 → 2 NbO2 + H2O
Ниобиум моноксидот произлегува од компропорција со користење на лачна печка:[18]
- Nb2O5 + 3Nb → 5 NbO
Ниобиум(III) оксидот со боја на бургунд, еден од првите суперспроводливи оксиди, може повторно да се подготви со компропорција:[17]
- Li3NbO4 + 2 NbO → 3 LiNbO2
Употреба
уредиНиобиум пентооксидот се користи главно во производството на ниобиум метал,[11] но постојат специјализирани апликации во производството на оптички очила и литиум ниобат.[1]
Тенките филмови од Nb2O5 ги формираат диелектричните слоеви во ниобиумските електролитски кондензатори.
Nb2O5 се смета за употреба како анода во литиум-јонска батерија, имајќи предвид дека нивната подредена кристална структура овозможува брзини на полнење од 225 mAh g−1 при 200 mA g−1 низ 400 циклуси, со кулумбиска ефикасност од 99.93%.[19]
Надворешни врски
уредиНаводи
уреди- ↑ 1,0 1,1 Francois Cardarelli (2008) Materials Handbook Springer London ISBN 978-1-84628-668-1
- ↑ 2,0 2,1 2,2 C. Nico; и др. (2011). „Sintered NbO powders for electronic device applications“. The Journal of Physical Chemistry C. 115 (11): 4879–4886. doi:10.1021/jp110672u.
- ↑ 3,0 3,1 Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ↑ Gatehouse, B. M.; Wadsley, A. D. (1964-12-01). „The crystal structure of the high temperature form of niobium pentoxide“. Acta Crystallographica. International Union of Crystallography (IUCr). 17 (12): 1545–1554. doi:10.1107/s0365110x6400384x. ISSN 0365-110X.
- ↑ 5,0 5,1 D.A. Bayot and M.M. Devillers, Precursors routes for the preparation of Nb based multimetallic oxides in Progress in Solid State Chemistry Research, Arte M. Newman, Ronald W. Buckley, (2007),Nova Publishers, ISBN 1-60021-313-8
- ↑ Alderman, O. L. G. Benmore, C. J. Neuefeind, J. C. Coillet, E Mermet, Alain Martinez, V. Tamalonis, A. Weber, J. K. R. (2018). „Amorphous tantala and its relationship with the molten state“. Physical Review Materials. 2 (4): 043602. Bibcode:2018PhRvM...2d3602A. doi:10.1103/PhysRevMaterials.2.043602.CS1-одржување: повеќе имиња: список на автори (link)
- ↑ Process for the manufacture of niobium pentoxide or tantalum pentoxide, Kern, Therwil, Jacob, Hooper (CIBA Switzerland), US Patent number: 3133788, (1964)
- ↑ Griesmar, P.; Papin, G.; Sanchez, C.; Livage, J. (1991). „Sol-gel route to niobium pentoxide“. Chemistry of Materials. American Chemical Society (ACS). 3 (2): 335–339. doi:10.1021/cm00014a026. ISSN 0897-4756.
- ↑ 9,0 9,1 9,2 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. изд.). Butterworth-Heinemann. ISBN 0080379419.
- ↑ Vezzoli, G. C. (1982-10-01). „Electrical properties of NbO2andNb2O5at elevated temperature in air and flowing argon“. Physical Review B. American Physical Society (APS). 26 (7): 3954–3957. Bibcode:1982PhRvB..26.3954V. doi:10.1103/physrevb.26.3954. ISSN 0163-1829.
- ↑ 11,0 11,1 Albrecht, Sven; Cymorek, Christian; Eckert, Joachim (2011), Ullmann's Encyclopedia of Industrial Chemistry: Niobium and Niobium Compounds, Weinheim: Wiley-VCH, doi:10.1002/14356007.a17_251.pub2
- ↑ Alan E. Comyns (1999) Encyclopedic Dictionary of Named Processes in Chemical Technology CRC Press, ISBN 0-8493-1205-1
- ↑ U.S. Environmental Protection Agency, Development Document for Effluent Limitations, Guidelines and Standards for the Nonferrous Metals Manufacturing Point Source Category, Volume VIII, Office of Water Regulations and Standards, May 1989
- ↑ Brown, D. (1967). „Niobium(V) Chloride and Hexachloroniobates(V)“. Inorganic Syntheses. 9. стр. 88–92. doi:10.1002/9780470132401.ch24. ISBN 978-0-470-13168-8.
- ↑ Santos, I.C.M.S.; Loureiro, L.H.; Silva, M.F.P.; Cavaleiro, Ana M.V. (2002). „Studies on the hydrothermal synthesis of niobium oxides“. Polyhedron. Elsevier BV. 21 (20): 2009–2015. doi:10.1016/s0277-5387(02)01136-1. ISSN 0277-5387.
- ↑ US Patent 5482001 - Process for producing lithium niobate single crystal,1996, Katoono T., Tominaga H.,
- ↑ 17,0 17,1 Geselbracht, Margret J.; Stacy, Angelica M.; Rosseinsky, Matthew (2007-01-05). „Lithium Niobium Oxide: LiNbO2 and Superconducting LixNbO2“. Inorganic Syntheses. 30. Hoboken, NJ, USA: John Wiley & Sons, Inc. стр. 222–226. doi:10.1002/9780470132616.ch42. ISBN 9780470132616. ISSN 1934-4716.
- ↑ Reed, T. B.; Pollard, E. R.; Lonney, L. E.; Loehman, R. E.; Honig, J. M. (2007-01-05). „Niobium Monoxide“. Inorganic Syntheses. 30. Hoboken, NJ, USA: John Wiley & Sons, Inc. стр. 108–110. doi:10.1002/9780470132616.ch22. ISBN 9780470132616. ISSN 1934-4716.
- ↑ Lavars, Nick (2022-09-09). „Battery electrode transforms during use for faster charging“. New Atlas (англиски). Посетено на 2022-09-10.