Гнездо (белковински структурен мотив)
Гнездото е вид на белковински структурен мотив, а има функција на врзување на анјони, и кај белковините и кај пептидите.[1][2][3][4][5][6][7][8][9] Тоа е изградено од атомите на ’рбетот на полипептидниот синџир на три последователни аминокиселински остатоци. Во врзувањето на анјонот учествуваат NH групите на ’рбетот на полипептидниот синџир, а страничните ланци на аминокиселинските остатоци најчесто не се вклучени во врзувањето. Бидејќи пролинските остатоци немаат NH групи, тие ретко се јавуваат во гнездата. Во просек, околу еден од дванаесет аминокиселински остатоци кај белковините , учествува во градење на гнездо.
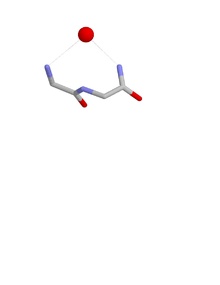
Конформации
уредиКонформацијата на гнездото е таква што NH групите на првиот и третиот аминокиселински остаток можат водородно да врзат негативно наелектризиран, или делумно негативно наелектризиран, атом, кој често е атом на кислород. Амино (NH) групата на вториот аминокиселински остаток може, исто така, да биде водородно врзана за истиот негативен атом, но обично е насочена во друг правец. Овие атоми од ’рбетот на полипептидниот синџир формираат конкавна формација (вдлабнатина), наречена гнездо, во кое се вклопува анјонскиот атом. Анјонските атоми, пак, понекогаш се нарекуваат јајца, а во гнездото може да биде врзано повеќе од едно „јајце“. Оксианјонската дупка на серинските протеази е функционален пример за гнездо. Кај антибиотскиот пептид ванкомицин, исто така, има гнездо на дното од една длабока вдлабнатина во тридимензионалната структура на пептидот. Ова гнездо служи за врзување на клучна карбоксилна група во ензимот, кој учествува во крајната фаза на синтезата на пептидогликанот од бактерискиот клеточен ѕид, а со тоа спречува делба на бактериската клетка.
Гнездата се дефинирани според конформацијата на атомите на ’рбетот на полипептидниот синџир, имено според вредностите на phi и psi диедарските агли на првите две аминокиселини во гнездото. За типично (RL) гнездо phii=-90°; psii=0°; phii+1=80°; psii+1=20°.
Гнездата варираат во нивниот степен на конкавност. Кај некои гнезда конкавноста потполно е изгубена, а пептидите кои ги содржат често врзуваат катјони со нивните C=O групи, наместо анјони со NH групите. Филтерот на калиумскиот канал[10] и водениот канал на аквапорините поседуваат ваква линеарна конформација на нивните гнезда, каде карбонилните групи се тие кои учествуваат во транспортот на молекулите низ мембраната. Ваквата скоро-линеарна конформација, исто така, се наоѓа во нишката на алфа-плочата.[11][12][13]
Збирни гнезда
уредиАко две гнезда се преклопуваат, така што се остатокот i+1 на првото гнездо е остатокот i на второто гнездо, се формира т.н. збирно гнездо. Ова гнездо има четири NH групи наместо три. Ако три гнезда се преклопуваат, така што остатоците i+1 и i+2 на првото гнездо се остатокот i на второто и третото гнездо, се формира пошироко збирно гнездо со пет NH групи, и така натаму. Атомите од ’рбетот на полипептидниот синџир формираат дел од некомплетен прстен, каде NH групи се насочени кон центарот на прстенот. Бидејќи нивната конкавност е поширока од онаа кај едноставните гнезда, збирните гнезда најчесто имаат улога на врзување на поголеми анјонски групи, како што се фосфати (кај Вокеровите мотиви) и железно-сулфурни кластери. Било покажано дека синтетизираниот пептид Ser-Gly-Ala-Gly-Lys-Thr, може силно да врзе неоргански фосфат при неутрално pH, слично како Вокеровиот А мотив или P-петелката.[14]
Типови на гнезда
уредиЕдноставните гнезда се од два типа, наречени RL и LR, во зависност од знакот на phi аглите на првите два аминокиселински остатока од гнездото. R аминокиселинските остатоци имаат негативни phi вредности (како кај десногирите алфа-завојници), а L остатоците имаат позитивни phi вредности (како кај левогирите алфа-завојницаи). Осумдесет проценти од гнездата се RL, а 20% се LR. Кога две гнезда се преклопуваат, тие може да бидат RLR или LRL. Кога три гнезда се преклопуваат, тие може да бидат RLRL или LRLR, и така натаму.
Шелмановата петелка вклучува RL гнездо во последните три од нејзините шест аминокиселински остатоци. Гнездото врзува карбонилни кислородни атоми кои му претходат во аминокиселинската низа.
Голем број на антитела имаат RLR гнезда во шнолните петелки на регионите за одредување на комплементарност (анг. CDRs, Complementarity-determining regions) на нивниот H-синџир, кои се врзани за карбоксилен страничен ланец. По пат на биоинженерство тие биле променети за да продуцираат моноклонални антитела, кои содржат гнезда специфични за белковини со фосфолирирани серини и треонини.[15]
Повеќето PDZ домени имаат RL гнездо на почетокот на првата бета-нишка, кое има функција да ја препознае карбоксилната група на C-терминалот на доменскиот пептид или на белковински лиганд.[16]
Наводи
уреди- ↑ Watson, JD; Milner-White (2002). „A novel main-chain anion-binding site in proteins: The nest. A particular combination of phi,psi values in successive residues gives rise to anion-binding sites that occur commonly and are found often at functionally important regions“. Journal of Molecular Biology. 315 (2): 171–182. doi:10.1006/jmbi.2001.5227. PMID 11779237.
- ↑ Pal, D; Suhnel (2002). „New principles of protein structure: nests, eggs and what next?“. Angew Chem Int Ed. 41 (24): 4663–4665. doi:10.1002/anie.200290009. PMID 12481319.
- ↑ Milner-White, EJ; Nissink (2004). „Recurring main-chain anion-binding motifs in short polypeptides: nests“. Acta Crystallographica Section D. D60: 1935–1942. doi:10.1107/s0907444904021390.
- ↑ Pajewski, R; Ferdani (2005). „Cation Dependence of Chloride Ion Complexation by Open-Chained Receptor Molecules in Chloroform Solution“. Journal of the American Chemical Society. 127 (51): 18281–18295. doi:10.1021/ja0558894. PMID 16366583.
- ↑ Berkessel, A; Koch (2006). „Asymmetric enone epoxidation by solid-phase bound peptides: further evidence for catalyst helicity and catalytic activity of individual strands“. Biopolymers. 84 (1): 90–96. doi:10.1002/bip.20413.
- ↑ Milner-White, EJ; Russell (2006). „Predicting the conformations of proteins and peptides in early evolution“. Biology Direct. 3: 3. doi:10.1186/1745-6150-3-3. PMC 2241844. PMID 18226248.
- ↑ Watson, JD; Laskowski (2005). „ProFunc: a server for predicting protein function from 3D structure“. Nucleic Acids Research. 33 (Web Server): W89–W93. doi:10.1093/nar/gki414.
- ↑ Langton, MJ; Serpell CJ; Beer PD (2016). „Anion recognition in water: Recent advances from a supramolecular and macromolecular perspective“. Angewandte Chemie International Edition. 55: 1974–1987. doi:10.1002/anie.201506589.
- ↑ Cremer, P; Flood AS; Gibb BC; Mobley DL (2018). „Collaborative routes to clarifying the murky waters of aquaeous supramolcular chemistry“. Nature Chemistry. 10: 8–16.
- ↑ Watson, JD; Milner-White (2002). „The conformations of polypeptide chains where the main-chain parts of successive residues are enantiomeric. Their occurrence in cation and anion-binding regions of proteins“. Journal of Molecular Biology. 315 (15): 183–191. doi:10.1006/jmbi.2001.5228. PMID 11779238.
- ↑ Milner-White, EJ; Watson (2006). „Amyloid formation may involve alpha- to beta sheet interconversion via peptide plane flipping“. Structure. 14 (9): 1369–1376. doi:10.1016/j.str.2006.06.016. PMID 16962968.
- ↑ Hayward, S; Milner-White (2008). „The geometry of α-sheet: Implications for its possible function as amyloid precursor in proteins“. Proteins. 71 (1): 415–425. doi:10.1002/prot.21717. PMID 17957773.
- ↑ Hayward, S; Milner-White (2011). „Simulation of the β- to α-sheet transition results in a twisted sheet for antiparallel and an α-nanotube for parallel strands: implications for amyloid formation“. Proteins. 79 (11): 3193–3207. doi:10.1002/prot.23154. PMID 21989939.
- ↑ Bianchi, A; Giorgi A; Ruzza P; Toniolo C (2013). „A synthetic hexapeptide designed to resemble a proteinaceous P-loop nest is shown to bind inorganic phosphate“. Proteins. 80: 1418–1424. doi:10.1002/prot.24038.
- ↑ Koerber, JT; Thomsen ND; Hannigan BT; DeGrado WF; Wells JA (2013). „Nature-inspired design of motif-specific antibody scaffolds“. Nature Biotechnology. 31 (10): 916–921. doi:10.1038/nbt.2672. PMC 3795957. PMID 23955275.
- ↑ Lee, H-J; Zheng JJ (2010). „PDZ Domains and their binding Partners: Strucure Specificty and Modification“. Cell Communication and Signalling. 8: 8. doi:10.1186/1478-811x-8-8.
Надворешни врски
уреди- ↑ Leader, DP; Milner-White (2009). „Motivated Proteins: A web application for studying small three-dimensional protein motifs“. BMC Bioinformatics. 10 (1): 60. doi:10.1186/1471-2105-10-60. PMC 2651126. PMID 19210785.
- ↑ Golovin, A; Henrick (2008). „MSDmotif: exploring protein sites and motifs“. BMC Bioinformatics. 9 (1): 312. doi:10.1186/1471-2105-9-312. PMC 2491636. PMID 18637174.