Валентност: Разлика помеѓу преработките
Создадена страница со: мини|лево|периоден систем мини|covalent =Вален... |
(нема разлика)
|
Преработка од 14:37, 9 декември 2013
Валентност
Поимот за валентност е еден од важните поими во хемијата. Тој во хемиската практика бил воведен во XIX век.Овој поим од денес го запазил првобитниот назив,но ја менувал својата содржина.
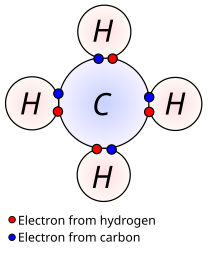
Определување на валентност според водород
Отпрвин, кога се зворувало за валентност,се мислело на:
способност на атом од некој елемент да се сврзува со определен број атоми од водород или определен број атоми од водород да заменува во некое соединение.
Така,ако атом на некој елемент може да се сврзе со еден атом од водород , велиме дека тој атом(или тој елемент) е едновалентен , односно има валентност еднаква на 1, ако може да се сврзе со два атома од водород тој е двовалентен (има валентност еднаква на 2) итн. Слично така, ако еден атом од некој елемент може да замени еден атом од водород, тој е едновалентен,ако може да замени два атома водород, се работи за двовалентен атом (или елемент) и слично.
пр:соединенија кои се состојат само од водород и од уште елемент-хлороводород,вода,амонијак и метан.
Нивните формули се: HCl , H2O, NH3 и CH4.Во хлороводородот еден атом на хлор е сврзан со еден атом од водород и,според тоа,хлорот е едновалентен. Во водата односот меѓу бројот на атоми од кислород и водород е 1:2,така што кислородот е двовалентен. На сличен начин заклучуваме дека азотот во амонијакот е тривалентен, а јаглеродот во метанот е четиривалентен.
Од хлороводород може да се добие натриум хлорид чија формула е NaCl.Од формулата изгледа како еден атом од натриум да заменил еден атом на водород.Заради тоа, може да се смета дека натриумот е едновалентен.Постојат и хлориди на калциумот,алуминиумот, калајот и антимонот чии формули се: CaCl2,AlCl3,SnCl4 и SbCl5. Во согласност со горната дефиниција,заклучуваме дека во овие соединенија калциумот е двовалентен, алуминиумот е тривалентен,калајот е четиривалентен,а антимонот-петвалентен.
Определување на валентност според кислород
Кислородот образува многу повеќе соединенија, вклучително и оксиди на елементите. Врз основа на ова,поимот за валентност бил малку изменет.Наместо во однос на водородот,валентноста почнала да се определува во однос на кислородот.Имено,ако елементот Е образува оксид со формула Е2О, во молекулата на тој оксид атомот на елементот Е може да се смета за еквивалентен (еднкавовреден) на еден водороден атом.Тој, според тоа, е едновалентен.Ако пак формулата на оксидот е ЕО, елементот е двовалентен итн
.
Формула на оксидот:__________________________Валентноста на елементот Е:
ЕО2 1
ЕО 2
Е2О3 3
ЕО2 4
И така,
валентноста може да се определува и во однос на кислородот.
Определување на валентност во однос на атомски групации
Определувањето на валентноста во однос на кислородот го олеснило,но не го решило проблемот во врска со определувањето на валентноста.Особено комплицирани биле проблемите кај органските соединенија.Јаглеродот е четиривалентен во сите органски соединенија,независно од тоа дали се работи,да речеме,за метан (CH4), за бутан (C4H10) или за етин (C2H2). И четиривалентноста на атомите од јаглерод и валентноста на други елементи може да се определи ако:
под валентност го подразбираме бројот на хемиски врски што ги образува еден атом.
Поимот за валентност може да се прошири и на атомски групации. Така, групацијата SO4 во сулфурната киселина е двовалентна поради тоа што е сврзана, со по една врска, за два водородни атома.Ваква е валентноста на SO4 групацијата и кај сите соли на сулфурната киселина (сулфатите). Слично на тоа, групацијата NO3 е едновалентна, а такви се и метилната (CH3) или етилната (C2H5) група. Во секој случај,треба да се запомни,
може да се зборува за валентност на атоми и елементи, но и на атомски групации.
Валентноста на ист елемент може да биде различна
Без оглед на тоа како е определена, некои елементи имаат постојана валентност, еднаква во сите соединенија.Други елементи,пак,може да образуваат повеќе од еден оксид.Во таков случај, зворуваме за променлива валентност на елементот (односно, на неговите атоми). Вака е кај сулфурот (тој образува оксиди со формули SO4 и SO3) или азотот (формулите на оксидите на азотот се N2O, NO,N2O3,NO2 и N2O5).Како што се гледа, сулфурот во однос на кислородот може да биде четиривалентен или шествалентен, а азотот може да има валентност 1, 2, 3, 4 или 5.Променлива валентност имаат и некои метали ( на пример,железото),додека други имаат постојана валентност(натриумот е,да речеме, секогаш едновалентен,а калциумот -двoвалентен).Водородот во сите соединенија што ги образува е едновалентен, а кислородот практично секогаш може да го сметаме за двовалентен. Во сите свои соединенија,флуорот е едновалентен.
За означување на валентноста се користи римски број напишан над симболот на елементот.Така може да се напише:
II III
FeCl2 или FeCl3
додека во називот римската бројка се става во загради,напишани слеано.Така првиот хлорид од двата дадени погоре е железо(II)хлорид, а вториот е железо(III)хлорид.
валентноста може да биде или постојана(т.е. еднаква во сите негови
соединенија) или променливa(т.е. различна во различни соединенија).
Надворешни врски
[1]
[http://dl.clackamas.cc.or.us/ch104-06/valence_electrons.htm
прикажан текст]
Наводи
Хемија за прва година од Бојан Шоптрајанов,Силвана Буклеска и Наше Салих
| Оваа статија е никулец. Можете да помогнете со тоа што ќе ја проширите. |