Беквит-Видеманов синдром
Беквит-Видеманов синдром (скратено BWS) е нарушување на прекумерен раст обично присутно од самото раѓање, кое се одликува со зголемен ризик од рак во детството и одредени вродени одлики. Малцинство (<15%) случаи на BWS се фамилијарни, што значи дека близок роднина исто така може да има BWS, а родителите на засегнатото дете може да имаат зголемен ризик да имаат други деца со BWS. Додека децата со BWS се изложени на зголемен ризик од рак во детството, повеќето деца со BWS не развиваат рак, додека пак огромно мнозинство од децата кои развиваат рак може успешно да се лекуваат.[1]
| Beckwith-Wiedemann syndrome | |
|---|---|
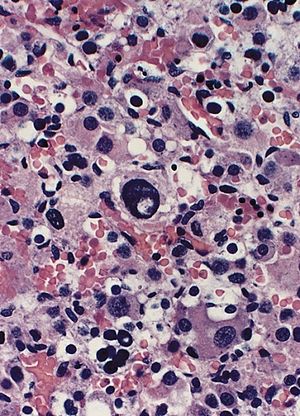 | |
| Adrenal gland: Beckwith-Wiedemann syndrome Nuclear enlargement and hyperchromasia with nuclear "pseudoinclusion" near the center of field. Mitotic figures were not identified. | |
| Специјалност | Медицинска генетика |
Презентација
уредиНе постојат консензусни клинички дијагностички критериуми за Беквит-Видемановиот синдром (BWS). Синдромот треба да се посомнева кај лица кои имаат еден или повеќе од следните главни и/или помали наоди.
Главни наоди поврзани со BWS[2]
- Макросомија (традиционално дефинирана како тежина и должина/висина >97 центил);
- Макроглосија;
- Хемихиперплазија (асиметричен прекумерен раст на еден или повеќе делови од телото);
- Омфалоцела (исто така наречена егзомфалос) или папочна кила;
- Ембрионален тумор (на пр. Вилмсов тумор, хепатобластом, невробластом, рабдомиосарком ) во детството;
- Висцеромегалија која опфаќа еден или повеќе интра-абдоминални органи вклучувајќи црн дроб, слезина, бубрези, надбубрежни жлезди и/или панкреас;
- Цитомегалија на феталниот надбубрежен кортекс (патогномоничен);
- Бубрежни абнормалности вклучувајќи структурни абнормалности, нефромегалија, нефрокалциноза и/или подоцнежен развој на медуларен сунѓерен бубрег;
- Набори на предниот линеарен ушен лобус и/или задните спирални ушни јами;
- Плацентарна мезенхимална дисплазија;
- Расцеп на непце (ретко кај BWS);
- Кардиомиопатија (ретка кај BWS);
- Позитивна семејна историја (≥1 член на семејството со клиничка дијагноза на BWS или историја или одлики кои укажуваат на BWS);
Мали наоди поврзани со BWS
- Наоди поврзани со бременост, вклучително полихидроамнион и недоносеност кај фетуси со оваа состојба;
- Неонатална хипогликемија;
- Васкуларни лезии вклучувајќи невус симплекс (обично се појавуваат на челото, глабелата и/или задниот дел на вратот) или хемангиоми (кожни или екстракутани);
- Карактеристични фаци, вклучувајќи ретрузија на средното лице и инфраорбитални набори;
- Структурни срцеви аномалии или кардиомегалија;
- Дијастаза;
- Напредна коскена возраст (честа појава кај прекумерен раст/ендокрини нарушувања);
Дијагнозата на BWS е поставена кај пробанд со едно од следниве:
- Три главни или два главни плус најмалку еден помал критериум Забелешка: BWS треба да се смета за клинички спектар, при што некои засегнати лица имаат само еден или два сугестивни клинички наоди. Затоа, општо прифатените клинички критериуми предложени овде не треба да се гледаат како апсолутни, туку како упатства. Со други зборови, тие не можат да се користат за да се исклучи дијагнозата на BWS и не може да се замени за клиничко расудување.
- Епигенетска или геномска промена што води до абнормална метилација на 11p15,5 или хетерозиготна патогена варијанта што предизвикува BWS во CDKN1C во присуство на еден или повеќе клинички наоди
Повеќето деца со BWS ги немаат сите овие одлики. Дополнително, некои деца со BWS имаат и други наоди, вклучувајќи: истакнат тил, хипоплазија на средното лице, хемихипертрофија, генитоуринарни аномалии (зголемени бубрези), срцеви аномалии, мускулно-скелетни абнормалности и губење на слухот. Исто така, некои предвремено родени новороденчиња со BWS немаат макроглосија сè додека не се приближи до очекуваниот датум на породување.[3]
Со оглед на различноста меѓу лицата со BWS и недостатокот на едноставен дијагностички тест, идентификувањето на BWS може да биде тешко. Во обид да се стандардизира класификацијата на BWS, го дефинирале доколку надетето му било дијагностицирано дека има BWS и ако детето има најмалку две од петте заеднички одлики поврзани со BWS (макроглосија, макросомија, мани на абдоминалниот ѕид на средната линија, набори на ушите, неонатална хипогликемија ). Друга дефиниција претставена од Елиот и сор. вклучува присуство на или три главни одлики (мана на предниот абдоминален ѕид, макроглосија или препостнатален прекумерен раст) или два главни плус три помали наоди (набори на увото, nevus flammeus, неонатална хипогликемија, нефромегалија или хемихиперплазија).[4]
Во 1963 година, американскиот патолог Беквит го опишал првиот случај на изразена цитомегалија на надбубрежниот кортекс со хиперплазија на бубрезите и панкреасот, што било придружено со хиперплазија на клетките на Лајдиг. Германскиот педијатар Видеман ја дополнил клиничката слика за новата болест со додавање на папочна кила и макроглосијаконски синдром. Синдромот Беквит-Видеман се дијагностицира кај 1 од 10.500 до 13.700 новороденчиња ширум светот, со приближно еднаква инциденца, и кај момчињата и кај девојчињата. Сепак, инциденцата на болеста може да е и повисока бидејќи кај случаите со лесни симптоми, ретко болеста може да биде дијагностицирана.
Неоплазми
уредиПовеќето деца (>80%) со BWS не развиваат рак; сепак, децата со BWS имаат многу поголема веројатност (~ 600 пати повеќе) од другите деца да развијат одредени детски карциноми, особено Вилмсов тумор (нефробластом), панкреатобластом и хепатобластом. Поединците со BWS се чини дека се изложени на зголемен ризик за рак само во детството (особено пред четиригодишна возраст) и немаат зголемен ризик од развој на рак во зрелите години. Ако 100 деца со BWS биле следени од раѓање до десетгодишна возраст, би се очекувале околу 10 случаи на рак во групата пред четиригодишна возраст, а околу 1 случај на рак во групата би се очекувал помеѓу четири и десет години. Покрај Вилмсовиот тумор и хепатобластомот, децата со BWS во поединечни извештаи за случаи се покажаа дека развиваат ганглионеуром, адренокортикален карцином, акутна лимфоидна леукемија, сарком на црниот дроб, карцином на штитната жлезда, меланом, рабдомиосарком и мезобластичен нефром .
Вилмсовиот тумор, хепатобластомот и мезобластниот нефром обично може да се излечат ако се дијагностицираат рано. Раната дијагноза им овозможува на лекарите да го третираат ракот кога е во рана фаза. Покрај тоа, постои помалку токсичен третман.[5][6] Со оглед на важноста на раната дијагноза, сите деца со BWS треба да добијат скрининг за рак.[7]
Се препорачува абдоминален ултразвук на секои 3 месеци до најмалку осумгодишна возраст[6] и тест на крвта за мерење на алфа-фетобелковина (AFP) на секои 6 недели до најмалку четиригодишна возраст.[8] Семејствата и лекарите треба да одредат распоред за скрининг за одредени пациенти, особено возраста на која треба да се прекине скринингот, врз основа на нивната сопствена проценка на односот ризик-корист.
Генетика
уредиПовеќето (>85%) случаи на BWS се спорадични, што значи дека, вообичаено, никој друг во тоа семејство нема BWS, а родителите на засегнатото дете не се изложени на зголемен ризик да имаат други деца со BWS. Сепак, некои (<15%) случаи на BWS се фамилијарни, што значи дека близок роднина исто така може да има BWS, а родителите на засегнатото дете може да имаат зголемен ризик да имаат други деца со BWS. Се покажа дека BWS конкретно вклучува мутации во дефиниран регион на краткиот крак на хромозомот 11 познат како 11p15.5, што доведува до хиперактивност на генот IGF-2 (фактор на раст) и/или нема активна копија на CDKN1C (инхибитор на генот за клеточна пролиферација).
BWS може да биде предизвикана од низа различни генетски мани. Над пет различни грешки кои вклучуваат 11p15.5 се идентификувани кај различни пациенти со BWS. Некои пациенти имаат мајчински хромозомски преуредувања од 11p15,5. Други пациенти имаат татковска еднородителска дисомија (UPD) на хромозомот 11, што значи дека мајчината копија од овој хромозом е заменета со дополнителна татковска копија. Многу други пациенти имаат абнормална метилација на ДНК во различни области од 11p15.5, што значи дека нормалните епигенетски знаци кои ги регулираат втиснатите гени во овој регион се променети. Неколку други пациенти имаат една генска копија сместена во 11p15, наместо две копии.
Отсуството на мутација кај дете со клинички наоди кои укажуваат на BWS не треба да ја исклучува дијагнозата на BWS. Дури и по екстензивно молекуларно тестирање, специфичниот мана што предизвикува BWS кај засегнатата индивидуа може да остане непознат. BWS останува клиничка, наместо генетска, дијагноза, бидејќи лекарите не можат да ги идентификуваат и тестираат сите генетски причини за BWS. Клиничката дефиниција што се користи за BWS е ограничена, бидејќи не постојат стандардни дијагностички критериуми кои биле независно потврдени со пациенти кои имаат или генетски или епигенетски мутации. Кога молекуларните анализи беа завршени кај 10 деца кои го исполнија истражувачкиот критериум за BWS, само 7 од 10-те деца имале генетски или епигенетски мутации.[9]
Имајќи предвид дека генетиката на BWS е сложена, детето со BWS треба да биде под медицинска нега на генетичар или експерт за управување со BWS. Поретко, синдромот на Беквит-Видеман е предизвикан од генетски промени во генот CDKN1C. Овој ген кодира белковина која го контролира растот на клетките, па доколку оваа белковина не работи како што треба, доаѓа до прекумерен раст на клетките.
Genes involved are IGF-2, CDKN1C, H19, and KCNQ1OT1.
Асоцијација со CDKN1C
уредиCDKN1C е белковински ген за кодирање кој шифрира циклин-зависен киназа инхибитор кој делува како негативен регулатор на клеточната пролиферација, ефикасно правејќи го CDKN1C ген за супресор на тумор. CDKN1C, исто така, работи за време на феталниот развој, спречувајќи го фетусот да стане премногу голем. Се наоѓа на кратката рака на човечкиот хромозом 11 во регионот ICR2, заедно со многу други втиснати гени. Бидејќи CDKN1C е преференцијално изразен кај мајката, хипометилацијата во ICR2 регионот на мајчиниот алел може да резултира со патологии како што е рак или мана познат како синдром Беквит-Вајдеман. Синдромот Беквит-Вајдеман (BWS) исто така може да биде предизвикан од CDKN1C 11p15 епимутации. Исто така, може да биде резултат на бришење на мали количини на ДНК кои предизвикуваат хромозомски абнормалности, што го прави генот неактивен. Ова остава само татковски изразениот IGF2 да промовира клеточна пролиферација. Намалувањето на ограничувањето на растот резултира со прекумерен раст на многу ткива, што доведува до вообичаени симптоми на BWS. Овие симптоми може да вклучуваат макроглосија, органомегалија, периорбитална полнота и хернии. Постојат нокаут модели за CDKN1C кај глувци; всушност, многу од засегнатите потомци покажуваат фетална и неонатална смртност и ги имаат повеќето одлики поврзани со Беквит-Вајдемановиот синдром.[10]
Управување
уредиМаните на абдоминалниот ѕид се чести кај новороденчињата со BWS и може да бараат хируршки третман. Исто така овие мани може да варираат по сериозност од омфалоцела (најсериозни) до папочна кила и дијастаза recti (најмалку сериозни). Омфалоцела е вродена малформација во која цревата на новороденчето, а понекогаш и други абдоминални органи, излегуваат надвор од абдоменот преку папокот. Кај новороденчињата со омфалоцела обично им е потребна операција за да се врати абдоминалната содржина назад во абдоменот со цел да се спречи сериозна инфекција или шок. Папочната кила е исто така мана во кој абдоминалната содржина доаѓа преку слаб мускул на абдоминалниот ѕид кај папокот. Општо земено, новороденчињата со папочна кила не бараат третман бидејќи често овие хернии спонтано се затвораат на возраст од четири години. Ако, по ова време, хернија сè уште е присутна, може да се препорача операција. Diastasis recti е раздвојување на левата и десната страна на ректусниот абдоминис мускул кои вообичаено се споени заедно. Децата со дијастаза recti обично не бараат третман бидејќи состојбата се решава како што детето расте.
Неонатална хипогликемија, ниска гликоза во крвта во првиот месец од животот, се јавува кај околу половина од децата со BWS.[11] Повеќето од овие хипогликемични новороденчиња се асимптоматски и имаат нормално ниво на гликоза во крвта во рок од неколку дена. Сепак, нелекуваната перзистентна хипогликемија може да доведе до трајно оштетување на мозокот. Хипогликемијата кај новороденчињата со BWS треба да се управува според стандардните протоколи за лекување неонатална хипогликемија. Обично оваа хипогликемија лесно може да се третира со почесто хранење или медицински дози на гликоза. Ретко (<5%) децата со BWS ќе продолжат да имаат хипогликемија по неонаталниот период и бараат поинтензивен третман.[9] Таквите деца може да бараат хранење со цевка, орални хипергликемични лекови или делумна панкреатектомија.
Макроглосијата, голем јазик, е многу честа (>90%) и истакната одлика на BWS. Доенчињата со BWS и макроглосија обично не можат целосно да ја затворат устата пред нивниот голем јазик, предизвикувајќи таа да излегува надвор. Макроглосијата кај BWS станува помалку забележлива со возраста и често не бара третман; но тоа предизвикува проблеми кај некои деца со BWS. Во тешки случаи, макроглосијата може да предизвика тешкотии во дишењето, хранењето и говорот. Децата со BWS и значајна макроглосија треба да бидат евалуирани од страна на краниофацијален тим.
Најдоброто време да се изврши операција за голем јазик не е познато. Некои хирурзи препорачуваат да се изврши операцијата на возраст од 3 до 6 месеци. Операцијата за макроглосија вклучува отстранување на мал дел од јазикот за да се вклопи во устата за да се овозможи правилен развој на вилицата и забите.
Овие деца често се управувани од мултидисциплинарен краниофацијален тим. Овие тимови вклучуваат логопеди и јазични терапевти, краниофацијални и педијатриски пластични хирурзи и ортодонти кои одлучуваат за соодветноста и времето на операцијата за намалување на јазикот. Некои земји имаат назначено центри за управување со макроглосија. На пример, во Обединетото Кралство, децата кои имаат макроглосија поврзана со синдромот Беквит Видеман се водат во национална специјализирана служба. Услугата е нарачана како високо специјализирана услуга од NHS Англија и се наоѓа во болницата Great Ormond Street.[12]
Nevus flammeus (дамка од порт-вино) е рамен, црвен роден знак предизвикан од малформација на капилари (мали крвни садови). Децата со BWS често имаат nevus flammeus на челото или на задниот дел од вратот. Nevus flammeus е доброќуден и најчесто не бара никаков третман.
Хемихипертрофија е абнормална асиметрија помеѓу левата и десната страна на телото се јавува кога еден дел од телото расте побрзо отколку нормално. Децата со BWS и хемихипертрофија може да имаат изолирана асиметрија на еден дел од телото или може да имаат разлика што ќе влијае на целата една страна од телото. Поединци кои немаат BWS може да имаат и хемихипертрофија. Изолираната хемихипертрофија е поврзана со поголем ризик за рак.[13] Видовите на рак и возраста на ракот се слични на децата со BWS. Како резултат на тоа, децата со хемихипертрофија треба да го следат општиот протокол за скрининг на рак за BWS.
Хемихипертрофијата, исто така, може да предизвика различни ортопедски проблеми, така што децата со значителна хемихиперплазија на екстремитетите треба да бидат евалуирани и следени од ортопедски хирург.
Хемихиперплазијата што го зафаќа лицето понекогаш може да предизвика значителни козметички проблеми што може да ги реши кранијален тим за лице.
Прогноза
уредиВо принцип, прогнозата е многу добра. Децата со BWS обично се многу добро и растат да станат височини што се очекуваат врз основа на висината на нивните родители. Додека децата со BWS се изложени на зголемен ризик од рак во детството, повеќето деца со BWS не развиваат рак и огромното мнозинство од децата кои развиваат рак може успешно да се лекуваат.
Децата со BWS во најголем дел немаа значителни доцнења во споредба со нивните браќа и сестри. Сепак, некои деца со BWS имаат проблеми со говорот кои можат да бидат поврзани со макроглосија или губење на слухот.
Напредокот во лекувањето на неонаталните компликации и предвремено родените бебиња во последните дваесет години значително ја подобри вистинската стапка на смртност кај новороденчињата поврзана со BWS. Во преглед на бремености кои резултираа со 304 деца со BWS, не беа пријавени неонатални смртни случаи.[14] Ова се споредува со претходно пријавената стапка на смртност од 20%.[15] Податоците од претходната студија беа изведени од регистарот BWS, база на податоци што може да биде малку пристрасна кон вклучување живи деца; сепак, смртта не беше критериум за исклучување за да се запише во матичната книга. Ова сугерира дека додека доенчињата со BWS веројатно имаат повисок од нормалниот ризик за смртност кај новороденчињата, тој не може да биде висок до 20%.
Асистентна репродуктивна технологија
уредиПомошната репродуктивна технологија (АРТ) е општ термин кој се однесува на методите што се користат за да се постигне бременост со вештачки или делумно вештачки средства. Според ЦДЦ, генерално, процедурите за АРТ вклучуваат хируршко отстранување на јајце-клетки од јајниците на жената, нивно комбинирање со сперма во лабораторија и нивно враќање во телото на жената или нивно донирање на друга жена. АРТ е поврзан со епигенетски синдроми, особено BWS и Ангелман синдром. Три групи покажаа зголемена стапка на зачнување со АРТ кај деца со BWS.[9][16][17][18] Ретроспективна студија за контрола на случај од Австралија откри 1 од 4000 ризик од BWS кај нивната ин-витро популација, неколку пати повисок од општата популација.[19] Друга студија покажа дека децата зачнати со ин витро оплодување ( ИВФ ) имаат три до четири пати поголеми шанси да развијат состојба.[20] Ниту еден специфичен тип на АРТ не е поблиску поврзан со BWS.[18] Механизмот со кој АРТ го произведува овој ефект сè уште е под истрага.
Епидемиологија
уредиБеквит-Видемановиот синдром има проценета инциденца од еден на 13.700; околу 300 деца со BWS се раѓаат секоја година во САД.[21] Точната инциденца на BWS е непозната поради изразената варијабилност во презентацијата на синдромот и тешкотиите со дијагнозата. Бројот на пријавени бебиња родени со BWS е најверојатно низок бидејќи многу од нив се родени со BWS, но имаат клинички одлики кои се помалку истакнати и затоа пропуштени. BWS е документиран кај различни етнички групи и се јавува подеднакво кај мажите и жените.
Децата зачнати преку ин витро оплодување имаат три до четирикратно зголемени шанси да развијат Беквит-Видеман синдром. Се смета дека ова се должи на вклучувањето или исклучувањето на гените со процедурите за ИВФ.[22]
Дијагноза
Дијагнозата се поставува врз основа на клиничката слика. т.е. кога детето ги има сите или некои од одликите на синдромот, и се потврдува со генетско тестирање.
Третман
Се препорачуваат редовни прегледи за да се открие развојот на потенцијалните карциноми што е можно поскоро.Ултразвук на абдоменот треба да се прави на секои три месеци до возраст од 7 години. До 4-та година, ултразвукот треба да вклучува прегледи на црниот дроб, бубрезите и другите внатрешни органи. Ризикот од развој на хепатобластом е значително намален кај деца постари од 4 години, така што преостанатите ултразвучни прегледи можат да се фокусираат специјално на бубрезите (ултразвук на бубрезите), кој ги вклучува и надбубрежните жлезди. Ултразвукот на абдоменот е безбеден и безболен, и не вклучува употреба на зрачење.Нивото на алфа-фетобелковина во крвта треба да се мери на секои три месеци до 4-та година од животот. Оваа белковина се ослободува од незрелите или оштетените клетки на црниот дроб, а во високи концентрации се ослободува и од клетките на туморот на хепатобластом. Ова е исклучително чувствителен начин за откривање на овој карцином. Мултидисциплинарен пристап е потребен во третманот на деца со овој синдром, и може да вклучува: ортопедија, пластична хирургија, ендокринологија и дополнителни потреби кои се засноваат на клиничките проценки.
Историја
уредиВо 1960-тите, д-р Џон Брус Беквит, американски патолог и д -р Ханс-Рудолф Видеман, германски педијатар, независно пријавија случаи на предложениот нов синдром.[23] Првично наречен ЕМГ синдром (за егзомфалос, макроглосија и гигантизам ), овој синдром со текот на времето стана познат како Беквит-Видеман синдром или Видеман Беквит синдром.
Првично, д-р Ханс-Рудолф Видеман (роден на 16 февруари 1915 година, Бремен, Германија, починал на 4 август 2006 година, Кил) го измислил терминот синдром егзомфалос - макроглосија - гигантизам (ЕМГ) за да ја опише комбинацијата на вродени мани на абдоминалниот ѕид (ексомфалоснија), големи јазици (макроглосија) и големи тела и/или долги екстремитети (гигантизам). Со текот на времето, ова соѕвездие беше преименувано во Беквит-Видеман синдром по автоптичките набљудувања на проф. Џон Брус Беквит (роден на 18 септември 1933 година, Спокејн, Вашингтон),[24] кој исто така забележал сериозно зголемување на големината на надбубрежните жлезди кај некои од овие пациенти.
Клиничка слика
Клиничката слика покажува карактеристична постнатална макрозомија (поголема телесна тежина на новороденчето) и овие деца се повисоки од нивните врсници. Растот забавува околу 8-та година од животот. Кај некои може да се појави абнормален раст само на едната страна од телото. Оваа необична состојба, хемихиперплазија, обично станува помалку изразена со возраста. Повеќето деца имаат мана на абдоминалниот ѕид (омфалоцела, папочна кила). Исто така, постои макроглосија (зголемен јазик), што може да предизвика проблеми со дишењето, голтањето и говорот, и абнормално големи абдоминални органи - висцеромегалија (црн дроб, бубрези и панкреас).
Децата со овој синдром бараат понатамошен третман, бидејќи имаат зголемен ризик од развој на Вилмсов тумор и хепатобластом. Туморите се развиваат кај околу 10% од пациентите и речиси секогаш се појавуваат во детството. Хипогликемија (низок шеќер во крвта) се јавува за неколку дена или месеци од животот, и добро реагира на терапијата со дијазоксид. Срцевите малформации се наоѓаат во 9 до 34% од случаите, а приближно половина имаат кардиомегалија.[1]
Наводи
уреди- ↑ 1,0 1,1 Ги запознаваме ретките болести
- ↑ Shuman, Cheryl; Beckwith, J. Bruce; Weksberg, Rosanna (1993), Adam, Margaret P.; Ardinger, Holly H.; Pagon, Roberta A.; Wallace, Stephanie E. (уред.), „Beckwith-Wiedemann Syndrome“, GeneReviews®, University of Washington, Seattle, PMID 20301568, Посетено на 2018-11-30
- ↑ „A novel cyclin encoded by a bcl1-linked candidate oncogene“. Nature. 350 (6318): 512–5. April 1991. Bibcode:1991Natur.350..512M. doi:10.1038/350512a0. PMID 1826542.
- ↑ „Clinical features and natural history of Beckwith-Wiedemann syndrome: presentation of 74 new cases“. Clinical Genetics. 46 (2): 168–74. August 1994. doi:10.1111/j.1399-0004.1994.tb04219.x. PMID 7820926.
- ↑ „Congenital mesoblastic nephroma 50 years after its recognition: A narrative review“ (PDF). Pediatric Blood & Cancer. 64 (7): e26437. 2017. doi:10.1002/pbc.26437. PMID 28124468.
- ↑ 6,0 6,1 „Screening for Wilms tumor in children with Beckwith-Wiedemann syndrome or idiopathic hemihypertrophy“. Medical and Pediatric Oncology. 32 (3): 196–200. March 1999. doi:10.1002/(SICI)1096-911X(199903)32:3<196::AID-MPO6>3.0.CO;2-9. PMID 10064187.
- ↑ „Overgrowth Syndromes“. Journal of Pediatric Genetics. 4 (3): 136–43. 2015. doi:10.1055/s-0035-1564440. PMC 4918719. PMID 27617124.
- ↑ „Serum alpha-fetoprotein screening for hepatoblastoma in children with Beckwith-Wiedemann syndrome or isolated hemihyperplasia“. The Journal of Pediatrics. 143 (2): 270–2. August 2003. doi:10.1067/S0022-3476(03)00306-8. PMID 12970646.
- ↑ 9,0 9,1 9,2 „Epigenetic alterations of H19 and LIT1 distinguish patients with Beckwith-Wiedemann syndrome with cancer and birth defects“. American Journal of Human Genetics. 70 (3): 604–11. March 2002. doi:10.1086/338934. PMC 384940. PMID 11813134.
- ↑ Pappas, J. (April 2015). „The Clinical Course of an Overgrowth Syndrome, From Diagnosis in Infancy Through Adulthood: The Case of Beckwith-Weidemann Syndrome“. Current Problems in Pediatric and Adolescent Health Care. 45 (4): 112–117. doi:10.1016/j.cppeds.2015.03.001. PMID 25861997.
- ↑ „Hypoglycemia in Beckwith-Wiedemann syndrome“. Seminars in Perinatology. 24 (2): 164–71. April 2000. doi:10.1053/sp.2000.6366. PMID 10805171.
- ↑ Great Ormond Street Hospital, Great Ormond Street Hospital. „Beckwith-Wiedemann syndrome (BWS)“. Great Ormond Street Hospital. Great Ormond Street Hospital. Посетено на 27 October 2020.
- ↑ „Isolated hemihyperplasia (hemihypertrophy): report of a prospective multicenter study of the incidence of neoplasia and review“. American Journal of Medical Genetics. 79 (4): 274–8. October 1998. doi:10.1002/(SICI)1096-8628(19981002)79:4<274::AID-AJMG8>3.0.CO;2-M. PMID 9781907.
- ↑ „Factors associated with preterm delivery in mothers of children with Beckwith-Wiedemann syndrome: a case cohort study from the BWS registry“. American Journal of Medical Genetics Part A. 134A (2): 187–91. April 2005. doi:10.1002/ajmg.a.30595. PMID 15723285.
- ↑ „Wiedemann-Beckwith syndrome: presentation of clinical and cytogenetic data on 22 new cases and review of the literature“. Human Genetics. 74 (2): 143–54. October 1986. doi:10.1007/BF00282078. PMID 3770742.
- ↑ „In vitro fertilization may increase the risk of Beckwith-Wiedemann syndrome related to the abnormal imprinting of the KCN1OT gene“. American Journal of Human Genetics. 72 (5): 1338–41. May 2003. doi:10.1086/374824. PMC 1180288. PMID 12772698.
- ↑ „Beckwith-Wiedemann syndrome and assisted reproduction technology (ART)“. Journal of Medical Genetics. 40 (1): 62–4. January 2003. doi:10.1136/jmg.40.1.62. PMC 1735252. PMID 12525545.
- ↑ 18,0 18,1 „Association between Beckwith-Wiedemann syndrome and assisted reproductive technology: a case series of 19 patients“. Fertility and Sterility. 83 (2): 349–54. February 2005. doi:10.1016/j.fertnstert.2004.07.964. PMC 4872595. PMID 15705373.
- ↑ „Beckwith-Wiedemann syndrome and IVF: a case-control study“. American Journal of Human Genetics. 75 (3): 526–8. September 2004. doi:10.1086/423902. PMC 1182036. PMID 15284956.
- ↑ „Rare congenital disorders, imprinted genes, and assisted reproductive technology“. Lancet. 361 (9373): 1975–7. 2003. doi:10.1016/S0140-6736(03)13592-1. PMID 12801753.
- ↑ „Exomphalos-macroglossia-gigantism syndrome in Jamaican infants“. American Journal of Diseases of Children. 119 (4): 316–21. April 1970. doi:10.1001/archpedi.1970.02100050318006. PMID 5434588.
- ↑ BBC, Horizon (2005). „BBC - Science & Nature - Horizon“. Архивирано од изворникот на 2005-12-04. Посетено на 2010-09-29.
Beckwith-Wiedemann Syndrome – a rare disorder linked to abnormal gene expression. It has been shown that babies conceived by IVF have a three- to four-fold increased chance of developing this condition.
- ↑ Wiedemann HR (September 1964). „Familial malformation complex with umbilical hernia and macroglossia - a "new syndrome"?“. Journal de Génétique Humaine (француски). 13: 223–32. PMID 14231762.
- ↑ Biographical note