Карбонат
Карбонатот е анјон со електричен полнеж -2 и емпириска формула CO32−.
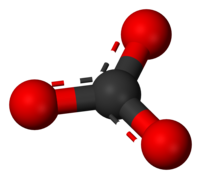
3
Едноставните карбонатни соли тежнеат да се нерастворливи во вода, со константи на растворливост помали од 1×10−8. Исклучоци од ова се солите формирани со амониум јонот (NH4+) или јоните на алкалните метали.
Во воден раствор карбонатот постои во три форми. Во силни базни услови, доминира карбонатниот јон од видот CO32−. Во слаби базни услови доминира бикарбонатниот јон HCO3−. Во кисели услови, водниот јаглерод диокисд CO2(aq) е главната форма. Со него постои и минутна количина на јаглеродна киселина H2CO3. Натриум карбонатот е базен, натриум бикарбонатот е слабо базен, додека јаглерод диоксиодот е слаба киселина.
Во биолошките системи, ензимот јаглеродна анхидраза ја катализира интерконверзијата меѓу јаглеродниот диоксид и карбонатните јони.
Карбонатите можат да се формираат и во меѓупланетарниот простор. Исто така, тие се детектирани на кратерот Гусев на Марс.
Галерија
уреди-
Одредување на карбонати во почва