Батерија
Батерија (или струјосклад) — електрохемиски уред во кој има складирана хемиска енергија (во форма на потенцијална енергија), која може да се претвори во електрична енергија, кога на краевите на батериите, електроди ќе се спојат со спроводник.
| Батерија | |
|---|---|
 Разни батерии (од лево кон десно): две AA, една D, една рачна радиаоматерска, една 9-волтна (PP3), Две AAA, една C, една од видеокамера и една од безжичен телефон. | |
| Тип | извор на ел. енергија |
| Принцип на работа | електрохемиски реакции, електромоторна сила |
| Првпат произведен | 1800-ти |
| Ел. симбол | |
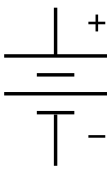 Симболот за батерија во ел. шема. Потекнува од шематскиот приказ на првобитна батерија — Волтиниот столб. | |
Првата позната батерија е багдадската батерија од периодот помеѓу 250 и 640 година п.н.е..
Модерните батерии работат на принципот кој бил измислен од страна на италијанскиот физичар Алесандро Волта (1745-1827).
Батерии спаѓаат во таканаречените основни извори на електрична енергија, затоа што ја претвораат хемиската енергија во електрична и можат да се полнат (процесот не е реверзибилен). За разлика од батеријата акумулаторот спаѓа во електро-хемиски секундарни (реверзибилни) извори на електрична енергија и можат постојано да ја претвораат хемиската енергија во електрична и обратно (може да се полни и празни).
Друго име за батеријата е галвански елемент. Галвански елементи се основни хемиски извори на струја. Постојат повеќе видови на галвански елементи меѓу кои се: Волтин, Даниелов, Лекланшеов итн. Со Даниеловиот елемент лесно може да се објасни принципот на батеријата.
Историја
уредиУпотребата на зборот „батерија" се земал за да се опише група на електрични уреди датира од Бенџамин Френклин, кој во 1748 година опишал неколку краставички од Leyden по аналогија на топови батерија (Бенџамин Френклин го позајми терминот „батерија" од војската, која се однесува за оружјето кое функционира заедно).
Италијанскиот физичар Алесандро Волта ја изградил и ја опишал првата електрохемиска батерија, галвански куп, во 1800. Ова беше куп од бакар и цинк чинии, разделени со хартиени дискови со накит од саламура, што може да создаде постојана струја во значително време. Волта не сфатил дека напонот се должи на хемиски реакции. Тој сметал дека неговите ќелии се неисцрпен извор на енергија и дека поврзаните корозивни ефекти на електродите биле само непријатност, наместо неизбежна последица на нивното работење, како што покажал Мајкл Фарадеј во 1834 година.
Иако раните батерии биле од големо значење за експериментални цели, во пракса нивните напони биле неппостојани и тие не можеле да обезбедат голема струја за одржлив период. Даниелската ќелија, измислена во 1836 година од британскиот хемичар Џон Фредерик Даниел, беше првиот практичен извор на електрична енергија, станувајќи индустриски стандард и широко распространето усвојување како извор на енергија за електрични телеграфски мрежи. Се состоеше од бакарен сад исполнет со раствор од бакарсулфат, во кој беше потопен сад без глинени садови исполнет со сулфурна киселина и цинк-електрода.
Овие влажни ќелии користеле течни електролити, кои биле склони кон истекување и истекување, ако не се постапува правилно. Многумина користеле стаклени тегли за да ги држат своите компоненти, што ги направило кревки и потенцијално опасни. Овие одлики ги направиле влажните ќелии непогодни за преносни апарати. Во близина на крајот на XIX век, пронајдокот на батериите од сувата ќелија, кои го замениле течниот електролит со паста, направиле преносливи електрични уреди практични.
Категории и видови на батерии
уредиБатериите се класифицирани во примарни и секундарни форми:
- Примарните батерии се дизајнирани за да се користат до исцрпување на енергија, а потоа се отфрлаат. Нивните хемиски реакции обично не се реверзибилни, па затоа не можат да се полнат. Кога напојувањето на реактантите во батеријата е исцрпено, батеријата престанува со производство на струја и е бескорисна.
- Секундарните батерии може да се полнат; односно, тие можат со своите имаат свои хемиски реакции обратност со примена на електрична струја во ќелијата. Ова ги регенерира оригиналните хемиски реактанти, така што тие можат да се користат, дополнуваат и повторно се користат повеќепати.
Некои видови примарни батерии што се користат, на пример, за телеграфски кола, беа вратени на работа со замена на електродите. Секундарните батерии не се бескорисни за полнење поради дисипација на активните материјали, губење на електролит и внатрешна корозија.
Батериите од никел-кадмиум (Ni-Cd) имаат слаба страна во тоа што, по секое полнење, времето потребно за да се испразнат е сè покусо. Така, по одредено време, батеријата не може повеќе да се наполни и треба да се замени. Во тој поглед, подобри се т.н. никел-метал хидридни батерии (Ni-MH) кои не страдаат од ефектот на паметење. Уште подобри се батериите во кои се образуваат, а потоа се разелектризираат, литиумови јони кои имаат значително поголем напон.[1]
Типови ќелии
уредиМногу видови на електрохемиски ќелии се произведени, со различни хемиски процеси и дизајни, вклучувајќи ги и галваничните ќелии, електролитски ќелии, горивни ќелии, протокот на ќелии и галвански колци.
Влажна ќелија
уредиВо влажната ќелија батерија има течен електролит. Наречени се и ‘поплавени‘ ќелии, бидејќи течноста ги опфаќа сите внатрешни делови или вентилираната ќелија, бидејќи гасовите што се создаваат за време на работата може да избегаат до воздухот. Влажните ќелии беа претходник на сувата ќелија и најчесто се користат како алатка за учење за електрохемија. Тие можат да бидат изградени со заеднички лабораториски материјали, како што се трофеии, за демонстрации за тоа како работат електрохемиските ќелии. Посебен вид влажна ќелија позната како концентрациона ќелија е важна за разбирање на корозијата. Влажните ќелии може да бидат примарни ќелии (не-полнење) или секундарни ќелии (полнење). Првично, сите практични примарни батерии, како што е Даниел, беа изградени како влажни ќелии со отворено стакло. Други примарни влажни ќелии се клеточната ќелија на Лекланче, Гроув, ќелијата Бунзен, ќелијата на хромната киселина, ќелијата Кларк и Вестон. Лекланшеската клеточна хемија беше прилагодена на првите суви ќелии. Влажните ќелии сè уште се користат во автомобилските батерии и во индустријата за режим на подготвеност за разводни, телекомуникациски или големи непрекинати напојување, но на многу места се користат батерии со гел-ќелии. Овие апликации најчесто користат олово-киселински или никел-кадмиумски ќелии.
Сува ќелија
уредиДодека пак сувата ќелија користи електролит за паста, со доволно влага за да се овозможи струја која ќе тече. За разлика од влажната ќелија, сувата ќелија може да работи во каква било ориентација без истурање, бидејќи не содржи слободна течност, што го прави погоден за пренослива опрема. За споредба, првите влажни ќелии беа типично кршливи стаклени контејнери со оловни прачки кои висеа од отворен врв и беше потребно внимателно ракување за да се избегне истурање. Оловно-киселински батерии не ја постигнале безбедноста и преносливоста на сувата ќелија додека не се развила гел батеријата.
Честа сува ќелија е цинк-јаглеродната батерија, со номинален напон од 1,5 волти, исто како и алкалната батерија (бидејќи и двете користат иста комбинација на цинк-манган диоксид). Стандардна сува ќелија содржи цинк-анодна, обично во форма на цилиндрично тенџере, со јаглеродна катода во форма на централна шипка. Електролитот е амониум хлорид во форма на паста до цинкот анодна. Останатиот простор помеѓу електролитот и јаглеродна катода е зафатен со втора паста која се состои од амониум хлорид и манган диоксид, а вториот делува како деполаризатор. Во некои дизајни, амониум хлоридот се заменува со цинк хлорид.
Сол батериите се примарни или секундарни батерии кои користат стопена сол како електролит. Тие работат на високи температури и мора да бидат добро теизолирани за да ја задржат топлината.
Резервната батерија може да се чува нерамномерно (неактивирана и без напојување) за подолг период (можеби години). Кога батеријата е потребна, тогаш таа е составена (на пример, со додавање на електролит); еднаш собрани, батеријата е наполнета и подготвена за работа. На пример, батеријата за електронски артилериски штитник може да се активира со влијанието на отпуштањето на пиштол. Забрзувањето крши капсула од електролит кој ја активира батеријата и ги напојува коларите на осигурувачот. Резервните батерии обично се дизајнирани за краток животен век (секунди или минути) по долгото складирање (години). Активираната вода со батерија за океанографски инструменти или воените примени се активира при потопување во вода.
Можности на ќелиите
уредиОдликите на батеријата може да варираат во текот на циклусот на оптоварување, преку циклус на полнење и во текот на целиот живот, поради многу фактори, вклучувајќи внатрешна хемија, тековна потрошувачка и температура. На ниски температури, батеријата не може да испорача толку енергија. Како таква, во студените клими, некои сопственици на автомобили инсталираат затоплувачи на батерии, кои се мали електрични грејни парничиња кои ја задржуваат батеријата на автомобилот топла.
Големини на батерии
уредиПримарните батерии што се достапни на потрошувачите се движат од малите ќелии што се користат за електрични часовници, до бројот 6 ќелија што се користи за сигнални кола или други апликации со долго траење. Секундарните ќелии се направени во многу големи димензии; многу големи батерии можат да напојуваат подморница или да ја стабилизираат електричната мрежа и да помогнат да ги надминат врвните оптоварувања.
Опасности
уредиЕксплозија на батерии генерално е предизвикана од злоупотреба или дефект, како при обид за полнење на батерија која не е наменета за полнење, или од краток спој.
Кога батеријата се надополнува со преголема брзина, експлозивната мешавина на гасови од водород и кислород може да се произведува побрзо отколку што може да избега од батеријата (на пр. Преку вграден вентилатор), што доведува до зголемување на притисокот и евентуално искривување на кутијата на батеријата. Во екстремни случаи, хемикалиите на батериите можат насилно да се истурат од обвивката и да предизвикаат повреда. Преполнувањето - односно обидот за полнење на батеријата надвор од неговиот електричен капацитет - исто така може да доведе до експлозија на батерии, покрај истекување или неповратно оштетување. Исто така, може да предизвика оштетување на полначот или уредот во кој подоцна се користи преполната батерија.
Батериите за автомобили најверојатно ќе експлодираат кога краток спој генерира многу големи струи. Таквите батерии произведуваат водород, кој е многу експлозивен, кога тие се преполни (поради електролиза на водата во електролит). При нормална употреба, износот на преполнување обично е многу мал и генерира малку водород, кој брзо се распаѓа. Меѓутоа, кога "скок со стартување" на автомобил, високата струја може да предизвика брзо ослободување на големи количини на водород, што може да се запали експлозивно од блиска искра, на пр. кога се исклучува кабел на скокач.
Отстранувањето на батеријата преку согорување може да предизвика експлозија додека пареа се гради во затворениот случај.
Потсетувањата на уредите кои користат литиум-јонски батерии станаа почести во последниве години. Ова е одговор на пријавените несреќи и неуспеси, повремено палење или експлозија. Експертско резиме на проблемот покажува дека овој видкористи течни електролити за пренос на литиумски јони помеѓу анодата и катодата. Ако батеријата ќе се наполни премногу брзо, може да предизвика краток спој, што доведува до експлозии и пожари".
Истекување
уредиМногу батерии се корозивни, отровни или и двете. Ако се случи истекување, или спонтано или преку несреќа, ослободените хемикалии може да бидат опасни. На пример, за еднократна употреба батерии често се користи цинк "може" и како реактант и како сад да се одржи на други реагенси. Ако овој вид на батерија е над-празнење, реагенсите може да се појават преку картон и пластика што го формираат остатокот од контејнерот. Активното истекување на хемикалијата потоа може да ја оштети или оневозможи опремата што ги напојува батериите. Поради оваа причина, многу производители на електронски уреди препорачуваат отстранување на батериите од уреди кои нема да се користат подолго време.
Токсични материи
уредиМногу видови на батерии користат токсични материјали како олово, жива и кадмиум како електрода или електролит. Кога секоја батерија ќе го достигне крајот на животот, мора да се отстрани за да се спречи оштетување на околината. Батериите се една форма на електронски отпад (е-отпад). Услугите за рециклирање на е-отпад закрепнуваат токсични супстанции, кои потоа можат да се користат за нови батерии. Од речиси три милијарди батерии купени годишно во САД, околу 179.000 тони завршуваат на депониите низ целата земја. Во САД, Актот за управување со батерии и батерии за полнење на батерии од 1996 година ја забрани продажбата на батерии кои содржат жива, донесоа унифицирани барања за етикетирање за акумулатори и бараа батериите за полнење лесно да се отстранат. Калифорнија и Њујорк го забрануваат отстранувањето на батериите за полнење во цврст отпад, и заедно со Мејн бараат рециклирање на мобилни телефони. Индустријата за полнење батерии работи на национално ниво за програми за рециклирање во САД и Канада, со повлекување бодови кај локалните трговци.
Директивата за батерии на Европската Унија има слични барања, покрај потребата од зголемено рециклирање на батериите и промовирање на истражувања за подобрени методи за рециклирање на батериите. Во согласност со оваа директива, сите батерии што треба да се продаваат во ЕУ мора да бидат обележани со "симбол за собирање" (пречкртан корпа за отпадоци). Ова мора да покрие најмалку 3% од површината на призматичните батерии и 1.5% од површината на цилиндричните батерии. Сите пакувања мора да бидат обележани исто така.
Потрошувачка
уредиБатериите може да бидат штетни или фатални ако се проголтаат. Малите копчиња може да се проголтаат, особено кај малите деца. Додека во дигестивниот тракт, електричното празнење на батеријата може да доведе до оштетување на ткивото; таквата штета е понекогаш сериозна и може да доведе до смрт. Инхерираните батерии на батерии обично не предизвикуваат проблеми, освен ако не станат поднесени во гастроинтестиналниот тракт. Најчесто место за батерии на дискови да се стават е хранопроводот, што резултира со клинички секвели. Батериите кои успешно го пресекуваат езофагусот најверојатно нема да поднесат на друго место. Веројатноста дека батеријата на дискот ќе поднесе во хранопроводникот е функција на возраста на пациентот и големината на батеријата. Дискови батерии од 16 мм се поставени во езофагите на 2 деца помлади од 1 година. Постарите деца немаат проблеми со батерии помали од 21-23 милиметри. Може да настане некроза на втечнување, бидејќи натриум хидроксидот е генериран од струјата произведена од батеријата (обично на анодата). Перфорацијата се случила брзо како 6 часа по ингестијата.
Хемија
уредиНаводи
уреди- ↑ Бојан Шоптрајанов, Хемија за втора година на реформираното гимназиско образование (петто изменето и дополнето издание). Скопје: Просветно дело, 2009, стр. XLII
- ↑ Hislop, Martin (1 March 2017). „Solid-state EV battery breakthrough from Li-ion battery inventor John Goodenough“. North American Energy News. The American Energy News. Посетено на 15 March 2017.
- ↑ https://www.youtube.com/playlist?list=PLAAoauVs9gEUQ1QfaueaDCjTMb9LoPEjX
Поврзано
уредиНадворешни врски
уреди| „Батерија“ на Ризницата ? |
- Батерии на Curlie (англиски)
- Како работат батериите