Цијановодород
Водород цијанид, понекогаш наречен и прусинска киселина — хемиско соединение со формула HCN и структура H–C≡N. Тоа е безбојна, исклучително отровна и запалива течност која врие малку над собната температура, на 25.6 °C (78.1 °F). HCN се произведува на индустриско ниво и е високо ценет претходник на многу хемиски соединенија кои се движат од полимери до фармацевтски производи. Примените од големи размери се за производство на калиум цијанид и адипонитрил, кои се користат во рударството и пластиката, соодветно.[8] Тој е поотровен од цврстите соединенија на цијанид поради неговата испарлива природа.
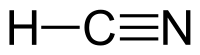
| |||
| |||
Други називи
| |||
| Назнаки | |||
|---|---|---|---|
| 74-90-8 | |||
| 3DMet | B00275 | ||
| ChEBI | CHEBI:18407 | ||
| ChemSpider | 748 | ||
| EC-број | 200-821-6 | ||
| 3Д-модел (Jmol) | Слика | ||
| KEGG | C01326 | ||
| MeSH | Водород+цијанид | ||
| PubChem | 768 | ||
| RTECS-бр. | MW6825000 | ||
| |||
| UNII | 2WTB3V159F | ||
| ОН-бр. | 1051 | ||
| Својства | |||
| Хемиска формула | |||
| Моларна маса | 0 g mol−1 | ||
| Изглед | Безбојна течност или гас | ||
| Мирис | Налик на бадем | ||
| Густина | 0.6876 g/cm3[3] | ||
| Точка на топење | |||
| Точка на вриење | |||
| Miscible | |||
| Растворливост во етанол | Miscible | ||
| Парен притисок | 100 kPa (25 °C)[3]:6.94 | ||
Хенриева константа (kH)
|
75 μmol Pa−1 kg−1 | ||
| Киселост (pKa) | 9.21 (во вода),
12.9 (in DMSO)[4] | ||
| Константа на базицитет (pKb) | 4.79 (цијанид анјон) | ||
| Конјуг. киселина | Хидроцијанониум | ||
| Конјуг. база | Цијанид | ||
| Показател на прекршување (nD) | 1.2675[5] | ||
| Вискозност | 0.183 mPa·s (25 °C)[3]:6.231 | ||
| Структура | |||
| Геометрија на молекулата | Линеарна | ||
| Диполен момент | 2.98 D | ||
| Термохемија | |||
| Ст. енталпија на формирање ΔfH |
135.1 kJ mol−1 | ||
| Стандардна моларна ентропија S |
201.8 J K−1 mol−1 | ||
| Специфичен топлински капацитет, C | 35.9 J K−1 mol−1 (гас)[3]:5.19 | ||
| Опасност | |||
| GHS-ознаки: | |||
Пиктограми
|
   
| ||
Сигнални зборови
|
Опасен | ||
Изјави за опасност
|
H225, H300, H310, H319, H330, H336, H370, H410 | ||
Изјави за претпазливост
|
P210, P261, P305+P351+P338 | ||
| NFPA 704 | |||
| Температура на запалување | {{{value}}} | ||
| 538 °C (1,000 °F; 811 K) | |||
| Граници на запалливост | 5.6% – 40.0%[6] | ||
| Смртоносна доза или концентрација: | |||
LC50 (средна концентрација)
|
501 ppm (стаорец, 5 мин) 323 ppm (глувче, 5 мин) 275 ppm (стаорец, 15 мин) 170 ppm (стаорец, 30 мин) 160 ppm (стаорец, 30 мин.) 323 ppm (стаорец, 5 мин)[7] | ||
LCLo (најниска објавена)
|
200 ppm (цицач, 5 мин) 36 ppm (цицач, 2 часа) 107 ppm (човек, 10 мин) 759 ppm (зајак, 1 мин) 759 ppm (мачка, 1 мин) 357 ppm (човечки, 2 мин) 179 ppm (човечки, 1 ч.)[7] | ||
| NIOSH (здравствени граници во САД): | |||
PEL (дозволива)
|
TWA 10 ppm (11 mg/m3) [skin][6] | ||
REL (препорачана)
|
ST 4.7 ppm (5 mg/m3) [skin][6] | ||
IDLH (непосредна опасност)
|
50 ppm[6] | ||
| Дополнителни податоци | |||
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |||
| Наводи | |||
Структура и општи својства уреди
Водород цијанидот е линеарна молекула, со тројна врска помеѓу јаглеродот и азот. Тавтомерот на HCN е HNC, водороден изоцијанид.
Водород цијанидот е слабо кисел со pKa од 9,2. Делумно се јонизира во воден раствор за да се добие анјон на цијанид, CN -. Растворот на водород цијанид во вода, претставен како HCN, се нарекува цијановодородна киселина. Солите на цијанидниот анјон се познати како цијаниди.
HCN има слаб мирис на горчлив бадем кој некои луѓе не можат да го детектираат поради рецесивна генетска одлика.[9] Испарливото соединение се користело како глодарицид за вдишување и човечки отров, како и за убивање на китови.[10] Цијанидните јони интерферираат со респираторните ензими што содржат железо.
Хемиски својства уреди
Водород цијанид ќе реагира со алкени при катализа на никел комплекси. Оваа реакција се нарекува хидроцијанизација.[11]
- RCH=CH 2 + HCN → RCH 2 -CH 2 -CN
Четири молекули на HCN ќе се тетрамеризираат во диаминомалеонитрил, кој може да се претвори во различни пурини.[12]
Историја на откривање уреди
Водород цијанидот првпат бил изолиран од синиот пигмент (пруско сино) кој бил познат уште од 1706 година, но чија структура била непозната. Сега е познато дека е координативен полимер со сложена структура и емпириска формула на хидриран железен фероцијанид. Во 1752 година, францускиот хемичар Пјер Макер направил важен чекор за да покаже дека пруската сина боја може да се претвори во железен оксид плус испарлива компонента и дека тие може да се искористат за нејзино реконституирање.[13] Новата компонента била она што сега е познато како водород цијанид. Следејќи го водството на Макер, тој првпат бил подготвен од пруско сино од шведскиот хемичар Карл Вилхелм Шеле во 1782 година,[14] и на крајот го добил германското име Blausäure (светло „Сина киселина“) поради неговата кисела природа во водата и деривирање од пруската сина боја. На англиски, популарно станала позната како прусинска киселина.
Во 1787 година, францускиот хемичар Клод Луј Бертоле покажал дека прусинската киселина не содржи кислород,[15] важен придонес во теоријата на киселина, која до тоа време се претпоставувало дека киселините мора да содржат кислород [16] (оттука и името на самиот кислород, што е добиени од грчки елементи што значат „создавач на киселина“ и исто така се пресметуваат на германски како Sauerstoff ). Во 1811 година, Џозеф Луис Геј-Лисак подготви чист, течен водород цијанид.[17] Во 1815 г., Геј-Лусик ја заклучил хемиската формула на пруска киселина.[18] Радикалниот цијанид во водород цијанид го добил своето име од цијан, не само англиски збор за нијанса на сино туку грчки збор за сино (старогрчки: κύανος), повторно поради неговото деривирање од пруската сина боја.
Производство и синтеза уреди
Водород цијанидот се формира во барем ограничени количини од многу комбинации на водород, јаглерод и амонијак. Водород цијанидот во моментов се произведува во големи количини со неколку процеси, како и обновен отпаден производ од производството на акрилонитрил.[8] Во 2006 година, во САД биле произведени помеѓу 500 милиони и 1 милијарди (помеѓу 230.000 и 450.000 t).[19]
Најважниот процес е Андрусовата оксидација измислена од Леонид Андрусов во ИГ Фарбен во која метанот и амонијакот реагираат во присуство на кислород на околу 1,200 °C (2.190 °F) над платина катализатор:[20]
- 2 CH 4 + 2 NH 3 + 3 O 2 → 2 HCN + 6 H 2 O
Енергијата потребна за реакцијата се обезбедува со делумна оксидација на метанот и амонијакот.
Од помала важност е процесот Дегуса (БМА процес) во кој не се додава кислород и енергијата мора индиректно да се пренесе преку ѕидот на реакторот:[21]
- CH 4 + NH 3 → HCN + 3H 2
Оваа реакција е слична на реформирањето на пареа, реакцијата на метанот и водата за давање јаглерод моноксид и водород.
Во Шавинигенскиот процес, јаглеводородите, на пр. пропанот, се реагираат со амонијак.
Во лабораторија, мали количини на HCN се произведуваат со додавање на киселини во цијанидните соли на алкалните метали:
- H + + NaCN → HCN + Na +
Оваа реакција понекогаш е основа за случајни труења бидејќи киселината конвертира неиспарлива цијанидна сол во гасовита HCN.
Историски методи на производство уреди
Големата побарувачка за цијаниди за рударски операции во 1890-тите била исполнета од Џорџ Томас Бејлби, кој патентирал метод за производство на водород цијанид со поминување на амонијак преку блескав јаглен во 1892 година. Овој метод се користел додека Хамилтон Кастнер во 1894 година не развил синтеза почнувајќи од јаглен, амонијак и натриум што дава натриум цијанид, кој реагира со киселина за да формира гасовит HCN.
Апликации уреди
HCN е претходник на натриум цијанид и калиум цијанид, кои се користат главно во ископувањето злато и сребро и за галванизација на тие метали. Преку посредство на цијанохидрините, различни корисни органски соединенија се подготвуваат од HCN вклучувајќи го мономерот метил метакрилат, од ацетон, аминокиселината метионин, преку синтезата на Strecker и хелатни агенси EDTA и NTA. Преку процесот на хидроцијација, HCN се додава во бутадиен за да се добие адипонитрил, претходник на најлон-6,6.[8]
HCN се користи на глобално ниво како фумигант против многу видови инсекти штетници кои ги напаѓаат капацитетите за производство на храна. И неговата ефикасност и начинот на примена доведуваат до употреба на многу мали количини на фумигант во споредба со другите токсични супстанции што се користат за истата намена.[22] Користењето на HCN како фумигант, исто така, има минимално влијание врз животната средина, во споредба со слични структурни фумигантни молекули како што се сулфурил флуорид,[23] и метил бромид.[24]
Појава уреди
HCN се добива од овошје што има јамка, како што се цреши, кајсии, јаболка и горчливи бадеми, од кои се добиваат бадемово масло и ароми. Многу од овие јами содржат мали количини на цијанохидрини како што се манделонитрил и амигдалин, кои полека ослободуваат водород цијанид.[25][26] Сто грама мелени семки од јаболка можат да дадат околу 70 mg HCN.[27] Таканаречените „горчливи“ корени на растението маниока може да содржат до 1 грам HCN на килограм.[28][29] Некои милипеди, како што се Harpaphe haydeniana, Desmoxytes purpurosea и Apheloria ослободуваат водород цијанид како одбранбен механизам,[30] како и одредени инсекти, како што се молците и ларвите на Paropsisterna eucalyptus.[31] Водород цијанид се содржува во издувните гасови на возилата и во чадот од согорувањето на пластиката што содржи азот.
HCN на Титан уреди
HCN е измерен во атмосферата на Титан со четири инструменти на вселенската сонда Касини, еден инструмент на Војаџер и еден инструмент на Земјата.[32] Едно од овие мерења било на самото место, каде што леталото Касини паднало помеѓу 1,000 и 1,100 км (620 и 680 mi) над површината на Титан за собирање на атмосферски гас за анализа со масена спектрометрија.[33] HCN првично се формирал во атмосферата на Титан преку реакција на фотохемиски произведените метан и азотни радикали кои продолжуваат низ H 2 CN посредник, на пр., (CH 3 + N → H 2 CN + H → HCN + H 2 ).[34][35] Ултравиолетовото зрачење го разложува HCN на CN + H; сепак, CN ефикасно се рециклира назад во HCN преку реакцијата CN + CH 4 → HCN + CH3.[34]
HCN на младата Земја уреди
Се претпоставува дека јаглеродот од каскада од астероиди (познат како доцно тешко бомбардирање ), како резултат на интеракцијата на Јупитер и Сатурн, ја разнел површината на младата Земја и реагирал со азот во атмосферата на Земјата за да формира HCN.[36]
HCN кај цицачите уреди
Некои автори покажале дека невроните можат да произведат водород цијанид при активирање на нивните опиоидни рецептори од ендогени или егзогени опиоиди. Тие исто така покажале дека невронското производство на HCN ги активира NMDA рецепторите и игра улога во трансдукцијата на сигналот помеѓу невронските клетки (невротрансмисија). Згора на тоа, зголеменото производство на ендогени невронски HCN под опиоиди било навидум потребно за адекватна опиоидна аналгезија, бидејќи аналгетското дејство на опиоидите било атенуирано од чистачите на HCN. Тие сметале дека ендогениот HCN е невромодулатор.[37]
Исто така, се покажало дека, додека стимулирањето на мускаринските холинергични рецептори во култивираните клетки на феохромоцитом го зголемува производството на HCN, во жив организам (in vivo) мускаринската холинергична стимулација всушност го намалува производството на HCN.[38]
Леукоцитите генерираат HCN за време на фагоцитозата и можат да убијат бактерии, габи и други патогени со генерирање на неколку различни токсични хемикалии, од кои едната е водород цијанид.[37]
Вазодилатација предизвикана од натриум нитропрусид се покажа дека е посредувана не само од генерирањето на NO, туку и од ендогеното генерирање на цијаниди, кое додава не само токсичност, туку и одредена дополнителна антихипертензивна ефикасност во споредба со нитроглицеринот и другите нецијаногени нитрати кои не предизвикуваат да се зголеми нивото на цијанид во крвта.[39]
HCN е составен дел на чадот од тутун.[40]
HCN и потеклото на животот уреди
Водород цијанидот е дискутиран како претходник на аминокиселините и нуклеинските киселини и се предлага дека играл улога во потеклото на животот.[41] Иако врската на овие хемиски реакции со потеклото на теоријата на животот останува шпекулативна, студиите во оваа област довеле до откритија на нови патишта до органски соединенија добиени од кондензацијата на HCN (на пр. Аденин).[42]
HCN во вселената уреди
HCN е откриен во меѓуѕвездената средина [43] и во атмосферите на јаглеродните ѕвезди.[44] Оттогаш, обемни студии ги испитувале патиштата на формирање и уништување на HCN во различни средини и ја испитувале неговата употреба како трагач за различни астрономски видови и процеси. HCN може да се набљудува од телескопи на земја преку голем број атмосферски прозорци.[45] Сите J=1→0, J=3→2, J= 4→3 и J=10→9 чисти ротациони транзиции се забележани.[43][46][47]
HCN се формира во меѓуѕвездени облаци преку една од двете главни патишта:[48] преку неутрално-неутрална реакција (CH 2 + N → HCN + H) и преку дисоцијативна рекомбинација (HCNH + + e - → HCN + H). Дисоцијативната патека на рекомбинација е доминантна за 30%; сепак, HCNH <sup id="mwAZA">+</sup> мора да биде во линеарна форма. Дисоцијативната рекомбинација со неговиот структурен изомер, H 2 NC +, исклучиво произведува водороден изоцијанид (HNC).
HCN се уништува во меѓуѕвездените облаци преку голем број механизми во зависност од локацијата во облакот.[48] Во регионите доминирани од фотони (PDRs), доминира фотодисоцијацијата, произведувајќи CN (HCN + ν → CN + H). На понатамошни длабочини, фотодисоцијацијата со космичките зраци доминира, произведувајќи CN (HCN + cr → CN + H). Во темното јадро, два конкурентни механизми го уништуваат, формирајќи HCN + и HCNH + (HCN + H + → HCN + + H; HCN + HCO + → HCNH + + CO). Реакцијата со HCO + доминира со фактор ~3,5. HCN се користи за анализа на различни видови и процеси во меѓуѕвездената средина. Предложено е како трагач за густ молекуларен гас [49][50] и како трагач на ѕвезден прилив во областите што формираат ѕвезди со висока маса.[51] Понатаму, соодносот HNC/HCN се покажал како одличен метод за разликување помеѓу PDR и региони доминирани со Х-зраци (XDRs).[52]
На 11 август 2014 година, астрономите објавиле студии, користејќи ја Големата милиметарска/подмилиметарска низа Атакама (ALMA) за прв пат, кои ја детализирале дистрибуцијата на HCN, HNC, H2CO и прашината во комата на кометите C/2012 F6 ( Lemmon) и C/2012 S1 (ISON).[53][54]
Во февруари 2016 година, било објавено дека траги од водород цијанид се пронајдени во атмосферата на жешката Супер-Земја 55 Cancri e со вселенскиот телескоп Хабл на НАСА.[55]
Како отров и хемиско оружје уреди
Во Првата светска војна, водород цијанидот го користеле Французите од 1916 година како хемиско оружје против Централните сили, а САД и Италија во 1918 година. Се покажало дека не е доволно ефикасен поради временските услови.[56][57] Гасот е полесен од воздухот и брзо се распрснува во атмосферата. Брзото разредување ја направило неговата употреба на терен непрактична. Спротивно на тоа, погустите агенси како фосген или хлор имаат тенденција да останат на нивото на земјата и да потонат во рововите на боиштата на Западниот фронт. Во споредба со таквите средства, водород цијанидот морало да биде присутен во повисоки концентрации за да биде фатален.
Концентрацијата на водород цијанид од 100-200 ppm во воздухот што вдишува ќе убие човек во рок од 10 до 60 минути. Концентрација на водород цијанид од 2000 ppm (околу 2380 mg/m 3 ) ќе убие човек за околу една минута. Токсичниот ефект е предизвикан од дејството на цијанидниот јон, кој го запира клеточното дишење. Дејствува како неконкурентен инхибитор за ензимот во митохондриите наречен цитохром c оксидаза. Како таков, водород цијанидот е вообичаено наведен меѓу хемиското оружје како крвен агенс.[58]
Конвенцијата за хемиско оружје го наведува во Распоред 3 како потенцијално оружје што има индустриска употреба од големи размери. Земјите потписнички мора да пријават производствени погони кои произведуваат повеќе од 30 метрички тони годишно и да дозволат инспекција од Организацијата за забрана на хемиско оружје.
Можеби неговата најозлогласена употреба е Zyklon B (германски: Циклон Б, со Б што значи Blausäure - прусинска киселина; исто така, за да се разликува од претходниот производ подоцна познат како Zyklon A),[59] користен во нацистичките германски логори за истребување за време на Втората светска војна за масовно убивање како дел од нивната програма за геноцид за конечно решение. Водород цијанид исто така се користел во камповите за излачување облека во обиди да се искорени болестите што ги носат вошките и другите паразити. Еден од оригиналните чешки производители продолжи да го прави Zyklon B под трговската марка „Uragan D2“ [60] до околу 2015 година [61]
За време на Втората светска војна, САД размислувале да го користат, заедно со цијаноген хлорид, како дел од Операцијата Даунфол, планираната инвазија на Јапонија, но претседателот Хари Труман се решил против тоа, наместо да ги користи атомските бомби развиени од тајниот проект Менхетен.[62]
Водород цијанидот исто така било средството кое се користело во судските дејствија во некои американски држави, каде што бил произведен за време на извршувањето со дејство на сулфурна киселина на натриум или калиум цијанид.[63]
Под името прусинска киселина, HCN се користел како убиствен агенс во харпуните на китови, иако се покажал доста опасен за екипажот што го распоредувал и брзо бил напуштен.[10] Од средината на 18 век се користел во голем број убиства со труење и самоубиства.[64]
Гасот водород цијанид во воздухот е експлозивен при концентрации над 5,6%.[65] Оваа концентрација е далеку над токсичното ниво.
Наводи уреди
- ↑ „Hydrogen Cyanide – Compound Summary“. PubChem Compound. United States: National Center for Biotechnology Information. 16 September 2004. Identification. Посетено на 2012-06-04.
- ↑ „hydrogen cyanide (CHEBI:18407)“. Chemical Entities of Biological Interest. UK: European Bioinformatics Institute. 18 October 2009. Main. Посетено на 2012-06-04.
- ↑ 3,0 3,1 3,2 3,3 Haynes, William M., уред. (2011). CRC Handbook of Chemistry and Physics (92nd. изд.). CRC Press. ISBN 978-1439855119.
- ↑ Evans DA. „pKa's of Inorganic and Oxo-Acids“ (PDF). Архивирано (PDF) од изворникот 2022-10-09. Посетено на June 19, 2020.
- ↑ Patnaik P (2002). Handbook of Inorganic Chemicals. McGraw-Hill. ISBN 978-0070494398.
- ↑ 6,0 6,1 6,2 6,3 „Џебен водич за опасните хемиски материи #0333“. Национален институт за безбедност и здравје при работа (NIOSH). (англиски)
- ↑ 7,0 7,1 „Hydrogen cyanide“. Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ 8,0 8,1 8,2 „Cyano Compounds, Inorganic“, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH
- ↑ „Cyanide, inability to smell“. Online Mendelian Inheritance in Man. Посетено на 2010-03-31.
- ↑ 10,0 10,1 „Poison Harpoons“. Whalecraft.net. Архивирано од изворникот на 2019-02-15.
- ↑ Leeuwen, P. W. N. M. van (2004). Homogeneous catalysis : understanding the art. Dordrecht: Kluwer Academic Publishers. ISBN 1402019998. OCLC 54966334.
- ↑ Bray, D; Robbins, P (1967). „Mechanism of ε15 conversion studied with bacteriophage mutants“. Journal of Molecular Biology. Elsevier BV. 30 (2): 457–475. doi:10.1016/s0022-2836(67)80037-8. ISSN 0022-2836.
- ↑ „Éxamen chymique de bleu de Prusse“ [Chemical examination of Prussian blue]. Mémoires de l'Académie royale des Sciences (French): 60–77. 1756.CS1-одржување: непрепознаен јазик (link)
- ↑ „Försök, beträffande det färgande ämnet uti Berlinerblå“ [Experiment concerning the coloring substance in Berlin blue]. Kungliga Svenska Vetenskapsakademiens Handlingar (Royal Swedish Academy of Science's Proceedings (Swedish). 3: 264–275. 1782.CS1-одржување: непрепознаен јазик (link)
- ↑ „Mémoire sur l'acide prussique“ [Memoir on prussic acid]. Mémoires de l'Académie Royale des Sciences (French): 148–161. 1789.CS1-одржување: непрепознаен јазик (link)
- ↑ „Claude Louis Berthollet: A Great Chemist in the French Tradition“. Canadian Chemical News. 1999-11-01. Архивирано од изворникот на 2008-04-20. Посетено на 2010-03-31.
- ↑ „Note sur l'acide prussique“ [Note on prussic acid]. Annales de Chimie. 44: 128–133. 1811.
- ↑ „Recherche sur l'acide prussique“ [Research on prussic acid]. Annales de Chimie. 95: 136–231. 1815.
- ↑ Non-confidential 2006 IUR Records by Chemical, including Manufacturing, Processing and Use Information.
- ↑ „The catalytic oxydation of ammonia-methane-mixtures to hydrogen cyanide“. Angewandte Chemie. 48 (37): 593–595. 1935. doi:10.1002/ange.19350483702.
- ↑ „Die technische Synthese von Cyanwasserstoff aus Methan und Ammoniak ohne Zusatz von Sauerstoff“. Chemie Ingenieur Technik. 30 (5): 305–310. 1958. doi:10.1002/cite.330300506.
- ↑ „Manual of fumigation for insect control – Space fumigation at atmospheric pressure (Cont.)“. Fao.org.
- ↑ „New greenhouse gas identified“. News.mit.edu.
- ↑ „Chapter 10 : Methyl Bromide“ (PDF). Csl.noaa.gov. Архивирано од изворникот (PDF) на 2022-10-09.
- ↑ „Plant cyanogenic glycosides“. Toxicon. 38 (1): 11–36. January 2000. doi:10.1016/S0041-0101(99)00128-2. PMID 10669009.
- ↑ „Why are so many food plants cyanogenic?“. Phytochemistry. 47 (2): 155–162. January 1998. doi:10.1016/S0031-9422(97)00425-1. PMID 9431670.
- ↑ „Are Apple Cores Poisonous?“. The Naked Scientists. 26 September 2010. Архивирано од изворникот на 6 March 2014. Посетено на 6 March 2014.
- ↑ „The toxic effects of cassava (manihot esculenta grantz) diets on humans: a review“. Veterinary and Human Toxicology. 33 (3): 274–275. June 1991. PMID 1650055.
- ↑ „Cyanogenesis in cassava. The role of hydroxynitrile lyase in root cyanide production“. Plant Physiology. 116 (4): 1219–1225. April 1998. doi:10.1104/pp.116.4.1219. PMC 35028. PMID 9536038.
- ↑ „Secretion of Benzaldehyde and Hydrogen Cyanide by the Millipede Pachydesmus crassicutis (Wood)“. Science. 138 (3539): 512–513. October 1962. Bibcode:1962Sci...138..512B. doi:10.1126/science.138.3539.512. PMID 17753947.
- ↑ „Cyanogenesis in Arthropods: From Chemical Warfare to Nuptial Gifts“. Insects. 9 (2): 51. May 2018. doi:10.3390/insects9020051. PMC 6023451. PMID 29751568.
- ↑ „The neutral photochemistry of nitriles, amines and imines in the atmosphere of Titan“. Icarus. 247: 218–247. February 2015. Bibcode:2015Icar..247..218L. doi:10.1016/j.icarus.2014.09.039.CS1-одржување: display-автори (link)
- ↑ „INMS-derived composition of Titan's upper atmosphere: Analysis methods and model comparison“. Planetary and Space Science. 57 (14–15): 1895–1916. December 2009. Bibcode:2009P&SS...57.1895M. doi:10.1016/j.pss.2009.06.016.
- ↑ 34,0 34,1 „HCN Production in Titan's Atmosphere: Coupling Quantum Chemistry and Disequilibrium Atmospheric Modeling“. Astrophysical Journal. 901 (2): 110. 2020. arXiv:2008.04312. Bibcode:2020ApJ...901..110P. doi:10.3847/1538-4357/abae5c.
- ↑ „A Consistent Reduced Network for HCN Chemistry in Early Earth and Titan Atmospheres: Quantum Calculations of Reaction Rate Coefficients“. The Journal of Physical Chemistry A. 123 (9): 1861–1873. March 2019. arXiv:1902.05574. Bibcode:2019JPCA..123.1861P. doi:10.1021/acs.jpca.8b11323. PMID 30721064.
- ↑ „Making Sense of the Chemistry That Led to Life on Earth“. The New York Times. 2015-05-04. Посетено на 5 May 2015.
- ↑ 37,0 37,1 „Hydrogen cyanide generation by mu-opiate receptor activation: possible neuromodulatory role of endogenous cyanide“. Brain Research. 768 (1–2): 294–300. September 1997. doi:10.1016/S0006-8993(97)00659-8. PMID 9369328.
- ↑ „Receptor mechanisms mediating cyanide generation in PC12 cells and rat brain“. Neuroscience Research. 49 (1): 13–18. May 2004. doi:10.1016/j.neures.2004.01.006. PMID 15099699.
- ↑ „Toxicology of some inorganic antihypertensive anions“. Federation Proceedings. 35 (1): 69–72. January 1976. PMID 1245233.
- ↑ „Hazardous compounds in tobacco smoke“. International Journal of Environmental Research and Public Health. 8 (2): 613–628. February 2011. doi:10.3390/ijerph8020613. PMC 3084482. PMID 21556207.
- ↑ Ruiz-Bermejo, Marta; Zorzano, María-Paz; Osuna-Esteban, Susana (2013). „Simple Organics and Biomonomers Identified in HCN Polymers: An Overview“. Life. 3 (3): 421–448. doi:10.3390/life3030421. PMC 4187177. PMID 25369814.
- ↑ „The Chemistry of Diaminomaleonitrile and its Utility in Heterocyclic Synthesis“. Tetrahedron. 59 (16): 2749–2763. 2003. doi:10.1016/S0040-4020(03)00153-4.
- ↑ 43,0 43,1 „Observations of Radio Emission from Interstellar Hydrogen Cyanide“. Astrophysical Journal. 163: L47–L52. 1971. Bibcode:1971ApJ...163L..47S. doi:10.1086/180664.
- ↑ Jørgensen UG (1997). „Cool Star Models“. Во van Dishoeck EF (уред.). Molecules in Astrophysics: Probes and Processes. International Astronomical Union Symposia. Molecules in Astrophysics: Probes and Processes. 178. Springer Science & Business Media. стр. 446. ISBN 978-0792345381.
- ↑ „Upper limits to trace constituents in Jupiter's atmosphere from an analysis of its 5-μm spectrum“. Icarus. 34 (2): 331–343. 1978. Bibcode:1978Icar...34..331T. doi:10.1016/0019-1035(78)90171-9.
- ↑ „Submillimeter‐ and Millimeter‐Wavelength Observations of SiO and HCN in Circumstellar Envelopes of AGB Stars“. Astrophysical Journal. 543 (2): 897–921. 2000. Bibcode:2000ApJ...543..897B. doi:10.1086/317129.
- ↑ „Detection of a Second, Strong Sub-millimeter HCN Laser Line toward Carbon Stars“. Astrophysical Journal. 583 (1): 446–450. 2003. Bibcode:2003ApJ...583..446S. doi:10.1086/345099.
- ↑ 48,0 48,1 „CN and HCN in Dense Interstellar Clouds“. Astrophysical Journal. 632 (1): 302–315. 2005. arXiv:astro-ph/0506535. Bibcode:2005ApJ...632..302B. doi:10.1086/432864.
- ↑ „The Star Formation Rate and Dense Molecular Gas in Galaxies“. Astrophysical Journal. 606 (1): 271–290. 2004. arXiv:astro-ph/0310339. Bibcode:2004ApJ...606..271G. doi:10.1086/382999.
- ↑ „HCN Survey of Normal Spiral, Infrared‐luminous, and Ultraluminous Galaxies“. Astrophysical Journal Supplement Series. 152 (1): 63–80. 2004. arXiv:astro-ph/0310341. Bibcode:2004ApJS..152...63G. doi:10.1086/383003.
- ↑ „Indications of Inflow Motions in Regions Forming Massive Stars“. Astrophysical Journal. 592 (2): L79–L82. 2003. arXiv:astro-ph/0306543. Bibcode:2003ApJ...592L..79W. doi:10.1086/377679.
- ↑ „Molecular properties of (U)LIRGs: CO, HCN, HNC and HCO+“. Proceedings IAU Symposium. 242: 462–466. 2007. arXiv:0709.3423. Bibcode:2007IAUS..242..462L. doi:10.1017/S1743921307013609.
- ↑ „Release 14-038 – NASA's 3-D Study of Comets Reveals Chemical Factory at Work“. NASA. 11 August 2014. Посетено на 12 August 2014.
- ↑ „Mapping the Release of Volatiles in the Inner Comae of Comets C/2012 F6 (Lemmon) and C/2012 S1 (ISON) Using the Atacama Large Millimeter/Submillimeter Array“. The Astrophysical Journal. 792 (1): L2. 11 August 2014. arXiv:1408.2458. Bibcode:2014ApJ...792L...2C. doi:10.1088/2041-8205/792/1/L2.CS1-одржување: display-автори (link)
- ↑ „First detection of super-earth atmosphere“. ESA/Hubble Information Centre. February 16, 2016.
- ↑ Schnedlitz, Markus (2008) Chemische Kampfstoffe: Geschichte, Eigenschaften, Wirkung.
- ↑ Weapons of War - Poison Gas. firstworldwar.com
- ↑ „Hydrogen Cyanide“. Organisation for the Prohibition of Chemical Weapons. Посетено на 2009-01-14.
- ↑ Dwork D, van Pelt RJ (1996). Auschwitz, 1270 to the present. Norton. стр. 443. ISBN 978-0-l393039337 Проверете ја вредноста
|isbn=: invalid character (help). - ↑ „Blue Fume“. Chemical Factory Draslovka a.s. Посетено на 2020-07-06.
- ↑ „Ursgan D2“. 2015-07-17. Архивирано од изворникот на 2015-07-17. Посетено на 2022-10-19.
- ↑ Binkov's Battlegrounds (April 27, 2022). „How would have WW2 gone if the US had not used nuclear bombs on Japan?“. YouTube.Com. Посетено на June 23, 2022.
- ↑ „Arizona 'refurbishes' its gas chamber to prepare for executions, documents reveal“. The Guardian. Посетено на 2022-06-14.
- ↑ „The Poison Garden website“. Thepoisongarden.co.uk. Архивирано од изворникот на 10 February 2020. Посетено на 18 October 2014.
- ↑ „Documentation for Immediately Dangerous to Life or Health Concentrations (IDLHs) – 74908“. NIOSH. 2 November 2018.
Надворешни врски уреди
- Национален институт за решерче и безбедност (1997). " Cyanure d'hydrogène et solutions aqueuses ". Фише токсикологија бр. 4, Париз: INRS, 5 стр. (PDF датотека, на француски )
- Меѓународна хемиска безбедносна картичка 0492
- Водород цијанид и цијаниди ( CICAD 61)
- Национален инвентар на загадувачи: информативен лист за соединенија на цијанид
- NIOSH Џебен водич за хемиски опасности
- Одделот за здравствен преглед
- Густина на гасот водород цијанид


