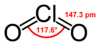
Хлор диоксид
Хлор диоксид — хемиско соединение со формула ClO2 кое постои како жолтеникаво-зелен гас над 11 °C, црвено-кафеава течност помеѓу 11 °C и −59 °C и како светло портокалови кристали под -59 °C. Обично се ракува како воден раствор. Исто така, најчесто се користи како белило. Поновите случувања ја прошириле неговата примена во преработката на храна и како средство за дезинфекција.
| |||

| |||
Назив според МСЧПХ Хлор диоксид | |||
Други називи Хлор(IV) оксид | |||
| Назнаки | |||
|---|---|---|---|
| 10049-04-4 | |||
| ChEBI | CHEBI:29415 | ||
| ChemSpider | 23251 | ||
| EC-број | 233-162-8 | ||
| 1265 | |||
| |||
| 3Д-модел (Jmol) | Слика Слика | ||
| MeSH | + диоксид Хлор + диоксид | ||
| PubChem | 24870 | ||
| RTECS-бр. | FO3000000 | ||
| |||
| UNII | 8061YMS4RM | ||
| ОН-бр. | 9191 | ||
| Својства | |||
| Хемиска формула | |||
| Моларна маса | 0 g mol−1 | ||
| Изглед | Гас од жолт до црвеникав | ||
| Мирис | Acrid | ||
| Густина | 2.757 g dm−3 | ||
| Точка на топење | |||
| Точка на вриење | |||
| 8 g/L at 20 °C | |||
| Растворливост | Растворлив во алкални раствори и сулфурна киселина | ||
| Парен притисок | >1 atm[1] | ||
Хенриева константа (kH)
|
0,04 atm m3 mol−1 | ||
| Киселост (pKa) | 3.0(5) | ||
| Термохемија | |||
| Ст. енталпија на формирање ΔfH |
104.60 kJ/mol | ||
| Стандардна моларна ентропија S |
257.22 J K−1 mol−1 | ||
| Опасност | |||
| Безбедност при работа: | |||
Главни опасности
|
Високо токсичен, корозивен, нестабилен, моќен оксидатор | ||
| GHS-ознаки: | |||
Пиктограми
|
  
| ||
Сигнални зборови
|
Опасен | ||
Изјави за опасност
|
H271, H300+H310+H330, H314, H372 | ||
Изјави за претпазливост
|
P210, P220, P260, P264, P271, P280, P283, P284, P301+P310, P304+P340, P305+P351+P338, P306+P360, P371+P380+P375, P403+P233, P405, P501 | ||
| NFPA 704 | |||
| Смртоносна доза или концентрација: | |||
LD50 (средна доза)
|
94 mg/kg (орално, стаорец)[2] | ||
LCLo (најниска објавена)
|
260 ppm (стаорец, 2 ч)[3] | ||
| NIOSH (здравствени граници во САД): | |||
PEL (дозволива)
|
TWA 0.1 ppm (0.3 mg/m3)[1] | ||
REL (препорачана)
|
TWA 0.1 ppm (0.3 mg/m3) ST 0.3 ppm (0.9 mg/m3)[1] | ||
IDLH (непосредна опасност)
|
5 ppm[1] | ||
| Безбедносен лист | Safety Data Sheet Archive. | ||
| Дополнителни податоци | |||
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |||
| Наводи | |||
Структура и поврзување уреди
Молекулата ClO2 има непарен број на валентни електрони и затоа е парамагнетски радикал. Тоа е необичен „пример за молекула со непарен електрон која е стабилна кон димеризација“ (азотен оксид е друг пример).
Во 1933 година, Лоренс О. Броквеј, дипломиран студент на Линус Полинг, предложи структура која вклучува три-електронска врска и две единечни врски.[4] Сепак, Полинг во неговата Општа хемија покажува двојна врска со едниот кислород и единечна врска плус три-електронска врска со другата. Структурата на валентната врска би била претставена како резонантен хибрид прикажан од Полинг.[5] Три-електронската врска претставува врска која е послаба од двојната врска. Во теоријата на молекуларната орбитала оваа идеја е вообичаена ако третиот електрон е поставен во орбитала против сврзување. Подоцнежната работа потврдиla дека највисоката окупирана молекуларна орбитала е навистина нецелосно исполнета антиврзувачка орбитала.[6]
Кристалната структура на ClO2 е орторомбна и ја прикажува симетријата на вселенската група Pbca .[7]
Подготовка уреди
Хлор диоксидот првпат бил подготвен во 1811 година од Сер Хемфри Дејви.[8]
Хлор диоксидот е соединение кое може насилно да се распаѓа кога се одвојува од разредувачките материи. Како резултат на тоа, често се претпочитаат методи на подготовка кои вклучуваат производство на раствори од него без да помине низ фаза на гасна фаза.
Оксидација на хлорит уреди
Во лабораторија, ClO2 може да се подготви со оксидација на натриум хлорит со хлор:[9]
Традиционално, хлор диоксидот за дезинфекција е направен од натриум хлорит или методот натриум хлорит- хипохлорит:
или методот на натриум хлорит- хлороводородна киселина:
или методот на хлорит -сулфурна киселина :
Сите три методи можат да произведат хлор диоксид со висок принос на конверзија на хлорит. За разлика од другите процеси, методот хлорит-сулфурна киселина е целосно без хлор, иако страда од потребата од 25% повеќе хлорит за производство на еквивалентна количина на хлор диоксид. Алтернативно, водород пероксид може ефикасно да се користи во мали апликации.[10]
Додавањето на сулфурна киселина или која било силна киселина во хлорните соли произведува хлор диоксид.[5]
Намалување на хлорат уреди
Во лабораторија, хлор диоксидот може да се подготви и со реакција на калиум хлорат со оксална киселина:
или со оксална и сулфурна киселина:
Над 95% од хлор диоксидот произведен во светот денес е направен со редукција на натриум хлорат, за употреба во белење на пулпа. Се произведува со висока ефикасност во раствор на силна киселина со соодветно средство за намалување како што се метанол, водороден пероксид, хлороводородна киселина или сулфур диоксид. Современите технологии се засноваат на метанол или водород пероксид, бидејќи овие хемикалии овозможуваат најдобра економичност и не копроизведуваат елементарен хлор. Целокупната реакција може да се запише како:
Како типичен пример, се верува дека реакцијата на натриум хлорат со хлороводородна киселина во еден реактор се одвива низ следниот пат:
што ја дава целокупната реакција
Комерцијално поважниот пат на производство користи метанол како средство за намалување и сулфурна киселина за киселост. Двете предности од некористењето на процесите засновани на хлорид се тоа што нема формирање на елементарен хлор и дека натриум сулфатот, вредна хемикалија за мелницата за пулпа, е спореден производ. Овие процеси базирани на метанол обезбедуваат висока ефикасност и може да се направат многу безбедни.[10]
Варијантен процес кој користи натриум хлорат, водород пероксид и сулфурна киселина се повеќе се користи од 1999 година за третман на вода и други апликации за дезинфекција од мали размери, бидејќи произведува производ без хлор со висока ефикасност, над 95%.
Други процеси уреди
Многу чист хлор диоксид може да се произведе и со електролиза на раствор од хлорит:[11]
Гасот хлор диоксид со висока чистота (7,7% во воздух или азот) може да се произведе со методот гас-цврст, кој реагира на разредениот гас на хлор со цврст натриум хлорит:[11]
Својства за ракување уреди
При парцијални притисоци над 10 килопаскали (или концентрации во гасна фаза поголеми од 10% волумен во воздухот на STP ) на ClO2 може експлозивно да се распадне на хлор и кислород. Распаѓањето може да се иницира со светлина, жаришта, хемиска реакција или шок од притисок. Така, хлор диоксидот никогаш не се постапува како чист гас, туку речиси секогаш се ракува во воден раствор во концентрации помеѓу 0,5 и 10 грама на литар. Неговата растворливост се зголемува при пониски температури, па затоа е вообичаено да се користи разладена вода (5 °C, 41 °F) кога се складира во концентрации над 3 грама на литар. Во многу земји, како што се Соединетите Американски Држави, хлор диоксидот може да не се транспортира во никаква концентрација и наместо тоа, речиси секогаш се произведува на лице место.[10] Во некои земји, раствори на хлор диоксид под 3 грамови на литар во концентрација може да се транспортираат по копно, но тие се релативно нестабилни и брзо се влошуваат.
Употреба уреди
Хлор диоксидот се користи за белење на дрвната маса и за дезинфекција (наречена хлорирање) на општинската вода за пиење,[12][13] :4-1[14] третман на вода во апликации за нафта и гас, дезинфекција во прехранбената индустрија, микробиолошка контрола во кули за ладење и белење на текстил.[15] Како средство за дезинфекција, тој е ефикасен дури и при ниски концентрации поради неговите уникатни квалитети.[13][15]
Белење уреди
Хлор диоксидот понекогаш се користи за белење на дрвната маса во комбинација со хлор, но се користи сам во секвенците на белење ECF. Се користи при умерено кисела pH вредност (3,5 до 6). Употребата на хлор диоксид ја минимизира количината на произведени органохлорни соединенија.[16] Хлор диоксидот (технологија ECF) во моментов е најважниот метод за белење во светот. Околу 95% од целата изветвена крафт-пулпа е направена со користење на хлор диоксид во секвенците за белење на ECF.[17]
Хлор диоксидот се користи за белење на брашното .[18]
Третман на вода уреди
Прочистителната станица во Нијагарините водопади, Њујорк првпат користела хлор диоксид за третман на вода за пиење во 1944 година за уништување на „фенолни соединенија што произведуваат вкус и мирис“.[13] :4-17[14] Хлор диоксидот бил воведен како средство за дезинфекција на водата за пиење во голем обем во 1956 година, кога Брисел, Белгија, се промени од хлор во хлор диоксид.[14] Нејзината најчеста употреба во третман на вода е како предоксиданс пред хлорирање на водата за пиење за да се уништат природните водени нечистотии кои инаку би произведувале трихалометани при изложеност на слободен хлор.[19][20][21] Трихалометаните се сомнителни канцерогени нуспроизводи за дезинфекција [22] поврзани со хлорирање на природни органски материи во сирова вода.[21] Хлор диоксидот, исто така, произведува 70% помалку халометани во присуство на природна органска материја во споредба со кога се користи елементарен хлор или белило.[23]
Хлор диоксидот е исто така супериорен во однос на хлорот кога работи над pH 7,[13] :4-33во присуство на амонијак и амини,[24] и за контрола на биофилмовите во системите за дистрибуција на вода.[21] Хлор диоксидот се користи во многу индустриски апликации за третман на вода како биоцид, вклучувајќи кули за ладење, процесна вода и преработка на храна.[25]
Хлор диоксидот е помалку корозивен од хлорот и е супериорен за контрола на бактериите Легионела.[14][26] Хлор диоксидот е супериорен во однос на некои други секундарни методи за дезинфекција на вода, со тоа што на хлор диоксидот не влијае негативно pH вредноста, не ја губи ефикасноста со текот на времето, бидејќи бактериите нема да растат отпорни на него) и нема негативно влијание од силициум диоксид и фосфати кои најчесто се користат инхибитори на корозија со вода за пиење. Во САД, тој е биоцид регистриран во EPA.
Тој е поефикасен како средство за дезинфекција од хлорот во повеќето околности против патогени агенси кои се пренесуваат преку вода, како што се вируси,[27] бактерии и протозои - вклучувајќи ги цистите на Giardia и ооцистите на Cryptosporidium.[13] :4-20–4-21
Употребата на хлор диоксид во третман на вода доведува до формирање на нуспроизвод хлорит, кој моментално е ограничен на максимум 1 дел на милион во водата за пиење во САД.[13] :4-33Овој стандард на EPA ја ограничува употребата на хлор диоксид во САД на релативно висококвалитетна вода, бидејќи тоа ја минимизира концентрацијата на хлорит, или водата што треба да се третира со коагуланси на база на железо, бидејќи железото може да го редуцира хлоритот во хлорид.[28] Светската здравствена организација советува и дозирање од 1 ppm.[23]
Употреба во јавни кризи уреди
Хлор диоксидот има многу примени како оксидатор или средство за дезинфекција. Хлор диоксидот може да се користи за дезинфекција на воздухот [29] и бил главниот агенс што се користел при деконтаминација на зградите во Соединетите држави по нападите на антракс во 2001 година.[30] По катастрофата на ураганот Катрина во Њу Орлеанс, Луизијана и околниот Заливски брег, хлор диоксидот бил искористен за искоренување на опасната мувла од куќите поплавени од поплавата.[31]
Во однос на пандемијата СОВИД-19, Агенцијата за заштита на животната средина на САД објавила список со многу средства за дезинфекција кои ги исполнуваат нејзините критериуми за употреба во мерките за животна средина против предизвикувачкиот коронавирус.[32][33] Некои се базираат на натриум хлорит кој се активира во хлор диоксид, иако во секој производ се користат различни формулации. Многу други производи на списокот ЕПА содржат натриум хипохлорит, кој е сличен по име, но не треба да се меша со натриум хлорит бидејќи тие имаат многу различни начини на хемиско дејство.
Други употреби за дезинфекција уреди
Хлор диоксидот може да се користи како фумигантен третман за „дезинфицирање“ на овошја како што се боровинки, малини и јагоди кои развиваат мувла и квасец.[34]
Хлор диоксидот може да се користи за дезинфекција на живината со прскање или потопување по колењето.[35]
Хлор диоксидот може да се користи за дезинфекција на ендоскопи, како на пример под трговското име Tristel.[36] Достапно е и во трио кое се состои од претходно претходно чистење со сурфактант и следно плакнење со дејонизирана вода и антиоксиданс со ниско ниво.[37]
Хлор диоксидот може да се користи за контрола на зебра и квага школки во внесот на вода.[13] :4-34
Се покажало дека хлор диоксидот е ефикасен во искоренувањето на бубачки.[38]
За прочистување на водата за време на кампување, таблетите за дезинфекција кои содржат хлор диоксид се поефикасни против патогени од оние кои користат белило за домаќинство, но обично чинат повеќе.[39][40]
Други употреби уреди
Хлор диоксидот се користи како оксиданс за уништување на фенолите во тековите на отпадните води и за контрола на мирисот во чистењето на воздухот на растенијата од животински нуспроизводи.[13] :4-34Достапен е и за употреба како дезодоранс за автомобили и чамци, во пакувања кои генерираат хлор диоксид кои се активираат со вода и се оставаат во чамецот или автомобилот преку ноќ.
Безбедносни прашања во вода и додатоци уреди
Потенцијалните опасности со хлор диоксид вклучуваат труење и ризик од спонтано палење или експлозија при контакт со запаливи материјали.[41][42]
Хлор диоксидот е токсичен и потребни се ограничувања на човечката изложеност за да се обезбеди негова безбедна употреба. Агенцијата за заштита на животната средина на САД поставила максимално ниво од 0,8 mg/L за хлор диоксид во водата за пиење.[43] Управата за безбедност и здравје при работа (OSHA), агенција на Министерството за труд на Соединетите Американски Држави, поставила 8-часовна дозволена граница на изложеност од 0,1 ppm во воздухот (0,3 mg / m 3 ) за луѓе кои работат со хлор диоксид.[44]
Хлор диоксидот е лажно и незаконски продаван како лек што може да се проголта за широк спектар на болести, вклучувајќи го детскиот аутизам [45] и коронавирусот.[46][47][48] Децата на кои им била дадена клизма на хлор диоксид како наводен лек за детскиот аутизам, претрпеле болести опасни по живот.[45] Американската Администрација за храна и лекови (ФДА) изјавила дека ингестијата или друга внатрешна употреба на хлор диоксид, надвор од надгледувано орално плакнење со разредена концентрација, нема никакви здравствени придобивки и не треба да се користи внатрешно од која било причина.[49][50]
Псевдомедицина уреди
На 30 јули и 1 октомври 2010 година, Управата за храна и лекови на САД предупредилада не се користи производот „Miracle Mineral Supplement“ или „MMS“, кој кога се подготвува според упатствата произведува хлор диоксид. ММС се продава како третман за различни состојби, вклучително и ХИВ, рак, аутизам, акни и од неодамна, СОВИД-19. Многумина се пожалиле на ФДА, известувајќи за опасни по живот реакции,[51] па дури и смрт.[52] ФДА ги предупредила потрошувачите дека ММС може да предизвика сериозна штета на здравјето и изјавила дека добила бројни извештаи за гадење, дијареа, сериозно повраќање и опасен по живот низок крвен притисок предизвикан од дехидрација.[53][54] Ова предупредување било повторено по трет пат на 12 август 2019 година и четврти пат на 8 април 2020 година, наведувајќи дека внесувањето MMS е подеднакво опасно како и внесувањето белило и ги повикува потрошувачите да не ги користат или да ги даваат овие производи на своите деца од која било причина., бидејќи не постојат научни докази кои покажуваат дека хлор диоксидот има некои корисни медицински својства.[50][55]
Наводи уреди
- ↑ 1,0 1,1 1,2 1,3 „Џебен водич за опасните хемиски материи #0116“. Национален институт за безбедност и здравје при работа (NIOSH). (англиски)
- ↑ Dobson, Stuart; Cary, Richard; International Programme on Chemical Safety (2002). Chlorine dioxide (gas). World Health Organization. стр. 4. hdl:10665/42421. Посетено на 17 August 2020.
- ↑ „Chlorine dioxide“. Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ Brockway, L. O. (March 1933). „The Three-Electron Bond in Chlorine Dioxide“ (PDF). Proceedings of the National Academy of Sciences. 19 (3): 303–307. Bibcode:1933PNAS...19..303B. doi:10.1073/pnas.19.3.303. PMC 1085967. PMID 16577512.
- ↑ 5,0 5,1 Linus Pauling (1988). General chemistry. Mineola, New York: Dover Publications. стр. 264. ISBN 0-486-65622-5.
- ↑ Flesch, R.; Plenge, J.; Rühl, E. (2006). „Core-level excitation and fragmentation of chlorine dioxide“. International Journal of Mass Spectrometry. 249-250: 68–76. Bibcode:2006IJMSp.249...68F. doi:10.1016/j.ijms.2005.12.046.
- ↑ „mp-23207: ClO2 (Orthorhombic, Pbca, 61)“. Materials Project. Посетено на 2022-11-03.
- ↑ Aieta, E. Marco, and James D. Berg.
- ↑ Derby, R. I.; Hutchinson, W. S. (1953). Chlorine(IV) Oxide. Inorganic Syntheses. 4. стр. 152–158. doi:10.1002/9780470132357.ch51. ISBN 978-0-470-13235-7.
- ↑ 10,0 10,1 10,2 Vogt, H.; Balej, J.; Bennett, J. E.; Wintzer, P.; Sheikh, S. A.; Gallone, P.; Vasudevan, S.; Pelin, K., „Chlorine Oxides and Chlorine Oxygen Acids“, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a06_483.pub2
- ↑ 11,0 11,1 White, George W.; White, Geo Clifford (1999). The handbook of chlorination and alternative disinfectants (4. изд.). New York: John Wiley. ISBN 0-471-29207-9.
- ↑ Swaddle, Thomas Wilson (1997). Inorganic Chemistry: An Industrial and Environmental Perspective. Academic Press. стр. 198–199. ISBN 0-12-678550-3.
- ↑ 13,0 13,1 13,2 13,3 13,4 13,5 13,6 13,7 Alternative Disinfectants and Oxidants Manual, chapter 4: Chlorine Dioxide (PDF), US Environmental Protection Agency: Office of Water, April 1999, Архивирано од изворникот (PDF) на 2015-09-05, Посетено на 2009-11-27
- ↑ 14,0 14,1 14,2 14,3 Block, Seymour Stanton (2001). Disinfection, Sterilization, and Preservation (5. изд.). Lippincott, Williams & Wilkins. стр. 215. ISBN 0-683-30740-1.
- ↑ 15,0 15,1 Simpson, Gregory Deward (2005). Practical Chlorine Dioxide (Volume 1. изд.). Colleyville, Texas: Greg D. Simpson & Associates. ISBN 0-9771985-0-2.
- ↑ Sjöström, E. (1993). Wood Chemistry: Fundamentals and Applications. Academic Press. ISBN 0-12-647480-X. OCLC 58509724.
- ↑ „AET – Reports – Science – Trends in World Bleached Chemical Pulp Production: 1990–2005“. Архивирано од изворникот на 2017-07-30. Посетено на 2016-02-26.
- ↑ Harrel, C. G. (1952). „Maturing and Bleaching Agents in Producing Flour“. Industrial & Engineering Chemistry. 44 (1): 95–100. doi:10.1021/ie50505a030.
- ↑ Sorlini, S.; Collivignarelli, C. (2005). „Trihalomethane formation during chemical oxidation with chlorine, chlorine dioxide and ozone of ten Italian natural waters“. Desalination. 176 (1–3): 103–111. doi:10.1016/j.desal.2004.10.022.
- ↑ Li, J.; Yu, Z.; Gao, M. (1996). „A pilot study on trihalomethane formation in water treated by chlorine dioxide“. Zhonghua Yufang Yixue Zazhi (Chinese Journal of Preventive Medicine). 30 (1): 10–13. PMID 8758861.
- ↑ 21,0 21,1 21,2 Volk, C. J.; Hofmann, R.; Chauret, C.; Gagnon, G. A.; Ranger, G.; Andrews, R. C. (2002). „Implementation of chlorine dioxide disinfection: Effects of the treatment change on drinking water quality in a full-scale distribution system“. Journal of Environmental Engineering and Science. 1 (5): 323–330. doi:10.1139/s02-026.
- ↑ Pereira, M. A.; Lin, L. H.; Lippitt, J. M.; Herren, S. L. (1982). „Trihalomethanes as initiators and promoters of carcinogenesis“. Environmental Health Perspectives. 46: 151–156. doi:10.2307/3429432. JSTOR 3429432. PMC 1569022. PMID 7151756.
- ↑ 23,0 23,1 „Guidelines for drinking-water quality, 4th edition, incorporating the 1st addendum“ (англиски). World Health Organization. Посетено на 2021-11-29.
- ↑ „Chlorine dioxide as a disinfectant“. Lenntech. Посетено на 2021-11-25.
- ↑ Andrews, L.; Key, A.; Martin, R.; Grodner, R.; Park, D. (2002). „Chlorine dioxide wash of shrimp and crawfish an alternative to aqueous chlorine“. Food Microbiology. 19 (4): 261–267. doi:10.1006/fmic.2002.0493.
- ↑ Zhang, Zhe; McCann, Carole; Stout, Janet E.; Piesczynski, Steve; Hawks, Robert; Vidic, Radisav; Yu, Victor L. (2007). „Safety and Efficacy of Chlorine Dioxide for Legionella control in a Hospital Water System“ (PDF). Infection Control and Hospital Epidemiology. 28 (8): 1009–1012. doi:10.1086/518847. PMID 17620253. Архивирано од изворникот (PDF) на 2011-07-19. Посетено на 2009-11-27.
- ↑ Ogata, N.; Shibata, T. (January 2008). „Protective effect of low-concentration chlorine dioxide gas against influenza A virus infection“. Journal of General Virology. 89 (pt 1): 60–67. doi:10.1099/vir.0.83393-0. PMID 18089729.
- ↑ „Chlorine Dioxide & Chlorite | Public Health Statement | ATSDR“. United States: Centers for Disease Control and Prevention. Посетено на 2021-11-25.
- ↑ Zhang, Y.-L.; Zheng, S.-Y.; Zhi, Q. (2007). „Air Disinfection with Chlorine Dioxide in Saps“. Journal of Environment and Health. 24 (4): 245–246.
- ↑ „Anthrax spore decontamination using chlorine dioxide“. United States: Environmental Protection Agency. 2007. Посетено на 2009-11-27.
- ↑ Sy, Kaye V.; McWatters, Kay H.; Beuchat, Larry R. (2005). „Efficacy of Gaseous Chlorine Dioxide as a Sanitizer for Killing Salmonella, Yeasts, and Molds on Blueberries, Strawberries, and Raspberries“. Journal of Food Protection. International Association for Food Protection. 68 (6): 1165–1175. doi:10.4315/0362-028x-68.6.1165. PMID 15954703.
- ↑ „How we know disinfectants should kill the COVID-19 coronavirus“. Chemical & Engineering News (англиски). Посетено на 2020-03-28.
- ↑ „List N: Disinfectants for Use Against SARS-CoV-2“. Environmental Protection Agency (англиски). United States. 2020-03-13. Посетено на 2020-03-28.
- ↑ O'Brian, D. (2017). „Chlorine Dioxide Pouches Can Make Produce Safer and Reduce Spoilage“. AgResearch Magazine. USDA Agricultural Research Service (July). Посетено на 2018-06-21.
- ↑ „The truth behind the chlorinated chicken panic“. The Big Issue (англиски). 2019-05-29. Посетено на 2020-02-05.
- ↑ Coates, D. (2001). „An evaluation of the use of chlorine dioxide (Tristel One-Shot) in an automated washer/disinfector (Medivator) fitted with a chlorine dioxide generator for decontamination of flexible endoscopes“. Journal of Hospital Infection. 48 (1): 55–65. doi:10.1053/jhin.2001.0956. PMID 11358471.
- ↑ „Tristel Wipes System Product Information“ (PDF). Ethical Agents. Архивирано од изворникот (PDF) на 2016-04-15. Посетено на 2012-11-01.
- ↑ Gibbs, S. G.; Lowe, J. J.; Smith, P. W.; Hewlett, A. L. (2012). „Gaseous chlorine dioxide as an alternative for bedbug control“. Infection Control & Hospital Epidemiology. 33 (5): 495–9. doi:10.1086/665320. PMID 22476276.
- ↑ Langlois, Krista (March 13, 2018). „How to Treat Backcountry Water on the Cheap“. Sierra. Sierra Club. Посетено на 2021-02-10.
- ↑ „A Guide to Drinking Water Treatment and Sanitation for Backcountry & Travel Use“. United States: Centers for Disease Control and Prevention. April 10, 2009. Посетено на 2021-02-10.
- ↑ „Toxicological Profile for Chlorine Dioxide and Chlorite“ (PDF). Agency for Toxic Substances and Disease Registry, US HHS. Архивирано од изворникот (PDF) на 2019-06-14.
- ↑ López, María I.; Croce, Adela E.; Sicre, Juan E. (1994). „Explosive decomposition of gaseous chlorine dioxide“. J. Chem. Soc., Faraday Trans. (англиски). 90 (22): 3391–3396. doi:10.1039/FT9949003391. ISSN 0956-5000.
- ↑ „ATSDR: ToxFAQs™ for Chlorine Dioxide and Chlorite“.
- ↑ „Occupational Safety and Health Guideline for Chlorine Dioxide“. Архивирано од изворникот на 2012-12-04. Посетено на 2012-12-08.
- ↑ 45,0 45,1 „Parents are poisoning their children with bleach to 'cure' autism. These moms are trying to stop it“. NBC News (англиски). Посетено на 2019-05-21.
- ↑ „Fake news: Chlorine dioxide won't stop coronavirus“. Detroit News (англиски). Посетено на 2020-04-03.
- ↑ Friedman, Lisa (2020-04-03). „E.P.A. Threatens Legal Action Against Sellers of Fake Coronavirus Cleaners“. The New York Times (англиски). ISSN 0362-4331. Посетено на 2020-04-03.
- ↑ Spencer, Sarnac Hale. „Those coronavirus 'cures' you're hearing about? They're fake. Don't drink chlorine dioxide“. USA TODAY (англиски). Посетено на 2020-04-03.
- ↑ „Drinking bleach will not cure cancer or autism, FDA warns“. NBC News (англиски). Посетено на 2019-08-13.
- ↑ 50,0 50,1 „FDA warns consumers about the dangerous and potentially life threatening side effects of Miracle Mineral Solution“ (англиски). United States: Food and Drug Administration. 2019-08-12. Архивирано од изворникот на 2019-08-14. Посетено на 2019-08-16.
- ↑ Bartley, Lisa (2016-10-29). „Group of SoCal parents secretly try to cure kids with autism using bleach“. ABC 7 News. ABC. Посетено на 2019-03-24.
- ↑ Ryan, Frances (2016-07-13). „The fake cures for autism that can prove deadly“. The Guardian. Посетено на 2019-03-24.
- ↑ „Press Announcements – FDA Warns Consumers of Serious Harm from Drinking Miracle Mineral Solution (MMS)“. Food and Drug Administration. Архивирано од изворникот на 2017-01-12.
- ↑ „'Miracle' Treatment Turns into Potent Bleach“. U.S. Food and Drug Administration. 2015-11-20. Архивирано од изворникот на 2017-11-01. Посетено на 2017-12-06.
- ↑ „FDA Warns Consumers of Serious Harm from Drinking Miracle Mineral Solution (MMS)“. United States: Food and Drug Administration. 2011-02-03. Архивирано од изворникот на 2011-02-03. Посетено на 2018-04-05.
Надворешни врски уреди
- Media related to chlorine dioxide at Wikimedia Commons