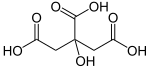
Лимонска киселина
Лимонската киселина е органско соединение со хемиска формула HOC(CO2H)(CH2CO2H)2.[9] Тоа е безбојна слаба органска киселина.[9] Природно се наоѓа во агрумите. Во биохемијата, е посредник во циклусот на лимонска киселина, кој се јавува во метаболизмот на сите аеробни организми.[9]
| |||

| |||
| Назнаки | |||
|---|---|---|---|
| 77-92-9 | |||
| ChEBI | CHEBI:30769 | ||
| ChEMBL | ChEMBL1261 | ||
| ChemSpider | 305 | ||
| DrugBank | DB04272 | ||
| EC-број | 201-069-1 | ||
| |||
| 2478 | |||
| 3Д-модел (Jmol) | Слика | ||
| KEGG | D00037 | ||
| PubChem | 311 22230 (монохидрат) | ||
| RTECS-бр. | GE7350000 | ||
| |||
| UNII | XF417D3PSL | ||
| Својства | |||
| Хемиска формула | |||
| Моларна маса | 0 g mol−1 | ||
| Изглед | бела цврста супстанца | ||
| Мирис | без мирис | ||
| Густина | 1.665 g/cm3 (анхидрид) 1.542 g/cm3 (18 °C, монохидрат) | ||
| Точка на топење | |||
| Точка на вриење | |||
| 54% w/w (10 °C) 59.2% w/w (20 °C) 64.3% w/w (30 °C) 68.6% w/w (40 °C) 70.9% w/w (50 °C) 73.5% w/w (60 °C) 76.2% w/w (70 °C) 78.8% w/w (80 °C) 81.4% w/w (90 °C) 84% w/w (100 °C)[4] | |||
| Растворливост | растворлива во ацетон, етанол, диетил етер, етил ацетат, диметил сулфоксид нерастворливс во C6H6, CHCl3, CS2, толуен[3] | ||
| Растворливост во eтанол | 62 g/100 g (25 °C)[3] | ||
| Растворливост во aмил ацетат | 4.41 g/100 g (25 °C)[3] | ||
| Растворливост во диетил етер | 1.05 g/100 g (25 °C)[3] | ||
| Растворливост во 1,4-диоксан | 35.9 g/100 g (25 °C)[3] | ||
| log P | −1.64 | ||
| Киселост (pKa) | pKa1 = 3.13[5] pKa2 = 4.76[6] pKa3 = 6.39,[7] 6.40[8] | ||
| Показател на прекршување (nD) | 1.493–1.509 (20 °C)[4] 1.46 (150 °C)[3] | ||
| Вискозност | 6.5 cP (50% aq. sol.)[4] | ||
| Структура | |||
| Кристална структура | Moноциклична | ||
| Термохемија | |||
| Ст. енталпија на формирање ΔfH |
−1543.8 kJ/mol[4] | ||
| Стандардна моларна ентропија S |
252.1 J/(mol·K) | ||
| Специфичен топлински капацитет, C | 226.51 J/(mol·K) (26.85 °C) | ||
| Pharmacology | |||
| ATC код | A09AB04 | ||
| Опасност | |||
| Безбедност при работа: | |||
Главни опасности
|
Иритација на кожата и очите | ||
| GHS-ознаки: | |||
Пиктограми
|
  [6] [6]
| ||
Сигнални зборови
|
Предупредување | ||
Изјави за опасност
|
H290, H319, H315[6] | ||
Изјави за претпазливост
|
P305+P351+P338[6] | ||
| NFPA 704 | |||
| Температура на запалување | {{{value}}} | ||
| 345 °C (653 °F; 618 K) | |||
| Граници на запалливост | 8%[6] | ||
| Смртоносна доза или концентрација: | |||
LD50 (средна доза)
|
3000 mg/kg (стаорец, oрално) | ||
| Безбедносен лист | HMDB | ||
| Дополнителни податоци | |||
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |||
| Наводи | |||
Секоја година се произведуваат повеќе од два милиони тони лимонска киселина. Широко се користи како закиселувач, како арома и хелатен агенс.[10]
Цитрат е дериват на лимонска киселина; односно солите, естерите и полиатомскиот анјон пронајдени во растворот. Пример за солта е тринатриум цитрат; естер е триетил цитрат. Кога е дел од сол, формулата на цитратниот анјон се запишува како C6H5O3−
7 или C3H5O(COO)3−
3.
Природна појава и индустриско производство уреди
Лимонската киселина се наоѓа во различни овошја и зеленчук, особено во агрумите. Лимоните и лиметите имаат особено високи концентрации на киселината; може да сочинува дури 8% од сувата тежина на овие плодови (околу 47 g/L во соковите[11]).[б 1] Концентрациите на лимонска киселина во агрумите се движат од 0,005 mol/L за портокали и грејпфрути до 0,30 mol/L во лимони и лимета; овие вредности варираат во видот во зависност од сортата и околностите под кои се одгледувал плодот.
Лимонската киселина првпат била изолирана во 1784 година од хемичарот Карл Вилхелм Шеле, кој ја кристализирал од сок од лимон.[12][13]
Производството на лимонска киселина во индустриски размери првпат започнало во 1890 година врз основа на италијанската индустрија за цитрусно овошје, каде што сокот бил третиран со хидриран вар (калциум хидроксид) за да се таложи калциум цитрат, кој бил изолиран и повторно претворен во киселина користејќи разредена сулфурна киселина.[14] Во 1893 година, C. Wehmer открил дека пеницилиумската мувла може да произведе лимонска киселина од шеќер. Сепак, микробното производство на лимонска киселина не станало индустриски важно сè додека не се нарушил италијанскиот извоз на цитрус за време на Првата светска војна.
Во 1917 година, американскиот хемичар за храна Џејмс Кари открил дека одредени видови на мувла Aspergillus niger може да бидат ефикасни производители на лимонска киселина,[15] и фармацевтската компанија Pfizer започнала со производство на индустриско ниво користејќи ја оваа техника две години подоцна, проследено со Citrique Belge во 1929 год. сахароза или медиум што содржи гликоза за производство на лимонска киселина. Изворот на шеќер е пченкарен пијалак, меласа, хидролизиран пченкарен скроб или друг евтин, зашеќерен раствор.[16] Откако мувлата се филтрира од добиениот раствор, лимонската киселина се изолира со таложење со калциум хидроксид за да се добие калциум цитратна сол, од која лимонската киселина се регенерира со третман со сулфурна киселина, како и при директното екстракција од сок од цитрусно овошје.
Во 1977 година, бил доделен патент на Lever Brothers за хемиска синтеза на лимонска киселина, почнувајќи или од аконитни или изоцитратни/алоидоцитратни калциумови соли под услови на висок притисок; ова произвело лимонска киселина во речиси квантитативна конверзија под она што изгледало како обратна, неензимска реакција на Кребсовиот циклус.[17]
Глобалното производство било над 2.000.000 тони во 2018 година.[18] Повеќе од 50% од овој волумен е произведен во Кина. Повеќе од 50% се користел како регулатор на киселост во пијалоци, околу 20% во други прехранбени апликации, 20% за детергенти и 10% за други апликации освен храна, како што се козметика, фармацевтски производи и во хемиската индустрија.[14]
Хемиски одлики уреди
Лимонската киселина може да се добие како анхидрид (без вода) или како монохидрат. Анхидридната форма се кристализира од топла вода, додека монохидратот се формира кога лимонската киселина се кристализира од ладна вода. Монохидратот може да се претвори во анхидридна форма на околу 78 °C. Лимонската киселина се раствора и во апсолутен (безводен) етанол (76 делови од лимонска киселина на 100 делови од етанол) на 15 °C. Се распаѓа со губење на јаглерод диоксид над околу 175 °C.
Лимонската киселина е трибазна киселина, со pKa вредности, екстраполирани на нула јонска јачина, од 3,128, 4,761 и 6,396 на 25 °C.[19] Утврдено е, со помош на спектроскопија 13C NMR, дека pKa на хидроксилната група, е 14,4.[20] Специјацискиот дијаграм покажува дека растворите на лимонска киселина се пуферски раствори помеѓу околу pH 2 и pH 8. Во биолошките системи околу pH 7, присутни се двата вида, цитрат јон и моно-водороден цитрат јон. SSC 20X хибридизацискиот пуфер е пример за вообичаена употреба.[21] Табели составени за биохемиски студии[22] се достапни.
Од друга страна, pH на 1 mM раствор на лимонска киселина ќе биде околу 3,2. pH на овошните сокови од агруми како портокали и лимони зависи од концентрацијата на лимонска киселина, при што повисока концентрација на лимонска киселина резултира со пониска pH вредност.
Киселите соли на лимонската киселина може да се подготват со внимателно прилагодување на pH вредноста пред да се кристализира соединението. Видете, на пример, натриум цитрат.
Цитратниот јон формира комплекси со метални катјони. Константите на стабилност за формирање на овие комплекси се доста големи поради хелатниот ефект. Следствено, формира комплекси дури и со катјони на алкални метали. Меѓутоа, кога се формира хелатен комплекс со користење на сите три карбоксилатни групи, хелатните прстени имаат 7 и 8 членови, кои генерално се помалку стабилни термодинамички од помалите хелатни прстени. Како последица на тоа, хидроксилната група може да се депротонира, формирајќи дел од постабилен 5-член прстен, како кај амониум железен цитрат,(NH4)5Fe(C6H4O7)2·2H2O.[23]
Лимонската киселина може да се естерифицира во една или повеќе од нејзините три групи на карбоксилна киселина за да формира која било од различните моно-, ди-, три- и мешани естери.[24]
Биохемија уреди
Циклус на лимонска киселина уреди
Цитратот е посредник во циклусот на лимонска киселина, исто така познат како циклус TCA (TriCarboxylic Acid) или циклус на Кребс, централен метаболички пат за животните, растенијата и бактериите. Цитрат синтаза ја катализира кондензацијата на оксалоацетат со ацетил CoA за да формира цитрат. Цитратот потоа делува како супстрат за аконитаза и се претвора во аконитна киселина. Циклусот завршува со регенерација на оксалоацетат. Оваа серија на хемиски реакции е извор на две третини од енергијата добиена од храна во повисоките организми. За ова откритие Ханс Адолф Кребс ја доби Нобеловата награда за физиологија или медицина во 1953 година.
Некои бактерии (особено E. coli) можат внатрешно да произведуваат и консумираат цитрат како дел од нивниот циклус на TCA, но не можат да го користат како храна бидејќи им недостасуваат ензими потребни за да го внесат во клетката. По десетици илјади еволуции во медиум со минимална гликоза кој исто така содржел цитрат за време на долгорочниот експеримент за еволуција на Ричард Ленски, варијантата E. coli еволуирала со способност да расте аеробно на цитрат. Захари Блаунт, студент на Ленски и неговите колеги ги проучувале овие „Cit+“ E. coli[25][26] како модел за тоа како еволуираат новите особини. Тие пронашле докази дека, во овој случај, иновацијата е предизвикана од ретка мутација за дуплирање поради акумулацијата на неколку претходни „поттикнувачки“ мутации, чиј идентитет и ефекти се уште се испитуваат. Еволуцијата на одликата Cit+ се смета за значаен пример за улогата на историската непредвидливост во еволуцијата.
Други биолошки улоги уреди
Цитратот може да се транспортира надвор од митохондриите и во цитоплазмата, потоа да се разложи на ацетил-CoA за синтеза на масни киселини и во оксалоацетат. Цитратот е позитивен модулатор на оваа конверзија и алостерски го регулира ензимот ацетил-CoA карбоксилаза, кој е регулирачки ензим во конверзијата на ацетил-CoA во малонил-CoA (чекор на посветеност во синтезата на масни киселини). Накратко, цитратот се транспортира во цитоплазмата, се претвора во ацетил-CoA, кој потоа се претвора во малонил-CoA со ацетил-CoA карбоксилаза, која е алостерски модулирана со цитрат.
Високите концентрации на цитозолен цитрат може да ја инхибираат фосфофруктокиназата, катализаторот на чекорот на гликолиза со ограничување на брзината. Овој ефект е поволен: високите концентрации на цитрат покажуваат дека постои голема понуда на биосинтетички прекурсорски молекули, така што нема потреба фосфофруктокиназата да продолжи да испраќа молекули од својот супстрат, фруктоза 6-фосфат, во гликолиза. Цитратот делува така што го зголемува инхибиторниот ефект на високите концентрации на ATP, уште еден знак дека нема потреба да се спроведува гликолиза.[27]
Цитратот е витална компонента на коските, помагајќи да се регулира големината на кристалите на апатит.[28]
Апликација уреди
Храна и пијалоци уреди
Бидејќи е една од посилните киселини за јадење, доминантната употреба на лимонската киселина е како ароматизирање и конзерванс во храната и пијалоците, особено безалкохолните пијалоци и бонбоните.[14] Во рамките на Европската Унија се означува со Е број E330. Цитратните соли на различни метали се користат за доставување на тие минерали во биолошки достапна форма во многу додатоци во исхраната. Лимонска киселина има 247 kcal на 100 g.[29] Во Соединетите Држави, барањата за чистота за лимонската киселина како додаток на храна се дефинирани со Кодексот за хемикалии за храна, кој е објавен од Фармакопеја на Соединетите Американски Држави (USP).
Лимонската киселина може да се додаде во сладолед како средство за емулгирање за да се спречи раздвојување на мастите, во карамела за да се спречи кристализација на сахарозата или во рецепти наместо свеж сок од лимон. Лимонската киселина се користи со натриум бикарбонат во широк опсег на шумливи формули, и за голтање (на пр., прашоци и таблети) и за лична нега (на пример, соли за капење, бомби за капење и чистење од маснотии). Лимонската киселина што се продава во сува прашкаста форма најчесто се продава на пазарите и намирниците како „кисела сол“, поради нејзината физичка сличност со кујнската сол. Се користи во кулинарски апликации, како алтернатива на оцет или сок од лимон, каде што е потребна чиста киселина. Лимонската киселина може да се користи во бојата на храната за да се балансира pH нивото на нормално основната боја
Средство за чистење уреди
Лимонската киселина е одличен хелатен агенс, ги врзува металите така што ги прави растворливи. Се користи за отстранување и спречување на таложење на бигор од котлите и испарувачите.[14] Може да се користи за третман на вода, што го прави корисен за подобрување на ефикасноста на сапуните и детергентите за перење. Со хелирање на металите во тврда вода, им овозможува на овие средства за чистење да произведуваат пена и да работат подобро без потреба од омекнување на водата. Лимонската киселина е активна состојка во некои раствори за чистење на бањи и кујна. Растворот со шест проценти концентрација на лимонска киселина ќе ги отстрани дамките од тврда вода од стаклото без чистење. Лимонската киселина може да се користи во шампон за миење на восокот и бојата од косата. Како илустрација за нејзините хелатни способности, лимонската киселина била првиот успешен елуент што се користел за целосно раздвојување на лантанидите со јонска размена, за време на проектот Менхетен во 1940-тите.[32] In the 1950s, it was replaced by the far more efficient[33] EDTA.
Во индустријата се користи за растворање на 'рѓа од челик и за пасивирање на нерѓосувачките челици.[34]
Козметика, фармацевтски производи, суплементи и храна уреди
Лимонската киселина се користи како ацидуланс во креми, гелови и течности. Се користи во храна и додатоци во исхраната, може да се класифицира како помагало за преработка доколку е додаден заради технички или функционален ефект (на пр. киселински, хелатор, вискозификатор итн.). Ако сè уште е присутен во незначителни количини, а техничкиот или функционалниот ефект повеќе не е присутен, може да биде ослободен од означување <21 CFR §101.100(c)>.
Лимонската киселина е алфа хидрокси киселина и е активна состојка во хемискиот пилинг на кожата.[35]
Лимонската киселина најчесто се користи како пуфер за зголемување на растворливоста на кафеавиот хероин.[36]
Лимонската киселина се користи како една од активните состојки во производството на марамици за лице со антивирусни својства.[37]
Друга употреба уреди
Пуферирачките својства на цитратите се користат за контрола на pH во средствата за чистење домаќинства и фармацевтските производи.
Лимонската киселина се користи како алтернатива на белиот оцет без мирис за боење на ткаенина со кисели бои.
Натриум цитратот е компонента на Бенедиктовиот реагенс, кој се користи и за квалитативна и за квантитативна идентификација на редукционите шеќери.[38]
Лимонската киселина може да се користи како алтернатива на азотна киселина при пасивација на нерѓосувачки челик.[39]
Лимонска киселина/калиум-натриум цитрат може да се користи како регулатор на киселина во крвта. Лимонската киселина е вклучена за да се подобри вкусноста[40]
Лимонската киселина е одличен флукс за лемење,[41] или сув или како концентриран раствор во вода. Треба да се отстрани по лемењето, особено со фини жици, бидејќи е благо корозивен. Се раствора и брзо се исплакнува во топла вода.
Алкалниот цитрат може да се користи како инхибитор на камења во бубрезите со зголемување на нивото на цитрат во урината, корисен за спречување на камења од калциум и зголемување на pH на урината, корисен за спречување на урична киселина и цистински камења.[42]
Синтеза на други органски соединенија уреди
Лимонската киселина е разновиден претходник на многу други органски соединенија. Патиштата на дехидрација даваат итаконска киселина и нејзиниот анхидрид.[43] Цитраконската киселина може да се произведе преку термичка изомеризација на анхидрид на итаконска киселина.[44] Потребниот анхидрид на итаконска киселина се добива со сува дестилација на лимонска киселина. Аконитната киселина може да се синтетизира со дехидрација на лимонска киселина со употреба на сулфурна киселина:[45]
- (HO2CCH2)2C(OH)CO2H → HO2CCH=C(CO2H)CH2CO2H + H2O
Ацетодикарбоксилната киселина може да се подготви и со декарбонилација на лимонска киселина во испарувана сулфурна киселина.[46]
Безбедност уреди
Иако е слаба киселина, изложеноста на чиста лимонска киселина може да предизвика негативни ефекти. Вдишувањето може да предизвика кашлица, отежнато дишење или болки во грлото. Прекумерното голтање може да предизвика абдоминална болка и болки во грлото. Изложеноста на концентрирани раствори на кожата и очите може да предизвика црвенило и болка.[47] Долготрајното или повеќекратното консумирање може да предизвика ерозија на забната глеѓ.[47][48][49]
Белешки за објаснување уреди
- ↑ This still does not make the lemon particularly strongly acidic. This is because, as a weak acid, most of the acid molecules are not dissociated so not contributing to acidity inside the lemon or its juice.
Наводи уреди
- ↑ 1,0 1,1 International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. стр. 747. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ↑ CID 22230 from PubChem
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 „citric acid“. chemister.ru. Архивирано од изворникот на November 29, 2014. Посетено на June 1, 2014.
- ↑ 4,0 4,1 4,2 4,3 CID 311 from PubChem
- ↑ name="sigma"
- ↑ 6,0 6,1 6,2 6,3 6,4 Fisher Scientific, Citric acid. Retrieved on 2014-06-02.
- ↑ „Data for Biochemical Research“. ZirChrom Separations, Inc. Посетено на January 11, 2012.
- ↑ „Ionization Constants of Organic Acids“. Michigan State University. Посетено на January 11, 2012.
- ↑ 9,0 9,1 9,2 „Citric acid | C6H8O7 - PubChem“. Архивирано од изворникот на January 19, 2022. Посетено на December 19, 2021.
- ↑ Apleblat, Alexander (2014). Citric acid. Springer. ISBN 978-3-319-11232-9.
- ↑ Penniston KL, Nakada SY, Holmes RP, Assimos DG (2008). „Quantitative Assessment of Citric Acid in Lemon Juice, Lime Juice, and Commercially-Available Fruit Juice Products“. Journal of Endourology. 22 (3): 567–570. doi:10.1089/end.2007.0304. PMC 2637791. PMID 18290732.
- ↑ Scheele, Carl Wilhelm (1784). „Anmärkning om Citron-saft, samt sätt at crystallisera densamma“ [Note about lemon juice, as well as ways to crystallize it]. Kungliga Vetenskaps Academiens Nya Handlingar [New Proceedings of the Royal Academy of Science]. 2nd series (шведски). 5: 105–109.
- ↑ Graham, Thomas (1842). Elements of chemistry, including the applications of the science in the arts. Hippolyte Baillière, foreign bookseller to the Royal College of Surgeons, and to the Royal Society, 219, Regent Street. стр. 944. Посетено на June 4, 2010.
- ↑ 14,0 14,1 14,2 14,3 Verhoff, Frank H.; Bauweleers, Hugo (2014), „Citric Acid“, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a07_103.pub3
- ↑ Currie, James (1917). The Journal of Biological Chemistry (англиски). American Society for Biochemistry and Molecular Biology. стр. 15–27.
- ↑ Lotfy, Walid A.; Ghanem, Khaled M.; El-Helow, Ehab R. (2007). „Citric acid production by a novel Aspergillus niger isolate: II. Optimization of process parameters through statistical experimental designs“. Bioresource Technology. 98 (18): 3470–3477. doi:10.1016/j.biortech.2006.11.032. PMID 17317159.
- ↑ US 4056567-V.Lamberti and E.Gutierrez
- ↑ „Global Citric Acid Markets Report, 2011-2018 & 2019-2024“. prnewswire.com. 19 March 2019. Посетено на 28 October 2019.
- ↑ Goldberg, Robert N.; Kishore, Nand; Lennen, Rebecca M. (2002). „Thermodynamic Quantities for the Ionization Reactions of Buffers“. J. Phys. Chem. Ref. Data. 31 (1): 231–370. Bibcode:2002JPCRD..31..231G. doi:10.1063/1.1416902. S2CID 94614267.
- ↑ Silva, Andre M. N.; Kong, Xiaole; Hider, Robert C. (2009). „Determination of the pKa value of the hydroxyl group in the α-hydroxycarboxylates citrate, malate and lactate by 13C NMR: implications for metal coordination in biological systems“. Biometals. 22 (5): 771–778. doi:10.1007/s10534-009-9224-5. PMID 19288211. S2CID 11615864.
- ↑ Maniatis, T.; Fritsch, E. F.; Sambrook, J. 1982. Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory, Cold Spring Harbor, NY.
- ↑ Gomori, G. (1955). „16 Preparation of buffers for use in enzyme studies“. Methods in Enzymology Volume 1. Methods in Enzymology. 1. стр. 138–146. doi:10.1016/0076-6879(55)01020-3. ISBN 9780121818012.
- ↑ Matzapetakis, M.; Raptopoulou, C. P.; Tsohos, A.; Papaefthymiou, V.; Moon, S. N.; Salifoglou, A. (1998). „Synthesis, Spectroscopic and Structural Characterization of the First Mononuclear, Water Soluble Iron−Citrate Complex, (NH4)5Fe(C6H4O7)2·2H2O“. J. Am. Chem. Soc. 120 (50): 13266–13267. doi:10.1021/ja9807035.
- ↑ Bergeron, Raymond J.; Xin, Meiguo; Smith, Richard E.; Wollenweber, Markus; McManis, James S.; Ludin, Christian; Abboud, Khalil A. (1997). „Total synthesis of rhizoferrin, an iron chelator“. Tetrahedron. 53 (2): 427–434. doi:10.1016/S0040-4020(96)01061-7.
- ↑ Powell, Alvin (February 14, 2014). „59,000 generations of bacteria, plus freezer, yield startling results“. phys.org. Посетено на April 13, 2017.
- ↑ Blount, Z. D.; Borland, C. Z.; Lenski, R. E. (4 June 2008). „Historical contingency and the evolution of a key innovation in an experimental population of Escherichia coli“. Proceedings of the National Academy of Sciences. 105 (23): 7899–7906. Bibcode:2008PNAS..105.7899B. doi:10.1073/pnas.0803151105. PMC 2430337. PMID 18524956.
- ↑ Stryer, Lubert; Berg, Jeremy; Tymoczko, John (2003). „Section 16.2: The Glycolytic Pathway Is Tightly Controlled“. Biochemistry (5. ed., international ed., 3. printing. изд.). New York: Freeman. ISBN 978-0716746843.
- ↑ Hu, Y.-Y.; Rawal, A.; Schmidt-Rohr, K. (December 2010). „Strongly bound citrate stabilizes the apatite nanocrystals in bone“. Proceedings of the National Academy of Sciences. 107 (52): 22425–22429. Bibcode:2010PNAS..10722425H. doi:10.1073/pnas.1009219107. PMC 3012505. PMID 21127269.
- ↑ Greenfield, Heather; Southgate, D.A.T. (2003). Food Composition Data: Production, Management and Use. Rome: FAO. стр. 146. ISBN 9789251049495.
- ↑ Xiang Hao, Yongge Wei, Shiwei Zhang (2001): "Synthesis, crystal structure and magnetic property of a binuclear iron(III) citrate complex". Transition Metal Chemistry, volume 26, issue 4, pages 384–387. doi:10.1023/A:1011055306645
- ↑ Shweky, Itzhak; Bino, Avi; Goldberg, David P.; Lippard, Stephen J. (1994). „Syntheses, Structures, and Magnetic Properties of Two Dinuclear Iron(III) Citrate Complexes“. Inorganic Chemistry. 33 (23): 5161–5162. doi:10.1021/ic00101a001.
- ↑ JOHNSON, WARREN C.; QUILL, LAURENCE L.; DANIELS, FARRINGTON (1947-09-01). „Rare Earths Separation Developed on Manhattan Project“. Chemical & Engineering News Archive. 25 (35): 2494. doi:10.1021/cen-v025n035.p2494. ISSN 0009-2347.
- ↑ Saleem, Muhammad Hamzah; Ali, Shafaqat; Rehman, Muzammal; Rizwan, Muhammad; Kamran, Muhammad; Mohamed, Ibrahim A.A.; Khan, Zaid; Bamagoos, Atif A.; Alharby, Hesham F.; Hakeem, Khalid Rehman; Liu, Lijun (2020-08-01). „Individual and combined application of EDTA and citric acid assisted phytoextraction of copper using jute (Corchorus capsularis L.) seedlings“. Environmental Technology & Innovation (англиски). 19: 100895. doi:10.1016/j.eti.2020.100895. ISSN 2352-1864. S2CID 219432688.
- ↑ „ASTM A967 / A967M - 17 Standard Specification for Chemical Passivation Treatments for Stainless Steel Parts“. www.astm.org.
- ↑ Tang, Sheau-Chung; Yang, Jen-Hung (2018-04-10). „Dual Effects of Alpha-Hydroxy Acids on the Skin“. Molecules. 23 (4): 863. doi:10.3390/molecules23040863. ISSN 1420-3049. PMC 6017965. PMID 29642579.
- ↑ Strang J, Keaney F, Butterworth G, Noble A, Best D (April 2001). „Different forms of heroin and their relationship to cook-up techniques: data on, and explanation of, use of lemon juice and other acids“. Subst Use Misuse. 36 (5): 573–88. doi:10.1081/ja-100103561. PMID 11419488. S2CID 8516420.
- ↑ „Tissues that fight germs“. CNN. July 14, 2004. Посетено на May 8, 2008.
- ↑ Chen, Wei; Abramowitz, Matthew K. (February 2014). „Treatment of Metabolic Acidosis in Patients With CKD“. American Journal of Kidney Diseases. 63 (2): 311–317. doi:10.1053/j.ajkd.2013.06.017. ISSN 0272-6386. PMC 3946919. PMID 23932089.
- ↑ „Pickling and Passivating Stainless Steel“ (PDF). Euro-inox.org. Архивирано од изворникот (PDF) на September 12, 2012. Посетено на 2013-01-01.
- ↑ PubChem. „Sodium citrate“. pubchem.ncbi.nlm.nih.gov (англиски). Посетено на 2021-08-02.
- ↑ „An Investigation of the Chemistry of Citric Acid in Military Soldering Applications“ (PDF). 1995-06-19. Архивирано (PDF) од изворникот March 15, 2020.
- ↑ Berg, C.; Larsson, L.; Tiselius, H. G. (1992). „The effects of a single evening dose of alkaline citrate on urine composition and calcium stone formation“. The Journal of Urology. 148 (3 Pt 2): 979–985. doi:10.1016/s0022-5347(17)36795-2. ISSN 0022-5347. PMID 1507355.
- ↑ R. L. Shriner; S. G. Ford; l. J. Roll (1931). „Itaconic anhydride and itaconic acid“. Org. Synth. 11: 70. doi:10.15227/orgsyn.011.0070.
- ↑ R. L. Shriner; S. G. Ford; l. J. Roll (1931). „Citraconic Anhydride and Citraconic Acid“. Org. Synth. 28: 28. doi:10.15227/orgsyn.011.0028.
- ↑ Bruce, W. F. (1937). „Aconitic Acid“. Organic Syntheses. 17: 1. doi:10.15227/orgsyn.017.0001.
- ↑ Roger Adams; H. M. Chiles; C. F. Rassweiler (1925). „Acetonedicarboxylic Acid“. Organic Syntheses. 5: 5. doi:10.15227/orgsyn.005.0005.
- ↑ 47,0 47,1 „Citric acid“. International Chemical Safety Cards. NIOSH. 2018-09-18. Архивирано од изворникот на July 12, 2018. Посетено на September 9, 2017.
- ↑ J. Zheng; F. Xiao; L. M. Qian; Z. R. Zhou (December 2009). „Erosion behavior of human tooth enamel in citric acid solution“. Tribology International. 42 (11–12): 1558–1564. doi:10.1016/j.triboint.2008.12.008.
- ↑ „Effect of Citric Acid on Tooth Enamel“.
Надворешни врски уреди
- Лимонска киселина на Ризницата ?